

|
|
R1 |
|
|
|
|
R3 |
R |
|
PdLnX + |
|
|
|
|
R4 |
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
R2 |
|
|
|
|
IV.7 Carbopalladation of Allenes
SHENGMING MA
A. INTRODUCTION
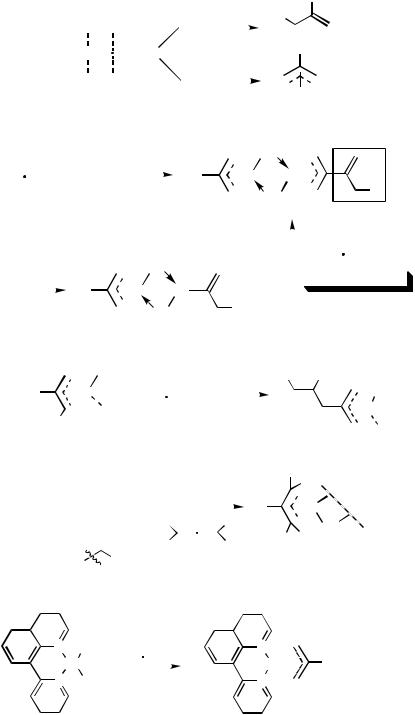
There are, in principle, two pathways for the carbopalladation reaction of allenes depending on the regiochemistry of the insertion reaction of the C—Pd bond into one of the two cumulated CRC bonds (Scheme 1). Following Path I, the reaction would afford a Csp2—Pd species 1, while a -allylpalladium species 2 could be formed via Path II.
A.i. Formation of -Allylpalladium Species via Stoichiometric Reactions of Carbon–Palladium Species with Allenes: Regiochemistry
of Carbopalladations of Allenes
Schultz discovered the first example of a carbopalladation of allenes when PdCl2(PhCN)2 was added to 1,2-propadiene to form the -allylpalladium complex 3, which was confirmed by the 1H NMR spectra (Scheme 2).[1],[2]In this case the first step is the chloropalladation of propadiene to form the -allylpalladium complex 4,[3] of which the Csp2—Pd bond reacted further with another molecule of propadiene to afford the final product 3.
In 1968, van Helden and co-workers studied the corresponding carbopalladation reaction of 1,2-propadiene with the -allylpalladium species 5, affording 3-(2-(2 - alkenyl)allyl)palladium complex 6 (Scheme 3).[4]–[6]Similar results were observed by Hughes and Powell.[7],[8] The rate-determining step for these insertion reactions is the actual insertion step, not the coordination of the 1,2-diene onto Pd.[9]
The stoichiometric reactions of palladium species other than -allylpalladium complexes with allenes have also been observed with similar regioselectivity to afford - allylpalladium species (Scheme 4).[10]–[14]
The regiochemistry of this carbopalladation has been further confirmed by the X-ray crystal structure analysis of complex 10, which was formed by the reaction of the methylpalladium chloride complex 9 with propadiene (Scheme 5).[15]
A.ii. Reactivities of -Allylpalladium Species Formed via Carbopalladation of Allenes: Outline of Possible Reactions
Based on the above stoichiometric reaction of organylpalladium species with allenes, it is believed that, in most cases, the carbon atom originally connected with Pd in the initial
Handbook of Organopalladium Chemistry for Organic Synthesis, Edited by Ei-ichi Negishi ISBN 0-471-31506-0 © 2002 John Wiley & Sons, Inc.
1491
1492 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pd+ |
|||
|
|
|
|
R |
|
|
Pd |
|
Path I |
|
|
R |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Path II |
|
|
|
R |
||||||
|
|
|
|
Pd |
|
|
|
R |
|
|
|
|
|
Pd+ |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PdCl2(PhCN)2 |
|
|
|
|
|
Cl |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
Cl |
|
Pd |
Pd |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
carbopalladation |
|||||||||||||||||||
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
Pd |
Pd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
R2 |
|
|
|
|
|
|
|
|||||||||||
R2 |
|
|
Pd |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
R1 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
Pd |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R4 |
R3 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
[ PdCl (Y) (COD) ] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Y |
|
Pd |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
R1 |
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
7 |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
n |
|||||||||||||||
|
Y = Me, |
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
|
|
|
|
R4 |
|
|
|
R1 |
R2 |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
Cl− |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
Pd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pd |
|
|
|
Me |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
N |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
IV.7 CARBOPALLADATION OF ALLENES |
1493 |
Pd species forms a C,C bond with the central carbon atom of the allene moiety; thus, the carbopalladation reaction of allenes provides an efficient entry to versatile and reactive-allylpalladium species. Extensive studies have been carried out for the Pd-catalyzed reactions involving allenes (Scheme 6).
|
|
Pd(0) |
|
+ RX |
|
|
|
|
|
|
|
|
|
R |
|||||
|
|
|
|
|
|
|
|
β-H |
|
|
R1 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
elimination |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
R4 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
R |
14 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
RPdX |
|
|
|
R1 |
HPdX |
|
|||||||||||
|
|
|
|
|
|
|
CH2R3 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
11 |
|
|
|
|
|
|
|
|
|
base |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 + |
|
CH2R3 |
|
R2 |
Pd R4 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
L |
|
L |
|
Pd(0) |
|
|
|||
|
|
|
|
|
|
|
|
R4 |
|
|
13 |
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
|
|
R |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_ |
|
|
|
CH2R3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nu |
|
|
|
R2 |
R4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
CH2R3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
Nu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16 |
||||
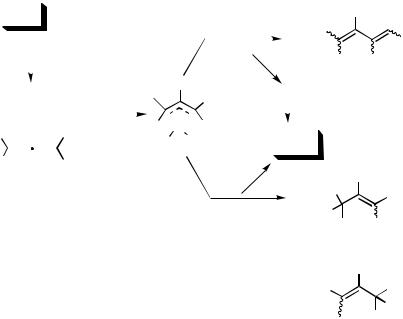
Scheme 6
Palladium intermediates of type 11 can easily be generated via an oxidative addition of suitable organic halide onto a zerovalent palladium complex. The insertion reaction of 11 into a double bond of the allene 12 affords the -allyl complex 13, which can undergo either a -hydride elimination or a nucleophilic substitution to afford organic product(s) and regenerate the zerovalent palladium species. Thus, new methodologies based on catalytic intermoleclar or intramolecular reactions involving allenes can be designed. In limited cases, Path I-type carbopalladation reactions have also been observed (vide infra).
B. INTERMOLECULAR CARBOPALLADATION OF ALLENES FOLLOWED BY -HYDRIDE ELIMINATION REACTION
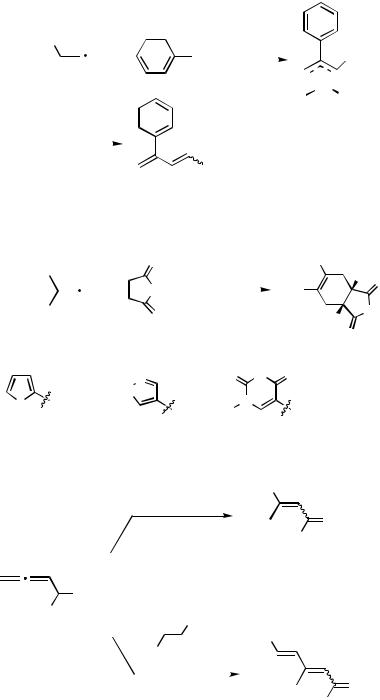
Shimizu and Tsuji reported the first catalytic carbopalladation reaction of allenes in 1984. The reaction of PhI with 1,2-heptadiene in the presence of Pd(OAc)2, dppe, and N- methylpyrrolidine (NMP) as the base gave 2-phenyl-1,3-heptadiene 18 (Scheme 7) via the -hydride elimination from the -allylpalladium intermediate 17.[16]
The 1,3-dienes formed could be trapped in situ with a dienophile to form an additional six-membered ring via a Diels–Alder reaction (Scheme 8).[17]
The corresponding reaction with 2,3-dienyl alcohols 21 provided a new entry to substituted enal/enone 22, dienal/dienone 23 (Scheme 9).[18]
1494 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
|
n-Bu |
+ |
|
|
|
|
I |
Pd(OAc)2, dppe |
|
|
n-Bu |
||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pd |
L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
||
|
|
β-H elimination |
|
|
|
|
|
|
|
|
|
|
|
|
17 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|
n-Pr |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 7 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
Pd(OAc)2, PPh3, |
Me |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag2CO3, |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
toluene |
|
|
|
|
|
O |
||
ArI |
+ |
|
|
|
|
|
|
|
+ |
|
|
NMe |
|
|
|
|
Ar |
|
|||||||
|
|
|
|
|
|
|
|
|
120 °C |
|
|
|
|
NMe |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
H |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19 |
|
|
|
|
|
|
|
20 |
O |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
|
|
|
|
||
Ar = |
84% |
|
|
|
N |
|
|
50% |
O |
N O |
|
|
|||||||||||||
|
TsN |
|
|
|
N |
65% |
|
|
|||||||||||||||||
|
S |
|
|
|
|
|
|
|
|
Me |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 8
PhI, NMP, DMSO cat. Pd(OAc)2, dppe
110 °C
|
OH |
||||
R |
|
|
|
Br |
|
21 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
R = H, Ph, i-Bu |
|
Ph |
|||
|
|
NMP, DMSO |
|||
|
|
|
|
||
|
|
cat. Pd(OAc)2, dppe |
|||
110 °C
Ph
O
R
22
R = H, 0.8 h, 88%, Z/E = 3:7 R = Ph, 1.5 h, 65%, E
Ph
O
23 R
R = Ph, 1.5 h, 94%, Z /E = 1:2
R = i-Bu, 4 h, 77%, Z /E = 1:2
Scheme 9
IV.7 CARBOPALLADATION OF ALLENES |
1495 |
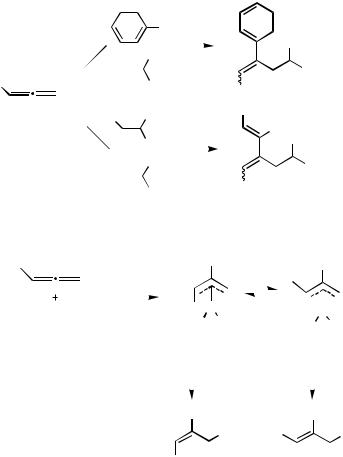
C. INTERMOLECULAR CARBOPALLADATION OF ALLENES FOLLOWED BY INTERMOLECULAR NUCLEOPHILIC TRAPPING
In Sect. B, the intermolecular carbopalladations of allenes are followed by a -hydride elimination to afford a 1,3-diene. However, in the presence of a nucleophile, a Tsuji–Trost-type nucleophilic substitution of the intermediate -allylpalladium species[19]–[21] has been fully established (Scheme 6).
Shimizu and Tsuji[16] and Cazes, Goré, and co-workers[22]–[25] reported the first examples of such transformations in 1984. The Pd(0)-catalyzed reactions of either an aryl halide (bromide or iodide) or an alkenyl bromide with a 1,2-diene in the presence of sodium diethyl malonate afforded styrene derivatives 24 and 1,3-diene derivatives 25, respectively (Scheme 10).[22]–[25]
In these kinds of transformations, the configuration of the newly formed carbon–carbon double bond in either 24 or 25 depends on the relative stabilities of the two -allylpalladium species anti-26 and syn-26 (Scheme 11).[25],[26]
R1
R = H, n-C7H15
R1
R2X
|
|
|
|
|
|
|
|
|
|
|
|
|
X , |
Pd(0) |
|
|
|
CO2Et |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Na |
|
|
|
|
|
|
CO2Et |
|
|
|
|
|
R |
1 |
|
|
CO2Et |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
R2 |
|
|
|
|
R |
3 |
|
|
|
|
|
R2 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
, Pd(0) |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
CO2Et |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
|
|
|
|
|
|
|
|
|
CO2Et |
|||||||
|
|
Na |
|
|
|
|
|
CO2Et |
|
|
|
|
|
R1 |
25 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 10 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
||||||
cat. Pd(0) |
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 Pd+ |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pd+ |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L L |
|
|
|
L |
L |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
anti -26 |
|
|
|
syn -26 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nu − |
|
|
|
|
Nu − |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
R2 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nu |
|
|
R1 |
Nu |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 E-27 |
|
|
|
Z-27 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Z and E refer to R1 |
and R2 |
|
|
|
|||||||||||
Scheme 11
1496 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
In these cases the interactions between R1 and R2 play the major role to determine the stereochemical outcome of the sequence of an intermolecular carbopalladation and an intermolecular nucleophilic trapping. Some typical results are listed in Scheme 12. In the case of 29, the methyl group at the 2-position of the alkenyl bromide clearly shifts the equilibrium between anti-26 and syn-26 exclusively to anti-26 (Scheme 12).[23]
 I
I
4 mol % Pd(dba)2 -dppe
66 °C , 14 h
71%
n-C7 H15
+
R
NaCH(CO2Et)2
Br , as above
R = Me, E / Z = 100:0, 85%
R = H, E / Z = 50:50, 75%
Scheme 12
CO2Et
 CO2Et
CO2Et
n-C7 H15
28
E / Z = 85:15
R
CO2Et
 CO2Et
CO2Et
n-C7 H15
29
Using trimethylsilyl-substituted vinyl bromides, the carbopalladation – intermolecular trapping protocol afforded trimethylsilyl-substituted 1,3-dienes 30/31 and 2-alkenyl-allyl silane 32, which could be used for further elaboration (Scheme 13).[27]
Under the catalysis of Pd(dba)2 and PPh3, the reaction of 1-hexynyl bromide with deca- 1,2-diene and nucleophiles afforded enyne derivatives such as 35 and 36 (Scheme 14).[28]
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SiMe3 |
|
|
|
|
|
|
|
|
|
|
SiMe3 |
|
4 mol % Pd(dba)2, dppe |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
+ |
|
THF, NaCHZZ′ |
30 |
CHZZ′ |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
75% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
as above, but |
Me3Si |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DMSO |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
Me3Si |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CHZZ′ |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
31 |
69% |
|
|
|
|
|
|
|
|
|
|
|
|
as above |
|
|
|
CO2Me |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
THF, Na |
|
|
|
|
Me |
|
CO2Et |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
+ |
Me3Si |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
85% |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me3Si |
CO2Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||||
|
|
|
|
|
|
|
|
|
|
CO2Et |
|
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
TiCl4 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
Me |
|
|
|
CH2Cl2, |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
32 |
|
|
|
_78 °C, |
|
|
|
|
|
|
|
33 49% |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 h |
|
|
|
|
|
|
|
|
|
||||
Scheme 13
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IV.7 CARBOPALLADATION OF ALLENES 1497 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bu-n |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cat. Pd(dba)2, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
n-C |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PPh3 |
n-C7H15 |
|
|
|
|
|
||
7 |
|
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
n-C4H9 |
|
|
|
|
|
|
Br |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
34 |
|
b |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bu-n |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Bu-n |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Na+ −CH(COOMe)2 |
|
|
|
|
|
|
|
CO2Me |
n-C7H15 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
DMF |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
37% |
|
|
|
|
n-C7H15 |
+ |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CO2Me |
MeO2C |
|
CO2Me |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
35 |
|
|
|
|
36 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
82 : 18 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E/Z = 0:100 |
|
|
|
|
|
|
|
Scheme 14
The following points should be noted.[28] (i) The yield is usually low in this reaction, mainly due to a homocoupling reaction of the 1-alkynyl bromide and polymerization. (ii) The configuration of the carbon–carbon double bond in 35 is exclusively Z (not E ), indicating that the effect of the interaction between R1 and R2 in 26 (Scheme 11) on the stereochemical outcome is replaced by that between R and the Pd residue[26]; that is, due to the linear spatial arrangement of R2, syn-26 is exclusively formed in the reaction mixture. (iii) The regioselectivity is somewhat lower; however, with a less reactive nucleophile, the regioselectivity is 100% (Scheme 15).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bu-n |
|
||
n-C7H15 |
|
|
|
|
|
|
cat. Pd (dba)2,PPh3 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
+ |
|
|
|
|
|
|
|
|
|
Nu |
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
n-C7H15 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
NaNu |
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||
n-C4H9 |
|
|
|
|
|
Br |
|
CO2Et |
37 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
Nu = |
− |
THF, 65 °C, 24 h |
36% |
||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
SO2Ph |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
CO2Me |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
CPh |
THF, 65 °C, 50 h |
31% |
||||
|
|
|
|
|
|
|
|
|
N |
|
||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
||||
Scheme 15
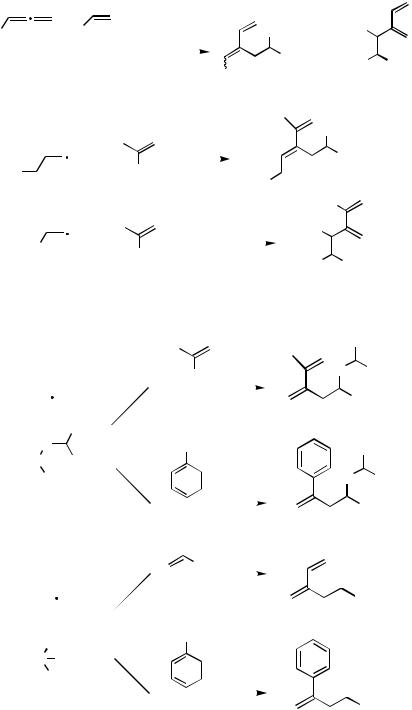
Enol triflates, which can easily be prepared by trapping regiospecifically generated enolates with triflic anhydride or N-phenyl triflimide,[29],[30] have also been applied in carbopalladation reactions of allenes (Scheme 16).[31],[32]
The Pd(0)-catalyzed reaction of the enol triflate of -tetralone with 1,2-propadiene in the presence of the enolate of 1,3-cyclopentadione afforded bicyclic precursors to the steroid skeleton 39. Under the catalysis of 10 mol % of Me3SiOTf at different temperatures, 39 (R1 H, R2 Me) could be highly selectively converted into compounds 40 or
41 (Scheme 17).[33]–[35]
1498 |
IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION |
R
+
OTf
Na − CO2Me CO2Me
cat. Pd(dba)2, PPh3, LiCl
DMSO, 65 °C
CO2Me
CO2Me
R 38
R = H |
85% |
R = n-C7H15 |
80% (E/ Z = 90:10) |
Scheme 16 |
|
OTf |
|
O |
|
+
R1


O
R2
O
R1
 39
39
+ R2 − |
|
cat. Pd(dba)2, PPh3 |
||
|
|
|
|
|
O |
|
|
|
|
R1 = H, R2= H |
50% |
|||
R1 |
= H, R2 = Me |
76% |
||
R1 |
= OMe, R2 = Me 94% |
|||
O
R2 = Me

 40
40
O
+
41
10 mol % Me3SiOTf, CH2Cl2, 0 °C, 5 h 40 (54%) : 41 (2%)
the same, but 25 °C |
40 (0) : 41 (90%) |
|
Scheme 17 |
Functional groups in allenes such as phenyl, Me3SiCH2, and methoxy are tolerated to afford the correspondingly functionalized 1,3-dienes in the Pd(0)-catalyzed reactions of the respective allenes with alkenyl bromides (Scheme 18).[36]
Using the enolate of the glycine equivalent methyl diphenylmethyleneaminoacetate 46 or of diethyl acetamidomalonate 49 as nucleophiles, novel amino acid derivatives have been prepared from allenes (Scheme 19).[24],[25],[37]
Amines have also been applied as nucleophiles.[6],[38] Under the catalysis of the palladium, the o-iodobenzyl homopropargyl ether 52 formed the seven-membered ring vinylpalladium intermediate 53, which subsequently reacted with 1,2-propadiene in the presence of a secondary amine to eventually afford 54 (Scheme 20).[38]
IV.7 CARBOPALLADATION OF ALLENES |
1499 |
+
Ph |
|
|
|
|
Br |
cat. Pd(dba)2, dppe |
CO2Et |
Ph |
||||||||
+ |
|
|
|
|
|
|
|
65 °C, THF |
|
|
|
+ |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
EtOOC CO2Et |
||
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
|
|
|
Na+ −CH(COOMe)2 |
|
|
|
|
42 |
|
|
43 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
E / Z = 35:65 |
91 : 9 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
|
|
|
|
|
|
+ |
|
|
as above |
|
|
|
CO2Et |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Me3Si |
|
|
|
|
|
|
|
Br |
21% |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Me3Si |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
44 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
MeO |
|
|
|
|
|
|
+ |
|
as above, but DMSO |
MeO |
|
|||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
Br |
|
40 °C, 20 h |
|
|
EtO2C |
CO2Et |
|||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
94%
45
Scheme 18
Ph
|
|
|
|
|
|
|
|
|
|
|
|
|
Br, cat. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
THF, 65−70 °C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
+ |
|
Ph |
|
|||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
N |
|
|
|
|
|
|
I |
|
|||||
|
|
|
|
|
|||||||||||
LiHC |
|
|
|
|
|
|
Ph |
|
|
|
|
||||
|
|
CO2Me |
|
|
, cat. |
|
|||||||||
|
|
|
|
||||||||||||
|
|
|
46 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
THF, 65−70 °C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br, cat. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DMSO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
+ |
|
|
|
|
|
|
|
|
||||
|
|
|
|
NHAc |
|
I |
|
||||||||
|
|
|
|
|
|
|
|
||||||||
NaC |
|
|
|
CO2Et |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
CO2Et |
|
|
, cat. |
|
|||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
49 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
DMSO |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
catalyst = 4 mol % Pd(dba)2 + 4 mol % dppe
Scheme 19
N  Ph
Ph
CO2Me
47 56%
Ph
N  Ph
Ph
CO2Me
48 35%
NHAc
 CO2Et
CO2Et
CO2Et
50 50%
NHAc
 CO2Et
CO2Et
CO2Et
51 40%
1500 IV Pd-CATALYZED REACTIONS INVOLVING CARBOPALLADATION
 NR2
NR2
|
|
|
|
|
|
|
10 mol % |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Pd(OAc)2 |
|
|
XPd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
I |
|
|
|
|
|
20 mol % PPh3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
K2CO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
O |
|
|
|
O |
|
|
|
HNR2 |
|
|
O |
|||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
52 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
54 |
|
|
|
53 |
NR2 |
= |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
68% |
||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
71% |
||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
OH |
|
|
|
||||
Scheme 20
In a similar way, even the benzooxacyclooctene derivative 56 with an eight-membered ring could be prepared, albeit in low yield along with the premature trapping product 57
(Scheme 21).[38]
Similar results involving o-( -alkenyl)phenyl iodides have also been reported to afford benzolactams and benzoannelated cyclic amines or ethers (Scheme 22).[39]
N
 I
I
O
55
cat. Pd(0) |
|
|
|
toluene, 70 °C |
|
|
|
20 h |
|
+ |
|
|
|||
|
|
|
|
|
|
|
O |
N |
56 |
|
|
|
|
||
H |
|
|
|
43% |
|
1 |
: |
Scheme 21
I |
|
10 mol % Pd(OAc)2 |
||||
+ |
+ HNR2 |
20 mol % PPh3 |
|
|||
Et4NCl, K2CO3 |
||||||
X |
|
Y n |
|
|||
|
|
|
|
|||
58 |
|
|
|
|||
N

 O
O
57
1.4
NR2
 n
n
Y
X
59
X = NMe, Y = CO; |
X = NTs, Y = CH 2; X = O, Y = CH2; |
|
X = CO, Y = NBu; X = CH2, Y = O. |
||
NR2 = |
or |
n = 1,2 |
|
N |
N |
|
H |
H |
Scheme 22
