

Organoboraneand OrganotinswithIodoenones-
ofAlkenylation-
andArylation-
Catalyzed-Pd ofReaction
7.TABLE
Reference
Product(%)Yield
(Temperature °C)
Solvent
a Catalyst
Organometal
α-Iodoenone
[88] |
|
|
[88] |
[88] |
[90] |
|
[88] |
[90] |
|
|
|
|
[96] |
|
|
[88] |
[88] |
[90] |
|
[88],[91] |
|
[88] |
|
[88],[89] |
[88],[89] |
(Continued) |
||||||||||||
80 |
|
|
76 |
66 |
97 |
|
83 |
78 |
|
|
|
81 |
|
|
80 |
95 |
100 |
|
47−65 |
|
87 |
|
83 |
77 |
|
|||||||||||||
25 |
|
|
80 |
50 |
25 |
|
110 |
25 |
|
|
|
70 |
|
|
80 |
60 |
25 |
|
35−50 |
|
85 |
|
24 |
24 |
|
|||||||||||||
|
NMP |
NMP |
NMP |
THF |
|
NMP |
THF |
|
|
|
NMP |
|
NMP |
NMP |
THF |
|
NMP |
|
NMP |
NMP |
NMP |
|
||||||||||||||||
|
I |
I |
I |
II |
|
I |
II |
|
|
|
III |
|
I |
I |
II |
|
I |
|
I |
IV |
V |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
2 |
|
|
|
|
|
3 |
|
|
SnBu |
3 |
|
|
|
CHSnBu |
CHSnBuC |
B(OH) |
|
CCHSnBu |
|
|
|
|
SnBu |
|
CHSnBuC |
|
CHSnBu |
|
|
4 |
|
||||||||||||||||||||
|
6 |
|
6 |
|
|
|
|
6 |
|
|
6 |
6 |
|
|
6 |
|
2 |
6 |
|
|||||||||||||||||||
3 |
|
|
3 |
SnBu |
2 |
|
3 |
B(OH) |
|
|
|
4 |
|
|
3 |
SnBu |
B(OH) |
|
3 |
|
SnBu |
|
H |
SnBu |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
4 |
|
|
|
|
H |
|
|
|
|
4 |
4 |
|
|
|
|
|
4 |
|
6 |
4 |
|
||
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|
|
TBSOC-m |
|
|
|
|
H |
H |
|
|
|
|
|
H |
|
C |
H |
|
|||
|
|
|
|
|
|
|
|
|
MeC-p |
|
|
|
|
|
MeC-p |
|
|
|
|
|
|
|
MeC-p |
MeC-p |
|
|
|
|
|
|
TBSOCH |
MeOC-o |
|
|||||
|
CH |
Me |
|
|
Me |
|
|
|
|
Me |
|
CH |
|
MeC-p |
|
|
||||||||||||||||||||||
2 |
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-i |
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
Z=AcorTBS O |
I |
|
|
|
|
OPr |
|
|
|
|
|
|
OAc =TIPS |
|
|
|
H COMe O |
|
|
|
|
|
|
||||||
O |
|
|
|
|
|
ZO |
|
|
|
|
|
O |
I |
|
|
O |
|
|
|
ZO |
|
Ph I |
|
|
OTf |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Z |
|
|
|
|
|
|
|
|
|
|
741

TABLE 7. (Continued )
Reference |
|
|
[92] |
|
|
|
[92] |
|
|
|
|
[93] |
|
|
|
|
|
[93] |
|
|
|
[97] |
||||||||
Product Yield(%) |
|
|
78 |
|
|
|
70 |
|
|
|
|
79 |
|
|
|
|
|
61 |
|
|
|
76 |
||||||||
°C) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Temperature( |
|
|
|
60−70 |
|
|
|
80 |
|
|
|
|
90 |
|
|
|
|
|
90 |
|
|
|
85 |
|||||||
Solvent |
|
|
|
|
NMP |
|
|
|
|
|
Toluene |
|
|
|
|
Toluene |
|
|
|
|
Toluene |
|
|
|
Toluene |
|||||
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Catalyst |
|
|
|
|
VI |
|
|
|
|
VI |
|
|
|
|
VII |
|
|
|
|
VII |
|
|
|
VII |
||||||
Organometal |
NHBOC |
|
|
SnBu |
|
|
NHBOC |
3 |
|
|
|
|
CH |
|
|
|
|
PhSnBu |
|
|
CH |
|||||||||
|
|
|
|
|
SnBu |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
3 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CHSnMe |
|
|
|
|
3 |
|
|
|
CHSnBu |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
=2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
TBSO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH(OMe) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α-Iodoenone |
|
|
Br |
|
|
Br |
CH(OMe) |
|
I |
|
|
|
|
|
COOPh O |
I |
|
|
|
|
COOPh O |
I |
||||||||
O |
|
|
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
N |
|
|
|
|
|
N |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
|
Me |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[97]
66
50
VII
3 PhSnMe
O
. 3 (dba) 2 Pd=
III
O. 2
Agequiv
1.6As, 3 Ph%
mol6
, 2 Pd(PhCN) 2 Cl%
mol3
CuI.% =II
mol10
As, 3 Ph%
mol10
, 2 Pd(PhCN) 2 Cl%
mol5
=I a
. 4 ) 3 Pd(PPh=
VII
. 3 )o
-P(Tol
, 3 CHCl . 3 (dba) 2 Pd=
VI. 3 (dba) 2 Pd=
LiCl., V
3 (dba) 2 Pd=
IV
CuI.As, 3 Ph, 3 CHCl
742

|
|
|
|
III.2.14.2 CROSS-COUPLING INVOLVING -HETERO-SUBSTITUTED COMPOUNDS |
743 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
O |
I or II |
|
|
|
|
|
|
|
O deprotection |
|
|
|
|
|
|
|
|
|
O |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
I (52%) [105] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(+)-harveynone OH |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
OTBS |
II (73%) [103] |
|
OTBS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
7 steps |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O I |
|
|
|
|
|
|
|
|
|
O |
|
I or II |
|
|
|
|
|
|
|
|
|
|
|
O |
|
1. deprotection |
|
|
|
|
|
|
|
|
|
O |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. HOAc |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I (54%) [105] |
|
|
|
|
|
|
|
|
|
|
|
|
DCC |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
OTBS |
|
II (80%) [103] |
|
OTBS |
|
|
(−)-tricholomenyn A |
|
OAc |
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
I = cat. Cl2Pd(PPh3)2, CuI, i-Pr2NH, CH2 |
|
|
C(R)C |
|
|
|
|
CH. |
|
CZnBr. DMF, 25 °C The products in these |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
II = 5 mol % Pd(dba)2 , 10 mol % P |
|
|
|
CH2 |
|
|
C(R)C |
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
cases were racemic mixtures. |
|
|
|
|
|
|
O |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
R = Me and Me2C |
|
|
|
CH(CH2)2 |
|
|
|
Scheme 24 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
Bu-t |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
, cat. Pd(PPh3)4 |
|
37% [102] |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
Bu-t |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, cat. Pd(PPh3)4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
33% [102] |
|
||||||||||
|
|
|
|
Bu3SnC |
|
CBu-t |
|
|
|
|
|
|
|
|
|
|
O |
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
Me |
|
|
Bu-t |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, cat. Pd(PPh3)4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
33% [102] |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
Me |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
Bu-n |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
BrZnC |
|
|
|
CBu-n |
|
|
|
cat. PdLn |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
Catalyst |
|
|
|
|
|
|
|
|
|
|
Solvent |
|
|
|
|
|
|
|
|
Yield (%) |
|
|
|
|
Reference |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
5% Cl2Pd(PPh3)2 |
|
|
|
|
|
|
|
|
|
Hexane, |
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
|
|
|
[103] |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
THF, DMF |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
5% Pd(dba)2 |
|
|
|
|
|
|
|
|
|
|
Hexane, |
|
|
|
|
|
|
45 |
|
|
|
|
|
|
|
|
|
|
[103] |
|
||||||||||||||||||||||||||
|
|
|
|
10% P(furyl-2)3 |
|
|
|
|
|
|
|
|
|
|
THF, DMF |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
5% Pd(dba)2 |
|
|
|
|
|
|
|
|
|
|
DMF |
|
|
|
|
|
|
90 |
|
|
|
|
|
|
|
|
|
|
[103] |
|
||||||||||||||||||||||||||
|
|
|
|
10% P(furyl-2)3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Scheme 26

744 |
III Pd-CATALYZED CROSS-COUPLING |
|
|
O |
O |
|
|
|
|
|||||||
|
|
|
|
|
|
|||||||||
|
I, |
|
|
|
I |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
TBSO |
|
|
|
|
70% [105] |
||||||||
|
|
|
|
|
||||||||||
|
|
|||||||||||||
|
|
|
O |
TBSO |
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||||
|
|
|
O |
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||||||
|
I, |
|
|
|
I |
|
|
|
|
75% |
[105] |
|||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
O |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
ZO |
|
|
|
I |
|
O |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I, |
|
OZ |
|
|
|
|
|
|
|
|
|
||
|
|
ZO |
|
74% |
[105] |
|||||||||
|
|
|
||||||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||
OZ
I = 5 mol % Cl2Pd(PPh3)2, 10 mol % CuI, i-Pr2NH, THF.
Scheme 27
D.ii.d. Pd-Catalyzed -Alkylation of -Iodoenones (Protocol IIA). Although
-alkylation of alkali metal enolates and related derivatives, such as enamines, proceeds satisfactorily in many cases, it is still desirable to develop a complementary -haloenone- based -alkylation methodology for the following reasons. First, it would provide an efficient route to -alkyl-substituted enones. Second, it might provide a satisfactory route to -alkyl-substituted ketones even in cases where the conventional alkylation methodology is unsatisfactory. An efficient synthesis of prostaglandin E1 involving Pd-catalyzed -alkylation of 2-iodo-4-(t-butyldimethylsiloxy)-2-cyclopentenone with B-(6-methoxycarbonyl)hexyl-9-BBN, where 9-BBN is 9-borabicylo[3.3.1]nonane, is a representative example (Scheme 28).[106]
O
I
+ 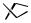 B(CH2)6COOMe
B(CH2)6COOMe
ZO
1. Li2Me(CN)Cu
 Pent-n
Pent-n
OZ
2. HF, pyridine, MeCN
5 mol % Cl2Pd(dppf ) O
10 mol % AsPh3 Cs2CO3 (1.8 equiv)
DMF, THF, H2O
Z = t-BuMe2Si
ZO
O
 (CH2)6COOMe
(CH2)6COOMe
Pent-n
(CH2)6COOMe 70−80%
HO |
73% |
OH |
|
||
|
|
Scheme 28

III.2.14.2 CROSS-COUPLING INVOLVING -HETERO-SUBSTITUTED COMPOUNDS |
745 |
A systematic investigation of the Pd-catalyzed cross-coupling reaction of -iodoenones with alkylzinc derivatives[107] indicates that both alkylzinc halides and dialkylzincs containing Me, primary alkyl, benzyl, homobenzyl, and homopropargyl groups react satisfactorily (Table 8). Benzylzinc derivatives prepared by treating benzylmagnesium bromide with
TABLE 8. Pd-Catalyzed -Alkylation of -Iodoenones a
α-Iodoenone |
Alkylzinc |
Method of |
|
Product |
||||||||||||||||
Derivative |
Generationb |
Catalystb |
Yield (%)b |
|||||||||||||||||
O |
Me2Zn |
A |
I |
85 |
|
|||||||||||||||
|
|
|
|
|
|
I |
I |
85 |
(81) |
|||||||||||
|
|
|
|
|
|
(n-Hex)2Zn |
B |
|||||||||||||
|
|
|
|
|
|
|
|
|
I |
85 |
(73) |
|||||||||
|
|
|
|
|
|
|
|
|
(i-Bu)2Zn |
B |
||||||||||
|
|
|
|
|
|
|
|
|
B |
I |
72 |
(61)e |
||||||||
|
|
|
|
|
|
|
|
|
(s-Bu)2Zn |
|||||||||||
|
|
|
|
|
|
|
|
|
I |
Trace |
||||||||||
|
|
|
|
|
|
|
|
|
(PhCH2)2Zn |
B |
||||||||||
O |
I |
82 |
(74) |
|||||||||||||||||
PhCH2ZnBr |
C |
|||||||||||||||||||
|
|
|
|
|
|
I |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
(n-Bu)2Zn |
B |
I |
76 |
(66) |
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
||||
O |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
(n-Bu)2Zn |
B |
I |
67 |
(59) |
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||
Me |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
O |
n-HexZnBr |
B |
I |
96 |
|
|||||||||||||
|
|
|
|
|
|
|
I |
PhCH2ZnBr |
C |
I |
94 |
|
||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
Me3SiC |
|
|
C(CH2)2ZnI |
C |
II |
80 |
(61) |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
O |
H2C |
|
|
CH(CH 2)2ZnBr |
D |
II |
36 |
|
||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
I |
PhCH2ZnBr |
C |
I |
72 |
|
||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
O |
n-BuZnBr |
B |
I |
84 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
I |
C |
I |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
PhCH2ZnBr |
71 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
Ph(CH2)2ZnBr |
D |
I |
83 |
|
|||||||
Me |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
Me |
|
|
|
|
|
|
|
|
|
|
|
||||||
aUnless otherwise mentioned, the reactions were carried out at 23 °C in DMF or DMF-THF using either 0.65 molar equiv of a dialkylzinc or 1.3 molar equiv of an alkylzinc bromide or iodide.
bA = Commercially available. B = RMgX + 12 ZnBr2 (X = Br or I). C = RX + Zn. D = RX + Mg + ZnBr2.
cI = 5 mol % Cl2Pd(PPh3)2. II = 5 mol % Cl2 Pd(TFP)2.
dBy NMR and/or GLC. The numbers in parentheses are isolated yields.
eCompletely isomerized to n-butyl. Additionally, 3-(s-butyl)cyclopentanone was also obtained in 12% yield.

746 |
III Pd-CATALYZED CROSS-COUPLING |
ZnBr2 are ineffective, but benzylzinc bromide prepared by treating PhCH2Br with Zn is satisfactory. Secondary alkylzinc derivatives give cross-coupling products in high yields, but it is difficult to avoid extensive secondary-to-primary isomerization observed with Cl2Pd(PPh3)2 or conjugate addition with concomitant deiodination observed with Cl2Pd(dppp) and Cl2Pd(dppf).[108] The results appear to indicate that substitution of -iodoenones is significantly more demanding than that of other ordinary alkenyl halides. Somewhat surprisingly, all attempts to allylate -iodocyclopentenone led to 1,2-addition of either allylzinc bromide or diallylzinc to the carbonyl group without the involvement of the C—I bond (Scheme 29).[107] The corresponding reaction of propargylzinc derivatives proceeds similarly via 1,2-addition.
|
|
|
|
|
|
|
|
O |
|||
O |
|
5% Cl2Pd(PPh3)2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||||
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
+ |
ZnX |
1:1 THF-DMF |
|
|
HO |
|||
|
|
|
X = Br or allyl |
|
|
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80−90% |
Scheme 29
D.ii.e. Pd-Catalyzed -Substitution of -Metalloenones (Protocol IIB). 2-Trimethyl- stannyl-2-cyclopentenone prepared via lithiation–stannylation of cyclic acetal-protected 2- bromo-2-cyclopentenone reacted with (E)-1-octenyl iodide in the presence of 5 mol % of Pd(PPh3)4 to give the desired cross-coupling product in 80% yield.[76] Under comparable conditions, 2-trimethylstannyl-2-cyclohexenone reacted with (E)-1-octenyl iodide and phenyl iodide to give the corresponding cross-coupling products in about 65% yields (Scheme 30).[107] These may well represent the first set of examples of Pd-catalyzed crosscoupling of -stannylenones. Unfortunately, attempts to alkenylate 2-trimethyl- stannylbicyclo[3.3.0]oct-1-en-3-one by the same reaction were unsuccessful, the yield of the desired product being 10%. A related -allylation of -stannylenones is also known, as shown in Scheme 31.[109]
|
|
|
|
|
|
|
|
|
|
Hex-n |
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
Hex-n |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
cat. Pd(PPh3)4 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
64% |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
O |
|
HMPA, 50 °C |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
O |
|
|
||||||||||||||
|
|
|
SnMe3 |
|
I |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cat. Pd(PPh3)4 |
|
|
|
|
|
|
65% |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
HMPA, 90 °C |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Scheme 30 |
|
|
|
|
|
|
|
|
|
||
|
|
|
O |
|
|
Br |
O |
||||||||||||||
|
|
|
|
|
|
|
SnBu3 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
2% Pd(dba)2 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
THF, 55 °C |
|
|
|
89% |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Scheme 31

III.2.14.2 CROSS-COUPLING INVOLVING -HETERO-SUBSTITUTED COMPOUNDS |
747 |
More recently, direct conversion of -iodoenones into the corresponding -zinco derivatives has been achieved using either an excess of Zn dust[110] or Zn–Ag couple (4 equiv) in the presence of TMEDA (1 equiv).[111] The Zn reagents thus generated are less reactive than the more usual alkenylzinc derivatives. Nonetheless, some satisfactory results have been obtained with aryl halides. On the other hand, variable results were obtained with alkenyl halides (Table 9).[110],[111] In summary, the -zincoenone-based procedures appear to be somewhat more involved than the corresponding -iodoenone-based procedures, and the cross-coupling yields tend to be lower. On the other hand, they do not require strongly basic organolithiums or Grignard reagents. Thus, they can tolerate a wider range of heteroatom functionalities.
TABLE 9. Pd-Catalyzed -Arylation and -Alkenylation of -Zincoenones a
|
|
|
|
|
|
Aryl or Alkenyl |
Catalyst b |
Product |
|
|||||||
Enone |
|
|
Halide |
Yield (%) |
Reference |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
ZnI |
I |
|
|
|
|
|
|
Hex-n |
I |
80 |
[110] |
|
|
|
|
|
|
|
|
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
71 |
[110] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
||||||
|
|
|
|
|
|
I |
|
|
|
|
|
|
X |
I |
78−88 |
[110] |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
O |
(X = CF3, NO2, COOEt) |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
ZnI |
I |
|
|
|
|
|
|
X |
I |
70−81 |
[110] |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
N |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
(X = CF3, NO2, COOEt) |
|
|
|
|||||||
|
Bz |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
O |
|
|
|
|
|
|
|
Pent-n |
II |
48 |
[111] |
|||||
|
|
|
|
ZnI |
I |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Br |
|
|
|
|
|
|
COOEt |
III |
32 |
[111] |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
Me |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
O |
|
|
|
|
|
|
|
Cl |
|
|
|
||
|
|
|
|
|
|
ZnI |
|
|
|
|
|
|
|
III |
89 |
[111] |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
Me |
|
|
|
|
|
|
|
III |
70 |
[111] |
|||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Br |
|
|
|
|
|
|
F |
|
|
|
a 1.3 to 2 equiv of organozinc reagents were used.
b I = 1 mol % Pd(dba)2 and 4 mol % P
 . II = 5 mol % Pd(dba)2 and 15 mol % AsPh3.
. II = 5 mol % Pd(dba)2 and 15 mol % AsPh3.
O 3
III = 5 mol % Pd(PPh3)4

748 |
III Pd-CATALYZED CROSS-COUPLING |
D.ii.f. Pd-Catalyzed -Substitution of -Haloenols and -Metalloenols (Protocols IIIA and IIIB). Protocols I and II discussed in Sects. D.ii.a–D.ii.e collectively provide satisfactory procedures for -substitution of enones in a wide variety of cases. Nonetheless, development of additional alternative procedures has proved to be desirable in some very demanding and delicate situations. In certain cases where the products and/or intermediates are highly acid-sensitive and the desired cross-coupling is very demanding, Protocol III (Scheme 17) has been shown to be the most dependable, although it is more cumbersome than Protocols I and II. The earliest study of Protocol III, however, employed 2-bromoallylic acetates of relatively modest reactivity. Despite some favorable results reported for alkynylation shown in Scheme 32,[112] their Pd-catalyzed cross-coupling with other nucelophiles, such as alkenyland arylmetals, is complicated by a few side reactions including
(i) elimination of allylic acetates to give conjugated bromodienes, (ii) deacetylation, and (iii) allylic substitution with pyrrolidine and other amines used as bases.[112]
OAc |
|
|
|
|
|
|
|
|
|
OAc |
Ph |
|||||
|
Br |
|
HC |
|
|
|
|
CPh |
|
|||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
cat. PdLn, pyrrolidine |
|
|
67% |
|||||||||||
|
|
|
||||||||||||||
|
|
|
HC |
|
|
|
CPh |
|
|
|
||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||||
|
OAc |
|
cat. PdLn, pyrrolidine |
OAc |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br
66%
SiMe3
Scheme 32
Much more favorable results can be obtained with 2-iodoallyl alcohol derivatives. In the syntheses of highly acid-sensitive nakienones A[113] and B,[114] it was not readily feasible to zincate (Z )-2-iodo-2,4-pentadien-1-ol derivatives due to competitive -elimi- nation. It was therefore desirable to incorporate the cyclic enone moiety as nucleophiles, as summarized in Scheme 33.
|
|
|
|
|
Me3SiO |
OTBS |
|
|
|
|
|
|
|
|
|
OH |
|||
|
Me3SiO |
|
|
|
|
|
O |
||||||||||||
|
|
|
ZnBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OTBS |
|
|
|
|
3 steps |
|
|
|
|||||||
|
I, DMF |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
OTBS |
95% |
OTBS |
nakienone A OH |
|||||||||||||||
|
|
|
|
|
|||||||||||||||
I |
Me3SiO |
|
|
|
OTBS |
|
|
|
|
|
|
|
|
|
OH |
||||
Me3SiO |
|
|
|
|
|
|
|
O |
|||||||||||
|
|
|
ZnBr |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
2 steps |
|
|
|||||||
|
TBSO |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
68% |
|
|
|
|
|
|
|
|
|
|
|
||||
|
II, DMF |
TBSO |
|
|
|
|
|
OH nakienone B |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
I = 5 mol % Cl2Pd(TFP)2, 10 mol % n-BuLi
II = 5 mol % Pd(PPh3)4
Scheme 33

III.2.14.2 CROSS-COUPLING INVOLVING -HETERO-SUBSTITUTED COMPOUNDS |
749 |
In a recent synthesis of carbacyclin,[115] a need for Protocol IIIA was encountered, when neither Protocol IIA nor Protocol IIB was shown to be satisfactory (Scheme 34). It is clear that Protocol II is the most desirable of all options discussed here. However, the need for Protocol III as discussed above indicates that there still is room for improvement of Protocol II. In the meantime, Protocol III may be employed as a reliable, if somewhat cumbersome, alternative for selective -substitution of enones.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A, NMP |
Pent- n |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cat. Pd(dba)2, |
|
|
OTBS |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AsPh3, CuI |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1. n-Bu2ZrCp2 |
|
|
|
|
|
|
|
SnMe3 |
<10% |
|
|||||||||||||||||||||||||||
|
|
|
|
|
SnMe3 |
2. CO |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
A = I |
|
|
|
|
Pent- n |
|
|
I2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
Pent- n |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OTBS |
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OTBS |
|||||||||||||
|
|
|
B = BrZn |
|
|
|
|
|
|
|
Pent- n |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OTBS |
|
|
|
|
B, DMF |
72% |
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5% Cl2Pd(TFP)2 |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10% n-BuLi |
|
|
|
|
|
|
O |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1. n-Bu2ZrCp2 |
|
|
|
|
|
SnMe3 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SnMe3 |
|
|
2. CO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TBSO(CH ) |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TBSO(CH2)4 |
76% |
|
|
|
|
||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n-Pent |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OTBS |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
B, DMF |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5% Cl2Pd(TFP)2 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
NIS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10% n-BuLi |
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
TBSO(CH2)4 |
83% |
|
|
|
|
|
|
|
|
|
TBSO(CH2)4 |
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
1. NaBH4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CeCl . |
7 H O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
MeOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OSiMe3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
THPO(CH2) 4 |
|
|
|
|
|
|
|
2. Me3SiCl, NEt3 |
|
THPO(CH2)4 |
84% |
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n-Pent |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n-Pent |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OTBS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OTBS |
||||
1. n-BuLi then ZnBr2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
2. A, 5% Cl2Pd(TFP)2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PCC, NaOAc |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
10% n-BuLi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2Cl 2 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
3. K2CO3 , MeOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
THPO(CH2)4 84% |
|
|
|
|
|
|
|
|
|
|
|
THPO(CH2)4 |
78% |
|
|
|
|
|||||||||||||||||||||||||
Scheme 34

750 III Pd-CATALYZED CROSS-COUPLING
D. iii. Pd-Catalyzed -Substitution of , -Unsaturated Esters and Amides
D.iii.a. Pd-Catalyzed -Substitution of -Metalloesters and Amides. -Substitution of , -unsaturated esters, amides, and related compounds is closely related to that of , - unsaturated enones. The synthesis of -aryl- and -alkenyl-substituted , -unsaturated esters via conjugate carbocupration of , -acetylenic esters followed by Pd-catalyzed cross-coupling reported in 1988[116] may represent the earliest example of reactions of this type. Unfortunately, the stereoselectivity was at best modest (Scheme 35). -Acylation of-stannylbutenolides is another prototypical example[117] (Scheme 36).
R1C |
|
CCOOR + |
R2Cu(NCy2)Li |
|
ether, −50 °C |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
R3I, cat. Pd(PPh3)4 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
R1R2C |
|
|
|
CCOOR |
|
|
|
R1R2C |
|
|
|
|
CCOOR |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu(NCy2)Li |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
||||||
|
|
R |
|
R1 |
R2 |
|
|
R3 |
|
|
|
|
|
|
|
|
|
Yield (%) |
|
|
|
E/Z |
|
|
|||||||||||||
|
Me |
|
H |
Me |
|
|
Ph |
|
|
|
|
|
|
|
|
|
|
63 |
|
|
|
86:14 |
|
|
|||||||||||||
|
Me |
|
H |
Bu |
|
|
(E)-BuCH |
|
|
CH |
60 |
|
|
|
92:8 |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
Et |
|
Me |
Ph |
|
|
Ph |
|
|
|
|
|
|
|
|
|
|
77 |
|
|
|
56:44 |
|
|
|||||||||||||
|
Me |
|
Ph |
Me |
|
|
Ph |
|
|
|
|
|
|
|
|
|
|
52 |
|
|
|
62:38 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Scheme 35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Bu3Sn |
|
OMe |
|
|
|
|
|
|
|
PhCH2(Cl)Pd(PPh3)2 |
RCO |
OMe |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO, 65 °C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
+ |
RCOCl |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
R = Ph (47%), (E)-PhCH |
|
|
|
CH (59%), |
|
|
|
O |
(48%) |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bu3Sn |
|
OMe |
H |
COOMe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
||||||||||||||||
|
|
|
PhCH2(Cl)Pd(PPh3)2 |
COOMe |
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
O |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
65 °C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
O |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
COCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OMe |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO |
||||||||||||
O 
O
Scheme 36
The Pd-catalyzed cross-coupling reactions of -stannyl- , -unsaturated esters and lactones have since been extensively developed, as indicated by the results shown in Scheme 37.[118]–[122] Despite many favorable results, these reactions are often associated with some undesirable features, such as the use of a significant excess of a stannane[118] or an organic halide,[122] relatively high catalyst loading (8–10 mol %),[118]–[120] and the use of toxic arsines.[120] In addition, an undesirable, if interesting, -to- regioisomerization has also been observed with a -unsubstituted -stannylacrylic ester, which has been interpreted in terms of a carbopalladation–Pd-carbene formation via -elimination– -CH activation–reductive elimination sequence (Scheme 38).[123] Clearly, further investigations and developments are desirable.
