
Академия наук СССР
Серия "Наука и технический прогресс"
А.Н.Бочков
В.А.Афанасьев
Г.Е.Заиков
Углеводы
Издательство "Наука"
Москва, 1980
Предисловие
Углеводы, или сахара, представляют собой обширный класс природных органических соединений, составляющих основную массу органического вещества нашей планеты. С представителями углеводов человек сталкивается в самых различных областях своей деятельности и при изучении самых различных живых объектов. Только по химии углеводов (не считая биохимии) сейчас публикуется в среднем полторы-две тысячи работ в год. Охватить этот материал в рамках небольшой книги, разумеется, невозможно. Мы сконцентрируем внимание на фундаментальных вопросах структуры углеродных молекул и лишь очень кратко остановимся на синтетических проблемах этой области, так как синтезу будет посвящена специальная книга. Наша задача - кратко описать современное состояние исследований в области углеводов. В понятие "современное состояние" мы вкладываем не только и не столько самоновейшие сведения и методы исследования, а в первую очередь сегодняшнее понимание этой области, ее, так сказать, современную идеологию. А она весьма нетривиальна и во многом отличается, например, от идеологии химии белка. Как мы дальше увидим, даже такое фундаментальное химическое понятие, как понятие об индивидуальном веществе, имеет различный смысл для белков и полисахаридов. Мы попытаемся дать читателю почувствовать современную логику мышления исследователей в этой очень своеобразной и увлекательной области биоорганической химии.
Эта книга написана с химиками. Поэтому весь материал рассматривается в ней с органо-химических позиций, т.е. представлен в терминах молекулярных структур и конформаций. Иными словами, здесь преимущественно описана химия углеводов. С другой стороны, углеводы - это прежде всего компоненты живых систем, и рассматривать
их структуры и свойства, а также логику развития исследований в этой области в отрыве от их биологической роли, было бы глубоко неправильно. Поэтому авторы все-таки попытались выборочно и в основном иллюстративно охарактеризовать роль углеводных структур в живых системах.
Авторы выражают глубокую признательность А.И.Усову и Т.Н.Дружининой, прочитавшим книгу в рукописи и сделавшим ряд ценных замечаний, а также М.И.Арцис и С.Н.Сенчековой за помощь при подготовке рукописи к печати.
Глава 1
Струтуры
Что это такое?
Как известно, полноценная пища для человека должна включать белки, жиры, углеводы, витамины и микроэлементы. Главные углеводные компоненты пищи - это крахмал, сахароза, глюкоза, фруктоза. Целлюлозная промышленность со всеми ее многочисленными ответвлениями производит и утилизирует другой представитель класса углеводов:высокомолекулярный полисахарид - целлюлозу. Что общего между несъедобной целлюлозой и крахмалом?
Наша звездная система называется Галактикой. Есть ли что-либо общее этим названием и моносахаридом галактозой?Вспомним:Галактика - Млечный путь - молоко - молочный сахар - лактоза - галактоза. Пустыня сахара и сахар. Древний Египет - тростник в долине Нила - тростниковый сахар, впервые попавший в Европу из Африки - Сахара.
Морской прибой непрерывно бьет о камни водоросли литорали. Они изгибаются, сплетаются друг с другом, завязываются в узлы, трутся взмытым песком - и все же сохраняют свою целостность. Что придает им форму и эластичность?
Микробиологи выращивают культуру микроорганизмов на агаровых средах. Практически это застывшая при комнатной температуре вода – твердый агаровый гель можно получить из 1л воды и всего 1 г агара. При всей гигантской всеядности микроорганизмов в целом (некоторые из них разрушают бетон и резину, утилизируют молекулярный водород, живут в серной кислоте и т.д.), лишь немногие из них способны переваривать агар. Агар – тоже полисахарид. Его выделяют из морских водорослей, которым он и подобные ему полисахариды обеспечивают чрезвычайно прихотливый набор физико-механических и физико-химических характеристик, необходимых растению для выживания в столь своеобразной среде, как прибойная зона Мирового океана.
По ошибке больному перелили кровь другой группы. Наступает бурная, чрезвычайно опасная реакция. Чем она вызвана?Оказывается, полисахаридные цепи биополимеров крови донора и реципиента различались по структуре всего на одно-два моносахаридных звена.
В технике борьба с трением и износоустойчивость – проблема фундаментального значения. В живых системах, где механическое движение распространено универсально, та же проблема решается не менее универсально – при помощи гликопротеиновой смазки. Гликопротеины – биополимеры, включающие белковую и пептидную компоненты, ковалентно связанные с углеводной. Она выстилает в животных организмах все трущиеся поверхности:кости в суставах, кровеносные сосуды, мочеполовые пути, поверхность тела рыб и т.л. А у антарктических рыб определенные гликопротеины играют роль антифризов, препятствующих замерзанию крови и других биологических жидкостей при отрицательных температурах.
А вот другой гликопротеин – хитин. Из него построены жесткие панцыри разнообразных низших животных – ракообразных, насекомых и т.д. Иная функция – иной набор механических и химических характеристик, во многом уникальных. Большой кусок крабьего панцыря, например, хрупок, и, казалось бы, измельчить его не составляет труда. Но попробуйте растереть его более мелкие кусочки в ступке. Материал пружинит, выскальзывает из-под пестика, но растиранию упорно не поддается. Он «ухитряется» быть одновременно и твердым, и вязким, и хрупким, и эластичным.
В организм попали болезнетворные микроорганизмы. Резко повышается температура, энергично вырабатывается иммунный ответ организма. На что в первую очередь реагирует организм-хозяин?На то, с чем соприкасается прежде всего:на материал, выстилающий внешнюю поверхность клеток-паразитов.У одного из классов возбудителей инфекционных болезней это липополисахариды – высокомолекулярные структуры, включающие липидную и полисахаридную части. У каждого вида – свои липополисахариды, и ответ на них строго индивидуален и специфичен (так, иммунитет от брюшного тифа не спасает от возвратного).
Кто в наше время не знает о нуклеиновых кислотах. Три структурных элемента обязательно входят в состав их каждого мономерного звена:гетероциклическое основание, фосфат и моносахаридный остаток:рибоза или 2-дезокси-рибоза. Таким образом, и это – производные углеводов.
Можно, наконец, вспомнить и о том, что углеводы составляют основную часть всего органического вещества на планете Земля.
Итак, углеводы – это глюкоза, крахмал, целлюлоза, лактоза, сахароза, агар, гликопротеины, липополисахариды, хитин, нуклеиновые кислоты, ацетатная пленка, шпательное волокно и т.д. и т.п. Так что же это все-таки такое,- углеводы?Как почти любому классу органических соединений с развитой химией, им трудно дать вполне строгое определение, т.е. такое, которое включало бы все представители и ислключало все, не входящее в этот класс. Поэтому поступим иначе:попытаемся описать основные структурные черты углеводов и показать на конкретных примерах их типичных представителей, какими они бывают.
Можно начать с семантики. «Угле-воды», уголь и вода, Cn(H2O)n. Так их называли в прошлом веке, когда элементный состав органических соединений служил одной из важнейших доступных характеристик. Действительно, элементарная формула глюкозы,C6H12O6– отвечает схеме «уголь+вода». Но понятно, что разбор одного элементного состава дает немного. Даже уксусная кислота в соответствии с таким определением есть углевод[CH3COOH = C2(H2O)2]. Так что оставим семантику и обсудим вопрос в более современных терминах.
Структура моносахаридов
Элементарным звеном всех высших углеводов, так же как и низкомолекулярных производных этого класса, являются моносахариды. В типичных случаях их молекулы содержат прямую насыщенную цепь из пяти или шести углеродных атомов, каждый из которых несет гидроксильный заместитель, а один окислен до альдегидное или кетонной группы. Таковы, например, альдопентозы 1 (т.е. С5-сахара с альдегидной группой), альдогексозы 2 (т.е. С6-сахара с альдегидной группой), кетогексозы (C6-сахара с кетогруппой) и др. Кроме наиболее распространенных пентоз и гексоз, существуют ещеC3-, C4-, C7-, C8-и дажеC9-моносахариды, называемые соответственно триозами, тетрозами, пентозами, октозами и нонозами.
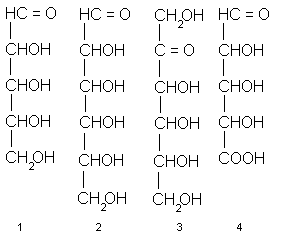

Концевое CH2OH-звено цепи (кстати, нумеруют углеродные атомы в моносахаридах всегда начиная с карбонильной группы или с ближайшего к ней конца цепи) может быть окислено до карбонила. При этом возникает другой распространенный подкласс моносахаридов – уроновые кислоты, например альдопентуроновые кислоты 4 или альдогексуроновые кислоты 5. В других случаях наоборот, у углеродного атома отсутствует гидроксил. Возникает так называемое дезоксизвено и соответственно дезоксисахара, например, 2-дезокси-альдопентозы (в частности, 2-дезокси-D-рибоза, комнонент ДНК) или 6-дезокси-альдогексозы 7. Одна из гидроксильных групп (а иногда и две или даже три) может быть заменена аминогруппой. Это аминосахара, как, например, 2-амино-2-дезокси-альдогексозы 8, часто, но нестрого называемые гексозаминами. Бывают, наконец, и моносахариды с разветвлением углеродного скелета а также с несколькими видами отклонений от классических структур типа 1-3 одновременно.
Не следует думать, что названные типы соединений – некие искусственные «монстры». Наоборот, все это типичные и достаточно распространенные структурные элементы более сложных природных углеводов (другое дело, что все они могут быть получены и синтетически). Более того, существуют в природе и нередко играют весьма важную роль в жизнедеятельности клетки и более сложные моносахариды, еще более отдаляющиеся по структуре и составу от классических «угле-водов». Здесь мы хотели указать на наиболее распространенные типы структурных вариаций, встречающихся в этом классе.
В каждой из рассмотренных структур имеется по нескольку ассиметричных центров и, следовательно, для каждой возможно существование 2nстереоизомеров, гдеn– число ассиметрических центров. В альдогексозах (2), например, их 4. В классификационных целях из них выделяют один:тот, который максимально удален от карбонильной группы (для гексоз это С-5), и по его конфигурации (D или L) относят моносахарид соответственно кD-илиL-ряду.
А как описать конфигурацию остальных центров?Для этого применяют серию тривиальных названий для всех возможных комбинаций относительных конфигураций. Так возникают такие названия, какD-глюкоза (9),D-галактоза (10),D-арабиноза (11),L-арабиноза (12),D-рибоза (13) и др.

Структуры 9-13 написаны в проекции Фишера. Напомним, что по правилам фишеровской проекции, тетраэдрический углеродный атом располагают так, чтобы его четыре связи проектировались на плоскость в виде креста, причем связи, смотрящие на наблюдателя (над плоскостью бумаги), образуют горизонтальную линию, а уходящие под плоскость бумаги (от наблюдателя) – вертикальную, как это показано на примере формул 14 и 15. Чаще всего символ центрального атома опускают, заменяя его точкой пересечения прямых (формула 16). Это показано на схеме, составленной в проекции Фишера
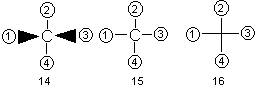
где 1-4 – заместители при центральном углеродном атоме, атом углерода в плоскости бумаги, заместители 1 и 3 – над плоскостью, заместители 2 и 4 – под плоскостью.
Итак, главные источники структурного и функционального многообразия моносахаридов лежат в различном наборе функциональных групп (карбонильные, гидроксильные, карбоксильные, аминогруппы и т.д.) и в не меньшей степени в различиях стереохимии. Последнее надо особо подчеркнуть. В обычном курсе органической химии рассматривают свойства и различия отдельных классов соединений, основанные в первую очередь на различиях бутлеровских структур, и отдельно в виде некоего экзотического приложения – вопросы стереохимии. В химии сахаров такого разделения не может быть. В принципе вся эта область есть органическая стереохимия par excellence*, и все многообразие свойств углеводов проистекает прежде всего из их стереохимических различий. Так, например, кардинальные различия свойств и биологической функции целлюлозы и одного из двух компонентов крахмала – амилозы – обусловлены различием конфигурации лишь одного ассиметричного центра элементарного звена этих стереоизомерных полисахаридов.
Целый ряд классических деструктивных методов установления строения органических веществ привел исследователей прошлого века к структурам типа 1-13 для моносахаридов.И в смысле справедливости строения углеродного скелета и положения заместителей эти структуры отражают непреложную, добытую экспериментом истину. Тем не менее они не соответствуют действительному строению моносахаридов, хотя и удобны в дидактическом плане:для описания и запоминания относительных конфигураций ассиметрических центров (чем мы в дальнейшем еще воспользуемся).
Чтобы продвинуться дальше (ближе к реальности)
нам нужно вспомнить некоторые свойства карбонильных соединений. Альдегиды и кетоны (по крайней мере обычные) в присутствии кислот легко реагируют со спиртами, образуя ацетали и кетали. Как и многие другие реакции конденсации, образование ацеталей и кеталей резко ускоряется в том случае, когда реагирующие группы пространственно сближены, например расположены на подходящем расстоянии внутри одной молекулы*. Моносахарижы представлены полиоксиальдегидами или полиоксикетонами, в которых карбонильная группа может на выбор вступать в конденсацию с любым гидроксилом той же молекулы. Естественно, что такая реакция осуществляется с наиболее «удобно» расположенным гидроксилом. Вследствие ряда причин, на которых мы сейчас не будем останавливаться, оптимальное расположение карбонильной и спиртовой групп отвечает замыканию пяти- и шестичленных циклов.
Действительно, одна из спиртовых гидроксильных групп моносахарида, например D-глюкозы (9), самопроизвольно вступает в конденсацию с альдегидной группой той же молекулы с образованием ацетальной связи. При этом возникает циклическое производное, но не ацеталь, а полуацеталь, т.е. такое, в котором один из заместителей при бывшем карбонильном атоме углерода – спиртовый остаток, а другой – гидроксильная группа. Так образуются пятичленные, так называемые фуранозные циклы (17), если в реакции участвует гидроксил при С-4 или шестичленные – пиранозные циклы (18), если в реакцию вступает гидроксил при С-5.
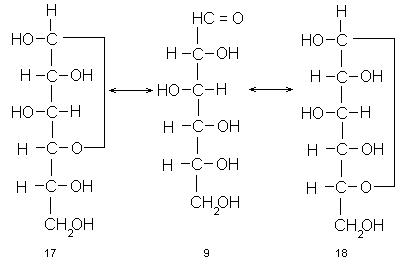
Подведем предварительные итоги. Моносахариды – это полиоксиальдегиды или полиоксикетоны с прямой (в типичных случаях) насыщенной углеродной цепью. Часть гидроксильных групп может отсутствовать или быть заменена на другие функциональные группы. Обычное состояние моносахаридов (и, как мы увидим в дальнейшем, всех их важнейших природных и синтетических производных) циклическое, включающее образование пяти- и шестичленного гетероцикла с одним атомом кислорода в цикле.
Теперь возникает технический, но немаловажный вопрос:Как их изобразить на бумаге?
Изображение молекул углеводов на плоскости
Хотя уже пещерные художники умели несколькими штрихами создавать адекватные образы явлений внешнего мира, проблема двухмерного изображения трехмерных объектов актуальная и по сей день. Вот, например, как столкнулся с ней шестилетний Антуан Сент-Экзюпери:«Я много раздумывал о полной приключений жизни джунглей и тоже нарисовал цветным карандашом свою первую картинку… Я показал свое творение взрослым и спросил, не страшно ли им. – Разве шляпа страшная?– возразили мне. А это была совсем не шляпа. Это был удав, который проглотил слона. Тогда я написовал удава изнутри, чтобы взрослым было понятнее. Им ведь всегда все нужно объяснять».
Из опыта автора «Маленького принца» мы видим, что есть два пути изображения объекта:подробное и схематическое. Первое технически сложно и мало годится для повседневности, второе удобно, но для его понимания требуется некоторое воображение. Для самого художника последнее ограничение не было существенным – он ведь много размышлял о своем предмете, прежде чем взялся за карандаш.
Молекулы сахаров – существенно трехмерные объекты. Но это еще не все. Гораздо важнее и менее тривиально, что у них нет никаких элементов симметрии, которые позволили бы изобразить их на бумаге в двух измерениях, без существенной потери информации. Это не бензол, имеющий плоскость симметрии и позволяющий без большого ущерба забыть об одной из пространственных координат и уверенно манипулировать на бумаге с плоским шестиугольником.
Выше мы пользовались проекцией Фишера. Она точно отражает относительную конфигурацию ассиметрических центров, но ничего не говорит (хуже того, говорит весьма искаженно) об истинном расположении атомов в пространстве. И уж совсем неудобной становится при изображении циклических структур. Отнюдь не случайно, формулы 17 и 18 имеют такой уродливый вид. Поэтому Хеуорс, один из классиков химии углеводов (который явно много размышлял о своем предмете), предложил повсеместно применяемые и по сей день так называемые перспективные формулы сахаров.
Если вы хотите подробно рассмотреть кольцо с камнем, вы вряд ли станете смотреть на него сбоку – исчезнет ощущение объемности и формы кольца. И не будете смотреть вдоль его оси – плохо виден камень. Скорее всего, вы посмотрите на него под некоторым углом – тогда и форма не ускользнет, и камень хорошо виден. Точно так же поступают (мысленно, разумеется) с циклической молекулой сахара при ее изображении по Хеуорсу.
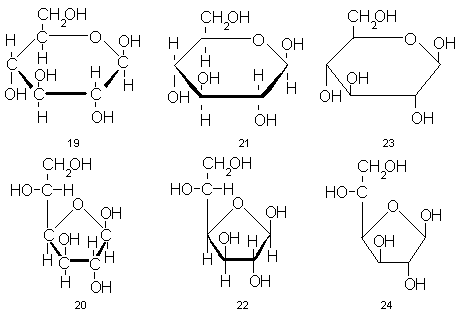
Правило простое:обращенную к наблюдателю часть цикла на рисунке помещают снизу, а от наблюдателя – наверху. При этом заместители автоматически расположатся над или под линиями, очерчивающими цикл. Обычно (хотя и не всегда) атом кислорода, входящий в цикл, помещают в правом верхнем углу (для пираноз) или наверху (для фураноз). Так, например,D-глюкопираноза описывается формулой 19, аD-глюкофураноза – формулой 20. Все ясно и наглядно. Нужно только помнить, что связи заместителей при каждом из углеродных атомов цикла, напримерH-C иC-OH, не лежат на самом деле на одной прямой, как изображается на рисунке, а составляют часть тетраэдрической системы связей центрального углеродноо атома, т.е. уголH-C-OHне равен 180, а близок к 109,5
Формулы Хеуорса ясны и удобны, но еще достаточно сложны и мало годятся для скорописи. Поэтому их обычно упрощают и схематизируют. Прежде всего отказываются от символов углеродных атомов цикла. Так получаются формулы 21 и 22. Затем убирают жирные линии, выделяющие приближенную к наблюдателю часть цикла. И, наконец, не изображают атомы водорода и их связи. Так приходят к формулам 23 и 24 – уже не «популярным», а тем самым, которые встречаются в любой вполне профессиональной статье или книге по химии сахаров.
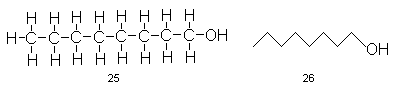
Надо ли доходить до такой степени схематизации, где углерод кажется трехвалентным, а части атомов вообще нет на рисунке?Заглянем на несколько десятков страниц вперед и подумаем, сколькопонадобится места и времени для изображения приведенных там структур формулами типа 19 и 20. Ответ станет ясен. В дальнейшем нам иногда придется прибегать к еще более схематичным изображениям, концентрируя внимание читателей на наиболее существенных особенностях обсуждаемых структур. К слову сказать, усложнение объекта неизбежно ведет к схематизации символики и языка (это общая тенденция всей науки). Важно только не скатиться к вульгаризации. Сравним для примера две структурные формулы октанола-1, одна из которых написана по всем школьным правилам структурных формул (25), а другая так, как становится обычным в современных работах по органической химии (26). Последняя формула при всей ее схематичности даже богаче информацией, чем первая, так как отражает наиболее характерное расположение атомов этого соединения в пространстве:плоский зигзаг.
Насыщенные шестичленные циклы (в нашем случае пиранозы) на самом деле не плоские. Чтобы валентные углы атомов, входящих в цикл мало отклонялись от наиболее энергетически выгодных – тетраэдрических – углов (10928’),молекула вынуждена принимать форму зигзага, замкнутого в цикл. Есть два типа таких зигзагов, обеспечивающих строго тетраэдрическиеуглы между связями атомов в шестичленном цикле. Один из них, отвечающий обычно минимуму энергии (и, следовательно, реализующийся предпочтительно), называется креслом. Для глюкозы такое кресло, выполненное в духе проекции Хеуорса, представлено формулой 27.
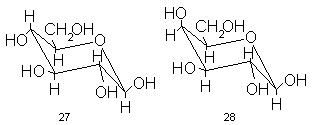
Эта формула очень близка к реальному расположению атомов глюкозы в реальном пространстве, и потому весьма богата информацией. Что же можно в ней усмотреть в первую очередь?Три атома цикла расположены над, а три других – под средней плоскостью, проходящей через центры всех шести связей, образующих цикл. Эта плоскость – основа геометрии кресла. Все пятьCH-связей в цисле ориентированы перпендикулярно этой плоскости:параллельно оси цикла и друг другу.
Такие заместители называют аксиальными (от слова axis-ось). Все же гидроксильные группы глюкозы иCH2OH-группа расположены вблизи плоскости цикла (точнее, их связи с циклом образуют с этой плоскостью углы около 30). Такие заместители называют экваториальными. Теперь видно, что пиранозный цикл в глюкозе охвачен, именно по экватору, почти равномерным кольцом из гидроксильных групп. А в галактозе, например, эта равномерность уже нарушена:гидроксил при С-4 занимает аксиальное положение и его химические свойства существенно отличны от свойств гидроксила при С-4 в глюкозе и всех остальных гидроксилов в галактозе (см. формулу 28)
Обратите внимание, какой контраст составляют эти заключения с теми, которые можно было бы вывести на проекции Фишера (ср. формулы 9 и 10). Так, может показаться, что в глюкозе гидроксил при С-3 стоит особняком, а остальные «скучены» по одну сторону молекулы, тогда как в галактозе, кажется, что гидроксилы при С-3 и С-4 (слева от оси формулы 10) сходны между собой и отличны от остальных. На основании формул типа 27 и 28, так называемых конформационных формул, можно, не прибегая к эксперименту, достаточно обоснованно предсказать множество химических и физических особенностей вещества. Сравнение формул 27 и 28 позволяет, например, оценить относительные скорости окисления глюкозы и галактозы периодатом (IO4-) и даже в общих чертах ход кинетической кривой этой реакции для галактозы, оценить относительное поведение этих сахаров при хроматографии на бумаге, предсказать характерные особенности спектров ядерного магнитного резонанса и даже высказать достаточно обоснованные предположения о том, почему именно глюкоза, а не какой-либо иной моносахарид занимает доминирующее положение в углеводном обмене любой живой системы.
Таким образом, конформационные формулы максимально информативны и приближены к реальности. Казалось бы, ими и нужно пользоваться. Однако именно в их детальности и заключается некоторая слабость.Дело в том, что они отражают не только структуру молекулы, т.е. ту единственную последовательность ковалентных связей атомов, которую молекула сохраняет, пока соединение остается самим собой. Конформационные формулы, помимо этого, отражают одну из тех форм, которые молекула принимает в пространстве, изгибаясь и деформируясь без разрыва ковалентных связей. Для данной молекулы таких форм (так называемых конформаций) в некоторых пределах может быть бесчисленное множество, и мы далеко не всегда знаем, какую же из этих конформаций принимает обсуждаемая молекула в действительности. В случае глюкозы и галактозы мы уверенно (и вполне обоснованно) приписали им конформации 27 и 28. Однако это далеко не всегда можно сделать с такой же уверенностью. Поэтому, когда предпочтительная конформация молекулы известна, или когда хотят подчеркнуть те или иные пространственные особенности молекулы, пользуются конформационными формулами. Если
же нет оснований приписать соединению определенную конформацию или если нет необходимости акцентировать внимание на конформации, обычно пользуются формулами Хеуорса типа 23 или 24.
Мутаротация
Мы сказали, что моносахариды существуют почти исключительно в циклической форме. Однако у способности ациклических моносахаридов быстро и самопроизвольно замыкаться в гетероциклы есть и оборотная сторона:эти циклы в растворе размыкаются тоже быстро. Между этими утверждениями нет противоречия, так как быстрые взаимопревращения отнюдь не исключают доминирования одной из структур (для этого достаточно, чтобы система характеризовалась большой константой равновесия).
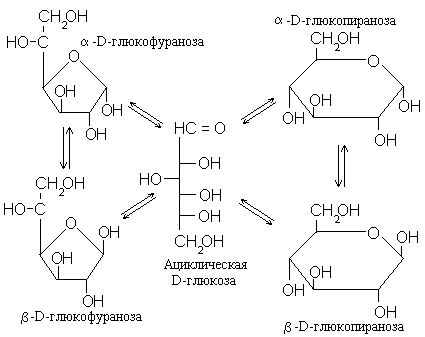
Циклизация моносахаридов может происходить двумя способами:с образованием пиранозы или фуранозы. Однако при образовании полуацеталя плоская карбонильная группа превращается в систему тетраэдрического атома углерода. Возникает новый ассиметрический центр. У него, естественно, могут быть две конфигурации:с полуацетальным гидроксилом вверх (в проекции Хеуорса) или вниз. Эти изомеры*, обозначаемые буквамии, способны к взаимопревращениям в растворе не только через ациклическую форму, но и непосредственно. Итак, на примере все той жеD-глюкозы имеем систему равновесий, изображенную на с.18.
Совокупность показанных на схеме превращений носит название мутаротации. Эта реакция катализируется и кислотами, и щелочами. Поэтому, если построить график зависимости константы скорости этой реакции от pH, получится колоколообразная кривая с минимумом в районеpH 7. При комнатной температуре в нейтральном растворе мутаротация протекает медленно:для достижения
равновесия в среднем требуются многие часы, а в сильнокислых или в сильнощелочных средах равновесие между всеми пятью формами устанавливается практически мгновенно.
Кинетика мутаротации и механизм этой реакции – один из любопытнейших разделов физической органической химии сахаров, на котором мы, однако, не можем здесь останавливаться. Важно только подчеркнуть, что в равновесном растворе моносахарида, как правило, присутствуют все пять форм, хотя чаще всего содержание ациклической оказывается ничтожно мало, а пиранозы резко преобладают. Поэтому во многих реакциях моносахариды в растворе ведут себя как смесь только двух изомеров:- и- пиранозы. В таких случаях (а их большинство) структурную формулу моносахарида принято писать с неопределенной конфигурацией при бывшем карбонильном атоме углерода, как показано дляD-глюкозы иD-арабинозы:
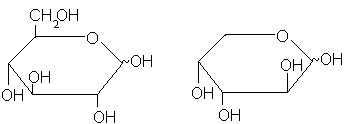
Иное дело – кристалл. В нем находится лишь одна из циклических форм. Например, обычная кристаллическая
глюкоза состоит только из -D-глюкопиранозы. Если же такие кристаллы растворить в воде и немедленно начать измерять удельное вращение раствора (угол, на который раствор оптически активного вещества определенной концентрации вращает плоскость поляризации света), то можно наблюдать быстрые характерные изменения этого угла:сначала быстрые, затем медленные. В конечном итоге удельное вращение стабилизируется на некоторой постоянной величине.
Удельное вращение, измеренное в первый момент, соответствует раствору чистой -D-глюкопиранозы;его изменения во времени характеризуют скорость и направление мутаротации, а стабилизировавшаяся величина – вращение равновесной смеси. По этой причине, в частности, удельное вращение очень удобно для изучения мутаротации.
Удельное вращение – одна из важнейших физических констант оптически активного вещества. Вследствие существования мутаротации для моносахаридов его имеет смысл измерять как константу только после достижения равновесия, так как до этого момента величина удельного вращения зависит от «истории» раствора:от того, из каких кристаллов он приготовлен и какое время отделяет момент приготовления раствора от момента измерения. Напротив, удельное вращение равновесного раствора независимо от этих факторов и является истинной, легко воспроизводимой характеристикой данного моносахарида.
Заметим, кстати, что в величину удельного вращения моносахаридов и их производных вносит аддитивный вклад каждый из имеющихся в нем ассиметрических центров;однако наиболее значителен вклад того из них, который возникает из бывшей карбонильной группы – так называемого гликозидного центра. Почему он носит такое название, станет ясным из следующей главы.
Структура гликозидов
Циклические формы сахаров – полуацетали. Это, вообще говоря, малостабильный тип соединений, склонных либо расщепляться до исходного альдегида или кетона, либо вступать в конденсацию со следующей молекулой спирта (необязательно того же самого) с образованием
полного ацеталя. В сахарах первое направление реакций проявляется в мутаротации. Второе направление столь же характерно. Моносахариды в присутствии кислотных катализаторов реагируют с разнообразными спиртами с образованием полных несимметричных ацеталей, так называемых гликозидов, как показано на схеме на примере образования -этил-L-рамнопиранозида изL-рамнозы и этанола.
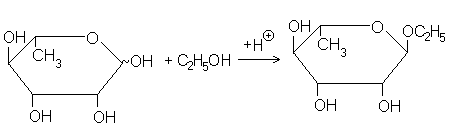
В структуре гликозида можно выделить два фрагмента:моносахаридный остаток, называемый гликозильным остатком (изредка гликоном), и остаток спирта, который называется агликоном. Связь между гликозильным остатком и агликоном носит название гликозидной связи. Термин «гликозиды» - общее название всего класса, а названия гликозидов конкретных моносахаридов производят от названия этих моносахаридов:глюкоза – глюкозиды, галактоза – галактозиды, арабиноза – арабинозиды, рамноза – рамнозиды и т.д.
В структуре каждого гликозида, например приведенного на схеме рамнозида, легко усмотреть соответствие одной из четырех циклических форм исходного моносахарида. Каждой из трех остальных соответствует свой изомер гликозида, которых, таким образом, для данного моносахарида и данного спирта может быть четыре, как покахано на схеме
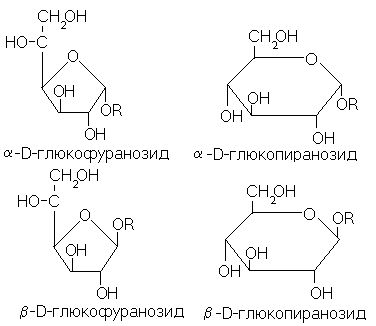
Сходство начинается и кончается структурным подобием гликозильного остатка и одной из циклических форм свободного моносахарида, не распространяясь ни на важнейшие свойства гликозидов, ни на пути их получения. Во-первых, гликозиды устойчивы, и отнюдь не подвергаются самопроизвольным взаимопревращениям:это истинные изомеры, четыре различных устойчивых вещества. Во-вторых, при образовании гликозидов из моносахаридов одна из циклических форм моносахарида совсем не приводит к автоматически к образованию гликозида со структурно подобным гликозильным остатком. Наоборот, как правило, это не происходит. Ниже мы подробнее разберем сложный и важный вопрос о путях синтеза гликозидов. В-третьих, характерные реакции моносахаридов, связанные с наличием у них карбонильной группы (типа образования серебрянного зеркала), полностью отсутствуют у гликозидов.
Аналогично описанным выше гликозидам со связью между агликоном и гликозильным остатком через атом кислорода (О-гликозиды) могут быть построены еще два класса производных по С-1: так называемыеS-гликозиды иN-гликозиды, образующиеся из остатков моносахаридов и меркаптанов или аминов. Как и О-гликозиды, они также могут существовать в виде четырех изомеров. Свойства гликозидов всех трех типов существенно зависят от электроотрицательности и основности гетероатомов гликозидной связи. Наиболее специфичны и непохожи на остальные свойстваN-гликозидов, особенно если последние образованы из первичных аминов с достаточно высокой основностью. Такие соединения легко получаются непосредственно из моносахарида и амина (например, при непродолжительном нагревании с кислотой), а в водных растворах испытывают таутомерные превращения, аналогичные мутаротации свободных моносахаридов. Последнее особенно резко отличает такиеN-гликозиды от их кислородных и серных аналогов, характеризующихся высокой стабильностью циклической системы.
Наиболее распространенной в природе и важной для химии углеводов является О-гликозидная связь*.
Гликозиды простых спиртов, таких как метанол или этанол,- обычно синтетические вещества. А вот большинство известных гликозидов сложных спиртов – природные соединения (это, конечно, не значит, что они не могут быть получены синтетическим путем). Природные гликозиды чрезвычайно разнообразны:они могут содержать различные углеводные остатки (причем для каждого, конечно, возможны четыре изомера) и очень различные агликоны. Большое разнообразие структур агликонов природных гликозидов можно понять. Дело в том, что живые системы весьма широко пользуются присоединением углеводов к тем или иным соединениям, главным образом, малорастворимым в воде, для повышения их растворимости в водной среде (основной жидкой фазе клетки), для снижения токсичности вредных метаболитов и т.д. Главным, почти универсальным способом присоединения сахаров, которым пользуется для этих целей природа, является образование гликозидной связи. Иными словами, гликозидный центр моносахаридов представляет собой их универсальный «стыковочный узел», применяемый для связывания с другими системами и, как мы увидим ниже, друг с другом.
Структура и разнообразие олигосахаридов
Моносахариды – полифункциональные соединения. Многие их реакции обусловлены, как мы видели, преимущественно карбонильной группой. В других же они выступают прежде всего как спирты. В качестве спиртов они могут служить агликонной составляющей гликозидов. Так, возникают дисахариды, в которых два моносахаридных остатка соединенных гликозидной связью, причем один из них является гликозильным остатком, а другой – агликоном. Так, например, в молочном сахаре – лактозе – остаток D-галактозы составляет гликозильную часть молекулы, а остатокD-глюкозы служит агликоном. В другом дисахариде – рутинозе – роль гликозильного остатка и агликона выполняют соответственно остаткиL-рамнозы иD-глюкозы (см. с. 23).
Моносахариды не просто спирты, а многоатомные спирты. Поэтому каждый из них может выступать в качестве агликона несколькими способами в зависимости от того, к какому из гидроксилов присоединен гликозильный остаток.
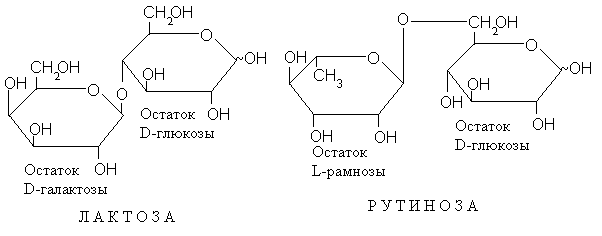
А эти остатки, как мы видим, могут иметь четыре различные структуры для каждого моносахарида. Но и это еще не исчерпывает разнообразия дисахаридных структур, так как и полуацетальный гидроксил может служить местом присоединения гликозильного остатка. Примером таких дисахаридов – их называют невосстанавливающими, так как в отличие от остальных дисахаридов и от моносахаридов, они не восстанавливают реагенты типа фелинговой жидкости или аммиачного раствора окиси серебра – может служить трегалоза (29). В таком дисахариде любой из двух моносахаридных остатков можно произвольно считать либо гликозильным, либо агликоном. Другой пример невосстанавливающего дисахарида – сахароза (или тростниковый сахар) (30), построенная из остатков D-глюкозы иD-фруктозы.
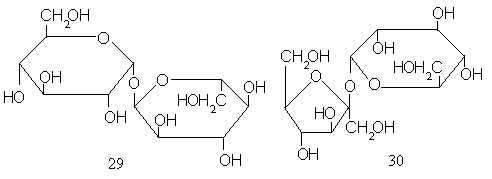
По той же схеме, по которой строятся дисахариды, можно связать цепочку из трех моносахаридных остатков. Такие соединения называются трисахаридами. Их примерами могут служить целлотриоза (31) и солатриоза (32). Первая построена из трех остатков D-глюкозы, вторая – из остатковL-рамнозы,D-глюкозы иD-галактозы.
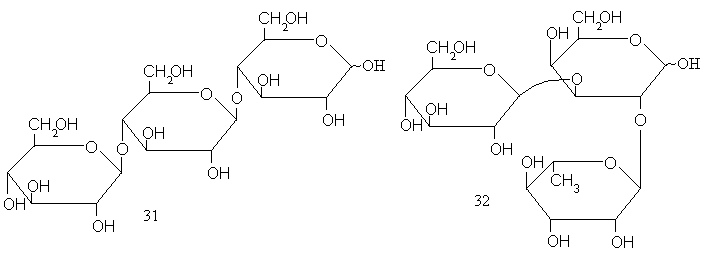
При переходе к трисахаридам обнаруживаются две качественно новые особенности компоновки структур:во-первых, в соединениях типа целлотриозы, центральный моносахаридный блок выступает одновременно и в роли агликона, и в роли гликозильного остатка;во-вторых, два гликозильных остатка могут быть присоединены к одному и тому же моносахаридному остатку (который таким образом оказывается, так сказать, дважды агликоном). В цепи моносахаридных остатков появляется разветвление. Такие трисахариды называются разветвленными, а остаток, к которому присоединены два гликозильных остатка(«дважды агликон»), называют точкой ветвлений. Так, солатриоза (32) – разветвленный трисахарид, точкой ветвления в котором служит остатокD-галактозы.
Аналогично трисахаридам устроены тетрасахариды (четыре моносахаридных остатка), пентасахариды, гексасахариды и т.д. Весь же класс таких соединений называют олигосахаридами («олиго»-несколько). Если говорить о качественно новых структурных особенностях высших олигосахаридов, то можно указать на возможность существования нескольких разветвлений в одной молекуле.
Олигосахариды могут отличаться одним от другого структурой входящих в них моносахаридов, их последовательностью в цепи, наличием или отсутствием разветвлений, размерами циклов (фураноза-пираноза), конфигурацией гликозидных центров и местами присоединения гликозильных остатков к агликонам. Все это в совокупности приводит к возникновению невообразимо огромного числа возможных изомеров даже у сравнительно простых олигосахаридов.
Обратимся к арифметическому расчету. Из двух разных гексоз, скажем из D-глюкозы иD-галактозы, можно
построить 56 изомерных дисахаридов. Из трех гексоз (например, из D-глюкозы,D-галактозы иD-маннозы) – 4896 изомерных трисахаридов, из четырех гексоз – 374784 тетрасахарида. Если же учесть еще возможные вариации в структуре исходных моносахаридов, то цифры становятся поистине астрономическими. Так, из восьми гексозD-ряда можно построить различных дисахаридов – 3136, трисахаридов – 1645056 и т.д. Но не будем увлекаться. Вспомним, что число индивидуальных органических соединений всех классов человечеству пока известно всего несколько миллионов, а олигосахаридов среди них – меньшинство. К чему же тогда запугивать читателя такой арифметикой?А вот к чему.
Во-первых, из того, что подавляющее большинство этих несметных полчищ олигосахаридов нам неизвестно, еще не следует, что их не может быть вообще. Поэтому при изучении строения нового олигосахарида исследователь обязан учитывать, что это соединение может иметь любую структуру из числа тех тысяч и миллионов изомеров, возможность существования которых предсказывает для него структурная теория. Например, если мы выделили тетрасахарид и уже знаем, из каких именно моносахаридов он состоит (пусть это будут для определенности четыре различных гексозы), то дальнейшая задача структурного исследования – выбрать для него одну (единственную!) структуру из 374784 возможных. На случайный выигрыш в такой лотерее рассчитывать не приходится.
Во-вторых, для живой клетки такое огромное разнообразие возможных структур, включающее считанные единицы мономерных остатков, означает гигантские информационные возможности, совершенно несопоставимые по мощности с возможностями такого классического информационного материала, как последовательность нуклеотидных звеньев в нуклеиновых кислотах. Вспомним:трехбуквенный генетический код позволяет построить из четырех основных природных нуклеотидов всего 64 «слова», тогда как из восьми гексоз (а разнообразие природных моносахаридов гораздо больше) уже можно составить 1645056 трисахаридных «слов»*.
Такое сопоставление заставляет задуматься. Неужели эволюция сумела создать сахара и не сумела как следует распорядиться их информационной емкостью?В течение длительного времени казалось, что действительно не сумела. Однако в последние годы становится ясно, что олигосахаридные остатки на поверхности клеток и макромолекул служат тем сигналом, по которому клетки или макромолекулы различают друг друга. Иначе говоря, эволюция использовала информационные возможности сахаров, и притом наиболее рациональным и экономным способом:там, где при помощи минимального числа носителей информации нужно добиться максимального, практически неограниченного разнообразия индивидуальных характеристик.
Структура полисахаридов
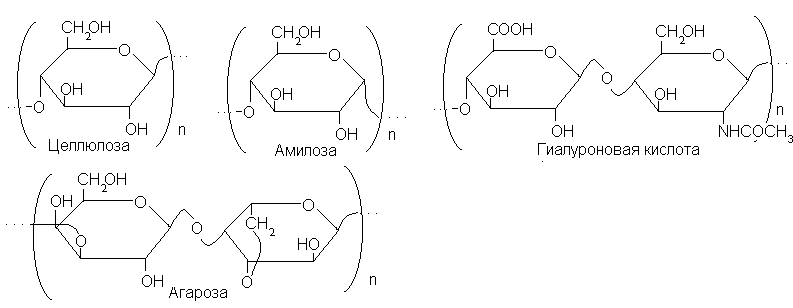
Углеводные цепи, построенные по принципу олигосахаридов, можно продолжать почти до бесконечности. Так создаются высокомолекулярные структуры – полисахариды. Вот несколько примеров линейных регулярных полисахаридов (в квадратных скобках – фрагменты, отвечающие так называемым повторяющимся звеньям) (см. с. 27).
Целлюлоза построена из остатков моносахаридов одного типа – из остатков глюкопиранозы. Все гликозидные связи имеют -конфигурацию и соединяют гликозидный центр одного остатка с кислородным атомом при С-4 следующего (такие связи сокращенно обозначают-14). Амилоза устроена аналогично, но все гликозидные связи имеют противоположную конфигурацию (-). В гиалуроновой кислота (одним из наиболее распространенных полисахаридов соединительной ткани) в цепи чередуются остатки двух разных моносахаридов –D-глюкуроновой кислоты иN-ацетил-D-глюкозамина – со связями-13 и-14соответственно. В агарозе, главном гелеобразующем компоненте агара, также чередуются остатки двух моносахаридов: -D-галактопиранозы и 3,6-ангидро--L-галактопиранозы.
Все четыре рассмотренных полисахарида имеют неразветвленную углеродную цепь и называются в связи с этим неразветвленными, или линейными. Замечательная особенность их структур – высокая регулярность. Это значит, что один сравнительно небольшой фрагмент структуры

многократно повторяется на всем протяжении цепи, причем других структурных элементов в полисахариде не содержится. Такой фрагмент называют повторяющимся звеном. Так, например, повторяющееся звено целлюлозы – 14-связанный остаток-D-глюкопиранозы, амилозы – 14-связанный остаток-D-глюкопиранозы, гиалуроновой кислоты и агарозы – соответствующие дисахаридные остатки.
Понятие повторяющегося звена, даже для таких простейших структур, как целлюлоза, амилоза, гиалуроновая кислота или агароза, не так примитивно, как может показаться на первый взгляд. Можно, конечно, отнестись к нему просто как к удобной форме сжатой записи, отражающей основные черты ковалентной структуры цепи, так:
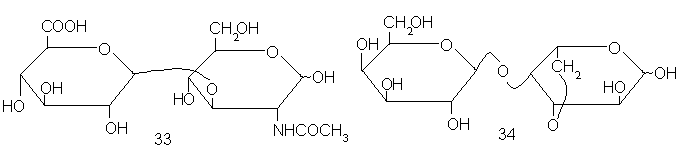
Подобная запись не только описывает структуру, но и является прямым выводом из результатов химического анализа этих структур. Например, можно осуществить такое расщепление гиалуроновой кислоты и агарозы, при котором практически единственными продуктами будут дисахариды 33 и 34 – гиалобиоуроновая кислота и агаробиоза соответственно, из чего следует, что именно они являются «мономерами», из которых построены эти полимеры.
Более глубокий анализ структур этих полисахаридов может, однако, привести к другим выводам.
Для целлюлозы и амилозы хорошо известна характерная конформация цепей, т.е. то, как макромолекула организована в пространстве. Для целлюлозы это прямой стержень, в котором каждое следующее звено повернуто на 180по отношению к предыдущему, как показано в формуле 35.

Такая структура действительно строго регулярна и периодична, т.е. сдвиг определенного участка цепи вдоль ее оси приводит к точному наложению на следующий участок – подобно тому, как это имеет место в кристалле. В этом смысле молекула целлюлозы – одномерный кристалл. Из формулы 35 легко видеть, что такой минимальный участок (шаг цепи) – это не моносахаридный, а дисахаридный остаток. Поэтому с точки зрения конформации цепи повторяющимся звеном в целлюлозе является не остаток глюкозы, а остаток дисахарида целлобиозы.
С амилозой дело обстоит сложнее. Ее молекула – спираль, на одном витке которой помещается точно шесть остатков глюкозы. Как любая правильная спираль, эта система повторяет сама себя, если ее сдвинуть вдоль оси на длину одного витка. В этом смысле повторяющееся звено амилозы представляет собой отрезок цепи из шести моносахаридных остатков, т.е. остаток гексасахарида мальтогексаозы.
Применительно к гиалуроновой кислоте и агарозе дисахаридные фрагменты также не отражают строения конформационных повторяющихся звеньев этих полисахаридов. Однако на этом примере нам хотелось бы указать еще один аспект понятия повторяющегося звена. Дисахариды 33 и 34, как уже говорилось, являются продуктами частичного расщепления цепей химическими методами. Поэтому естественно приписать этим полисахаридам структуру из повторяющихся звеньев именно этих дисахаридов. Поскольку к такой структуре
приводит логика химического исследования, соответствующий фрагмент принято называть «химическим» повторяющимся звеном.
Точно такую же цепь можно, однако, построить иначе, взяв за основу структуру изомерных дисахаридов 36 и 37 (они получаются при сдвиге вдоль цепи не на два, а на одно моносахаридное звено)*.

Многие полисахариды синтезируются клеткой по такой схеме:сначала происходит синтез олигосахарида, а затем его поликонденсация, сшивание в длинные цепи. Такой олигосахарид в биологическом смысле, т.е. с точки зрения путей биосинтеза этого полисахарида, и является истинным мономером полисахаридной цепи. Поэтому такой фрагмент называют «биологическим» повторяющимся звеном. И оно совсем необязательно совпадает с химическим повторяющимся звеном.
Можно, наконец, рассмотреть и еще один – также биологический – аспект понятия о повторяющемся звене, связанный с взаимодействием готовой полисахаридной цепи с другими макромолекулами в живых системах. Речь в данном случае идет о том, каков минимальный фрагмент цепи, воспринимаемый другими молекулами или системами (назовем их рецепторами) как характерный признак данного полисахарида. Сюда относится широкий круг феноменов, таких, как иммунные реакции организма, сортировка макромолекул в клетке и в организме, преодоление клеточных барьеров, метаболизм полисахаридов и т.д.
Рассмотрим лишь один наиболее простой пример:ферментативный гидролиз полисахаридов. Распространенный фермент животных организмов (лизоцим) специфически расщепляет гликозидные связи-14-связанных
остатков N-ацетил-D-глюкозамина в полисахаридных цепях. В частности, он легко катализирует гидролиз полисахаридных цепей хитина*:

Для того, чтобы фермент мог нормально работать, его рецептору нужно одновременно «чувствовать» участок цепи из шести остатков глюкозамина: тогда он способен выполнять свою функцию – расщеплять четвертую гликозидную связь в этой последовательности. Если же регулярная цепь содержит меньше, чем шесть остатков, или они связаны иначе, чем в хитине, фермент не работает**. Таким образом, «с точки зрения лизоцима», повторяющееся звено в хитине – гексасахаридный фрагмент.
Полисахариды, о которых мы говорили выше, относятся к числу простейших полисахаридных структур. Даже неразветвленные полисахариды, построенные из остатков моносахарида одного типа, могут иметь гораздо более сложное строение. Так, например, глюкан овса содержит сопоставимые количества остатков -D-глюкопиранозы, связанных13-и14-связями. При этом, в отличие, например, от агарозы или гиалуроновой кислоты, эти связи не чередуются правильным образом и не образуют сколько-нибудь значительных блоков из однотипных связей. Поэтому чередование двух типов связей в полисахаридной цепи приходится в данном случае характеризовать как хаотическое. Этим утверждением можно было бы и ограничиться. Мы, однако, пока не знаем, является ли хаотичность истинной или кажущейся. В самом деле, здесь может быть (хотя отнюдь не обязательно должна
быть) упорядоченность высшего порядка, которую мы пока не в состоянии уловить при помощи существующих (относительно грубых) методов исследования. Это можно пояснить, прибегнув к такой аналогии.
Статистический анализ страницы текста показал бы более или менее случайное распределение в нем всех букв алфавита, не обнаружил бы ни правильного чередования (например, каждая пятая буква – «а»), ни блочного строения (нет более или менее длинных последовательностей одинаковых букв). Между тем буквы в тексте высоко организованы по крайней мере на трех уровнях:они сгруппированы в осмысленные слова, слова объединены в грамматически правильные фразы, а последовательность фраз логически организована в информативный текст.
Таким образом, мы видим уже два принципа построения полисахаридных цепей: правильное чередование (регулярность) и хаотическое расположение фрагментов (снова подчеркнем: хаотическое с точки зрения сегодняшних знаний). Возможен, кроме того, и блочный принцип. Так, например, устроена альгиновая кислота – полисахарид бурых водорослей (кстати, имеющий большое практическое значение как гелеобразователь). В ее линейную цепь входят остатки-D-маннуроновой кислоты (38) и-L-гулуроновой кислоты, соединенные14-связями.
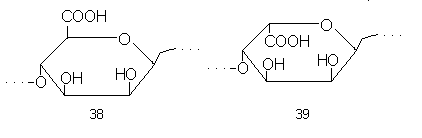
Структурный анализ этого полисахарида показывает, что в его цепи имеются участки трех типов: более или менее длинные последовательности из мономеров одного типа, аналогичные последовательности мономеров второго типа, и участки, где остатки маннуроновой и гулуроновой кислот чередуются более или менее хаотически. Схематически такую структуру можно изобразить так:
…А-А-А-А-А-А-А-А-А-А-А-Б-А-Б-Б-А-А-
-Б-А-Б-Б-А-Б-Б-Б-Б-Б-Б-Б-Б-Б…
Наконец, сравнительно недавно было установлено, что некоторые полисахаридные цепи могут быть одновременно
менно и нерегулярными, и регулярными, не нарушая при этом незыблемый принцип логики – закон исключительного третьего.
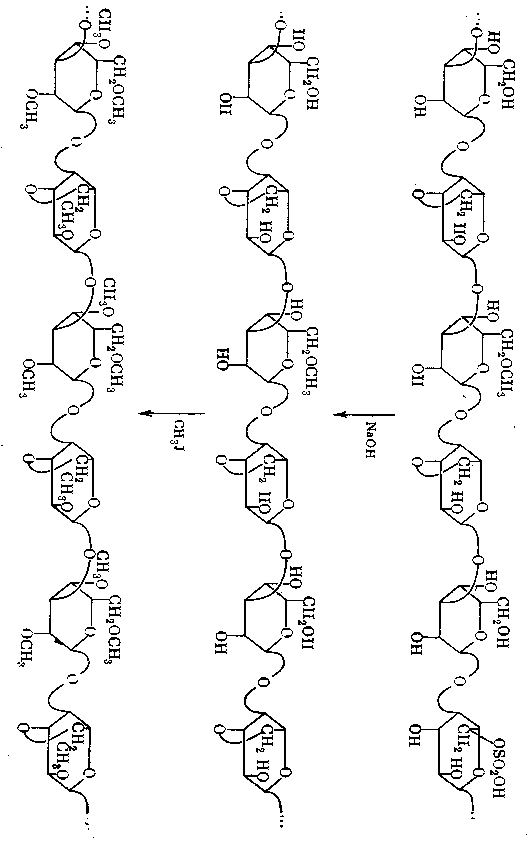
Возьмем один из полисахаридов красных водорослей – порфиран. Он построен из чередующихся остатков D-иL-галактопиранозы (и в этом смысле подобен агарозе). Однако часть остатковD-галактозы превращена в метиловый эфир (по положению 6), а остаткиL-галактозы входят в полисахарид частично в виде эфиров серной кислоты по положению 6, а частично в виде 3,6-ангидропроизводного, как в агарозе. Вариации каждого типа остатков распределены вдоль цепи хаотически, поэтому в целом цепь весьма нерегулярна. Однако, если порфиран обработать щелочью, то в остатках галактозы, этерифицированных серной кислотой, происходит замыкание 3,6-ангидроциклов. В результате все остаткиL-галактозы становятся одинаковыми:нерегулярность по этим остаткам исчезает.
Дальше можно все гидроксильные группы полисахарида превратить в метиловые эфиры (это делается при помощи метилирования – весьма важной в химии полисахаридов реакции, к рассмотрению которой мы еще вернемся). При этом унифицируется структура всех остатков D-галактозы. Получается производное полисахарида, содержащее совершенно правильное чередование метилированных остатковD-галактопиранозы и3,6-ангидро-L-галактопиранозы (полисахарид становится регулярным).
Весьма важно, что метилирование заведомо регулярного полисахарида (агарозы) приводит к точно такому же (идентичному) метиловому эфиру, который получается описанным путем из порфирана (см. схему, с.34).
Такая «регулярность-нерегулярность» была обнаружена английским ученым Рисом и названа им «замаскированной регулярностью» или «замаскированной повторяющейся структурой». В последнее время накапливается ряд данных, указывающих на то, что такая замаскированная регулярность – довольно распространенный принцип построения многих линейных полисахаридных цепей. Суть этого принципа не сводится только к тому, что нерегулярности могут быть (фактически или только в принципе) устранены с помощью той или иной обработки. Дело здесь значительно глубже. Можно полагать, что многие типы полисахаридов имеют достаточно регулярный
скелет цепи, в которой некоторые звенья варьируют по типу или (и) конфигурации отдельных заместителей, что сравнительно мало отражается на геометрии макромолекулы в целом. А иногда, наоборот, такие вариации вносят в регулярную структуру определенные, биологически осмысленные нарушения, вызывающие, например, изломы в правильных спиралях. Подробнее об этом мы расскажем ниже.
До сих пор мы рассматривали только линейные полисахариды и видели, что даже для простейших биополимеров этого класса, построенных из остатков одного-двух моносахаридов, возможны весьма значительные вариации типов структур, не говоря уже о бесчисленных вариациях конкретных структур внутри каждого типа. Системы, однако, резко усложняются, а возможности вариаций практически безгранично возрастают, если мы еще учтем существование разветвлений. Геометрия разветвленных полисахаридов может быть схематически типизирована следующим образом.
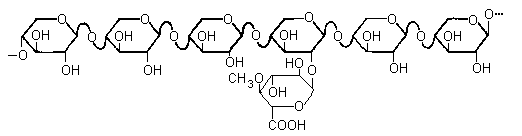
Простейшие разветвленные системы содержат одну длинную линейную цепь, к которой присоединены разветвления в виде одиночных моносахаридных остатков или в крайнем случае в виде коротких олигосахаридов. Так устроен, например, ксилан, выделенный из березы. К регулярной цепи из -14-связанных остатковD-ксилопиранозы присоединены единичные остатки 4-О-метил-D-глюкуроновой кислоты, в среднем один на каждые десять ксилозных звеньев. Такие системы иногда называют «гребнеобразными полисахаридами».
Следующий шаг на пути усложнения структур – полимерный характер боковых цепей, т.е. случай, когда боковые цепи сами являются остатками более или менее высокомолекулярных полисахаридов. Простейшим примером
может служить один из полисахаридов бурых водорослей – так называемый растворимый ламинарин. Его главная цепь построена из -13-связанных остатковD-глюкопиранозы, некоторые из которых несут разветвления в положении 6, а сами разветвления представляют собой тоже регулярные полисахаридные цепи, структурно вполне аналогичные главной. Такую молекулу уже трудно изобразить на бумаге достаточно подробно. Поэтому мы здесь прибегнем лишь к схематичному изображению, в котором полисахаридные цепи символизируются стрелками:

Боковые полисахаридные цепи, в свою очередь, могут быть разветвлены, а полисахариды, присоединенные к этим боковым цепям, также могут нести разветвления и т.д. Так строятся древовидные структуры высокоразветвленных полисахаридов.
Для иллюстрации рассмотрим строение одного из простейших представителей такого класса – амилопектина, который вместе с амилазой составляет крахмал. Аналогично амилопектину устроен животный крахмал (гликоген). Все цепи этих полисахаридов – и основная, и боковые, и разветвления в разветвлениях и т.д. построены однотипно и состоят из -14-связанных остатковD-глюкопиранозы. Все узлы разветвлений – точки ветвления – построены так же единообразно: боковые цепи присоединены к другой цепи гликозидной связью в положение 6 остатка глюкозы (см. схему, с.37).
И, наконец, последний структурный тип полисахаридов можно было бы назвать ультраразветвленным. Так устроен галактан одного из видов улиток. К остатку галактозы присоединено два галактозных остатка в положениях 3 и 6. Каждый из этих остатков, в свою очередь, несет по два других галактозных остатка, также присоединенных в положения 3 и 6, к которым аналогичным образом присоединены еще по два галактозных остатка, и т.д. Таким образом весь полисахарид (а он весьма высокомолекулярен) состоит из сплошных разветвлений.

Каждый моносахаридный остаток, за исключением концевых, является узлом ветвления, а понятие главной цепи теряет смысл (так как любую из большого числа цепей, которые можно выделить в структуре такого полисахарида, можно формально считать главной).
Строение такого галактана представлено на схеме (кружок со стрелкой символизирует остаток галактопиранозы, а его острый конец – гликозидный центр).

Следует сказать, что между четырьмя названными крайними типами может существовать бесчисленное множество промежуточных структур, что структуры узлов ветвления и полисахаридных цепей внутри одной полисахаридной молекулы вовсе не обязательно одинаковы и что полисахаридные молекулы могут быть построены не из одного, а из двух, трех, четырех, пяти, шести, семи и даже восьми типов моносахаридов. (Подчеркнем, что мы разбираем не просто теоретические возможности, а структурные особенности, встречающиеся в реальных полисахаридах). Все
это создает гигантские, истинно неисчерпаемые возможности вариаций полисахаридных структур и их пространственной организации, далеко превосходящие возможное разнообразие структур каких-либо других типов макромолекул живых систем (что можно показать строго математически). А мы еще ничего не сказали о структурных вариациях внутри каждого конкретного полисахарида. Но это требует специальной главы.
Микрогетерогенность
Что такое «чистое вещество», «индивидуальное вещество», «гомогенное вещество»?По классическому определению (если отвлечься от неизбежного количества присутствия большего или меньшего количества примесей), это вещество, все молекулы которого одинаковы по структуре. Подобное определение, казалось бы, не должно вызывать ни сомнений, ни двусмысленных толкований. И так оно и есть, пока речь идет о низкомолекулярных веществах или даже о многих сравнительно высокомолекулярных. Однако уже на примере глюкозы видно, что дело тут может оказаться не таким простым.
Действительно, если речь идет о кристаллической -D-глюкопиранозе, трудно усомниться в том, что она по всем меркам подходит под определение «индивидуальное вещество». Однако стоит только растворить эту самую глюкозу в воде, как начинается мутаротация, в результате которой мы получим раствор четырех циклических форм моносахарида. Можно ли говорить о нем, как о растворе индивидуального вещества? И да, и нет. Но, может быть, дело в том, что оно находится именно в растворе, где есть еще один компонент – растворитель?
Упарим раствор, отогнав воду в вакууме. В остатке мы получим сироп, содержащий все четыре циклические формы. Индивидуально ли такое вещество?По-видимому, нет, так как в нем присутствуют молекулы четырех структурно различных типов – четырех изомеров. При стоянии этот сироп самопроизвольно закристаллизовался, мы опять получили индивидуальную-D-глюкопиранозу. Как же так:из смеси четырех веществ, не прибегая к химическим или физическим воздействиям, мы снова получили индивидуальное вещество? Видно, с понятием индивидуальности и в самом деле не все обстоит так просто, как кажется.
Возьмем синтетический полимер, например полиэтилен. Можно получить полиэтилен высокой степени чистоты. Индивидуален ли такой полимер? Да, в том смысле, что все его молекулы устроены одинаково:это линейные цепи из большого числа звеньев–CH2-CH2-. И нет, в том смысле, что молекулы в образце полиэтилена различаются по молекулярной массе. Эти различия могут быть велики или малы (в зависимости от молекулярно-массового распределения);но в синтетических полимерах они есть всегда, так как рост каждой отдельной цепи при их синтезе подчиняется закону случая. Таким образом, в образце полимера не только не «все молекулы одинаковы по структуре», но в нем множество различающихся по структуре молекул.
Правда, небольшие вариации молекулярной массы высокомолекулярного соединения при неизменности повторяющейся структуры – это, казалось бы, нечто сравнительно мало существенное. Трудно ведь допустить, чтобы полиэтилен с молекулярной массой 100000 сильно отличался от полиэтилена с молекулярной массой 99500 или тем более от смеси двух полиэтиленов с молекулярными массами 99500 и 100500. Так что применительно к полимерам понятие «индивидуальное вещество» приходится трактовать расширенно.
Но то синтетические полимеры. Часть биополимеров синтезируется в клетке отнюдь не по закону случая. Наиболее известный пример – белки. Сборка их полипептидных цепей происходит на рибонуклеиновой матрице, вследствие чего положение каждой аминокислоты строго детерминировано. Иначе быть не может – ошибка в положении даже одной аминокислоты – уже ЧП, как правило, с тяжелыми и нередко летальными последствиями для клетки. Поэтому белки могут быть получены в истинно индивидуальном состоянии (в том смысле, в котором это понятие применяют для низкомолекулярных веществ). Биосинтез полисахаридов протекает по совершенно иной схеме: здесь нет матрицирования, структура и размер молекул управляются иными механизмами. Хотя в большинстве случаев мы мало знаем об этих механизмах, нам известен результат их функционирования. А он принципиально отличен от результата биосинтеза белков.
Все изученные к настоящему времени полисахариды отличаются так называемой микрогетерогенностью. Это
значит, что в любом образце индивидуального (очищенного всем доступными современной науке методами) полисахарида некоторые количественные параметры, при помощи которых можно описать его структуру, варьируют в некоторых пределах. Чаще всего варьирует молекулярная масса, число разветвлений на макромолекулу, длина боковых цепей, соотношение моносахаридных остатков (если полисахарид не регулярен), степень замещения неуглеводными остатками (типа эфиров серной кислоты или метиловых эфиров). Поэтому находимые экспериментально структурные характеристики такого типа почти всегда означают результат усреднения по всем имеющимся в изученном образце молекулам полисахарида. Так, например, если анализ дает для полисахарида молекулярную массу 100000, это означает, что в образце есть молекулы с массой и 95000, и 97000, и 105000 и т.д. (разумеется эти вариации не непрерывны: «квантом» молекулярной массы в данном случае является одно моносахаридное звено). Точно так же, если установлено, что в среднем полисахарид имеет 100 разветвлений, в нем можно обнаружить молекулы и с 90, и с 91, и с 92 и т.д. разветвлениями. Истинная картина распределения этих параметров почти никогда не бывает известна (из-за исключительно больших экспериментальных трудностей). Совокупность имеющихся данных, однако, создает впечатление, что структурные вариации в пределах индивидуального полисахарида подчиняются лишь закону случая. Подчеркнем: речь идет лишь о некоторых структурных параметрах, а отнюдь не обо всех.
Интересно оценить количественно, каким может быть число структурных вариантов индивидуального полисахарида.
Рассмотрим гипотетический разветвленный полисахарид, построенный из двух типов мономерных остатков (А и Б) с такой структурой:
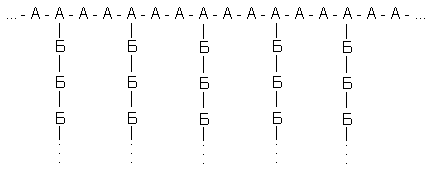
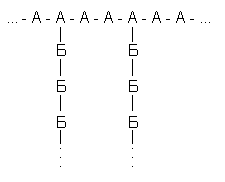
Примем условно, что у всех его молекул длина главной цепи одинакова (240 остатков), что положение разветвлений строго фиксировано (у каждого третьего), и посмотрим, что дадут вариации только одного параметра – длины боковых цепей. Наложим и на этот параметр жесткие ограничения. Пусть любая из боковых цепей может содержать либо 9, либо 10 остатков Б;причем появление цепи из 9 или 10 остатков в любом месте равновероятно. Таких цепей на молекулу, как ясно из принятых характеристик – 80. Тогда число возможных структур для полисахарида равно2801,2*1024, т.е. вдвое больше, чем содержится молекул в моле вещества. Это значит, что в достаточно малом образце полисахарида может не найтись двух одинаковых молекул:все молекулы будут различаться по структуре*!
Этот вывод заметно отличается от того определения индивидуального вещества, которое мы давали вначале. И тем не менее полисахарид с такими характеристиками любой специалист по химии углеводов счел бы индивидуальным веществом, высокоочищенным, гомогенным. Заметим еще, что в нашем расчете мы не учли возможности вариации других структурных параметров, что в реальных полисахаридах число разветвлений может быть и 100, и 250 и более и что на самом деле вариации в длине
полисахаридных цепей (как основной, так и боковых) могут быть гораздо шире, чем плюс-минус одно звено.
Итак, что же все-таки это такое – индивидуальный полисахарид?Может показаться, что полисахариды вообще построены «как попало» и что говорить об их структуре (в классическом значении этого слова) бессмысленно. Но это далеко не так. Отнюдь не любые структурные единицы полисахарида варьируют, размываются микрогетерогенностью. Среди них есть и консервативные, строго фиксированные. Трудность состоит, однако, в том, что комбинация консервативных и вариабельных признаков и степень вариабельности вариаблельных индивидуальны для каждого полисахарида (постольку, поскольку об этом можно судить сейчас, учитывая малую изученность микрогетерогенности, как явления). Поэтому, приступая к изучению структуры нового полисахарида, мы заранее не знаем, какие его характеристики окажутся усредненными величинами, а какие – строго детерминированными. Можно только полагать, что и консервативность, и вариабельность тех или иных характеристик строго подчинены выполнению полисахаридом его биологической функции, т.е. биологически оправданы. Вот простой пример.
Главная функция целлюлозы в растительной клетке – быть структурирующим материалом клеточной стенки. Последняя устроена весьма сложно, но приближенно может быть уподоблена армированному материалу типа стеклопластика или железобетона, в котором длинные пучки нитевидных молекул целлюлозы вплавлены в менее упорядоченный материал. Основой такой конструкции являются микрофибриллы – пачки длинных молекул. Для упаковки микрофибрилл молекула целлюлозы должна иметь вид длинного жесткого стержня, каким она в действительности и является.
Даже значительные вариации молекулярной массы целлюлозы не помешают ее молекулам образовывать микрофибриллы. Однако стоит только изменить конфигурацию одной единственной гликозидной связи на макромолекулу (- вместо -), как в жестком стержне появится излом, микрофибриллы не смогут упаковаться, целлюлоза полностью утратит способность выполнять свою главную биологическую функцию. И для этого достаточно, чтобы в биосинтезе целлюлозы была допущена одна ошибка на тысячи правильно построенных гликозидных связей. Естественный
отбор таких ошибок не прощает, и поэтому в этом пункте растительная клетка не ошибается никогда.
Приведенный пример характерен, так как обычно в полисахаридах именно конфигурация гликозидных связей оказывается наиболее консервативным, а молекулярная масса – наиболее вариабельным параметром структуры. Однако подчеркнем еще раз:в каждом типе полисахаридов могут быть свои консервативные и вариабельные элементы. Вопрос в том, что именно нужно для биологической функции. Но вот этого-то мы чаще всего и не знаем, и в конечном итоге именно для выяснения этого вопроса и работают исследователи структуры полисахаридов.
Смешанные биополимеры
Давно уже известны четыре класса полимеров живых систем – биополимеров. Это белки, нуклеиновые кислоты, полисахариды и липиды. Четыре, так сказать, «кита».
Как обстоит дело с такими «китами» в естественных науках? Чаще всего так. Сначала – хаотическое нагромождение объектов исследования. Приходит Наблюдатель. Он просто описывает как можно точнее и подробнее отдельные объекты. Мы узнаем много нового, но хаос накопленных фактов остается первозданным. Затем является Систематик. Он группирует факты, объединяет однородные или сходные в классы, типы и т.д., создает некоторую систему поиска – словом, раскладывает все по своим полочкам. На этом этапе обычно и появляются те самые «киты». Затем приходят другие Наблюдатели (чаще всего во множественном числе). Эти говорят: «Позвольте! А вот это не укладывается в вашу систематику, а здесь явно промежуточный тип, а это вообще вне известной серии фактов!». Тогда Систематику (или его последователям) приходится вводить подклассы, подтипы, новые классы и т.п. Наконец, приходит Исследователь и устанавливает, что классы, типы и т.д. – все это хорошо для школьных учебников, а реальные объекты образуют почти непрерывные переходы от одного типа к другому, а сами типы (или классы) суть только схематические описания некоторых крайних, часто нетипичных случаев.
Нуклеиновые кислоты стоят несколько особняком;но для белков, полисахаридов и липидов ситуация сейчас явно близка к той, к которой приходит наш Исследователь. Во многих полисахаридах при ближайшем рассмотрении
можно обнаружить большой или маленький ковалентно привязанный пептидный фрагмент. А очень многие классические белки, как выясняется при подробном анализе, несут на поверхности своих глобул короткие олигосахаридные цепи. Однако первые продолжают по инерции называть просто полисахаридами, а вторые – просто белками.
Между этими крайностями имеются всевозможные системы, содержащие больше или меньше белковой компоненты и больше или меньше полисахаридной. Такие соединения называют гликопротеинами, а также протеогликанами (гликаны – общее название полисахаридов). Точного определения у этих терминов нет, и те или иные классы биополимеров называют либо гликопротеинами, либо протеогликанами, руководствуясь при этом скорее традицией, чем какими-либо четкими критериями. Аналогично обстоит дело с ковалентно связанными углеводами и липидами: их называют гликолипидами, а также липополисахаридами. Весь же тип природных высокомолекулярных соединений, включающих ковалентно связанные фрагменты полимеров более чем одного класса, называют смешанными биополимерами, а в последнее время – гликоконъюгатами.
Стурктуры смешанных биополимеров чрезвычайно сложны, а их подробное изучение в сущности лишь только начинается. В отличие от полисахаридов систематически описать и классифицировать типы структур смешанных биополимеров весьма затруднительно прежде всего из-за ограниченного количества надежно и полно расшифрованных структур. Укажем лишь, что связь олиго- или полисахаридной компоненты с пептидной, белковой или липидной осуществляется обычно при помощи гликозидной связи: либо по гидроксильным группам (например, в остатках оксиаминокислот пептидной цепи), либо по амидной группе амидов двухосновных аминокислот. Возможна также фосфодиэфирная связь, подобная той, которая лежит в основе строения нуклеиновых кислот.
Для иллюстрации схематически опишем структуры двух таких биополимеров:гликопротеина и липополисахарида. Биополимеры, определяющие групповую принадлежность ткани, представляют собой высокомолекулярные (молекулярная масса до 1 млн.) гликопротеины, содержащие около 80-85% углеводной компоненты и около 15-20% пептидной. В основе строения их молекул лежит
длинная полипептидная цепь с весьма высоким (по сравнению с большинством белков) содержанием оксиаминокислот – серина и треонина.
К гидроксильным группам части этих аминокислотных остатков присоединены гликозидными связями углеводные цепи, общее число которых достигает нескольких сотен. Эти цепи содержат 15-20 моносахаридных остатков каждая, имеют высокоразветвленную структуру и построены из остатков N-ацетил-D-глюкозамина,N-ацетил-D-галактозамина,D-галактозы,L-фукозы, и в части случаевN-ацетил-D-нейраминовой кислоты. В биологическом отношении максимально функциональны (непосредственно ответственны за групповую специфичность) концевые (внешние) участки моносахаридных остатков (так называемые детерминанты). Именно здесь расположены все остаткиL-фукозы иN-ацетил-D-нейраминовой кислоты (см. схему).
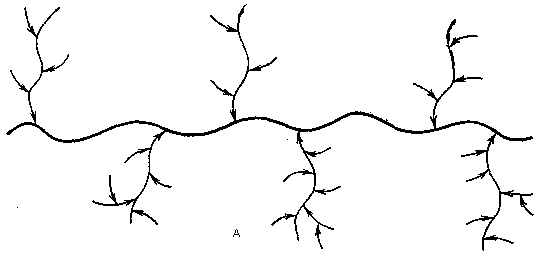
Жирные линии на схеме символизируют полипептидную цепь, остальные линии – полисахаридные цепи: А-общая схема, Б-один из узлов связи полисахаридной и пептидной цепей.
Второй пример – липополисахариды грамотрицательных бактерий, располагающиеся на внешней поверхности бактериальной клетки. На контакт именно с этими биополимерами животный организм-хозяин дает иммунный ответ – начинает вырабатывать антитела. Иными словами, липополисахариды такого типа – это высокоактивные и высокоспецифичные антигены, структура которых строго индивидуальна для каждого вида микроорганизмов. Однако схема построения этих структур имеет весьма общий характер для больших классов микроорганизмов. Вот так приблизительно они построены.
Макромолекула в целом линейна и состоит из трех последовательно связанных крупных блоков, представленных на схеме:
![]()
Липид А – главным образом дисахарид, состоящий из двух остатковD-глюкозамина, к одному из гидроксилов которого присоединен кор, а остальные гидроксилы и обе аминогруппы ацилированы высшими жирными кислотами, что и придает фрагменту высоко гидрофобный, липидный характер. Благодаря этому липидный фрагмент липополисахарида погружен (можно было бы сказать, растворен или, еще точнее, вплавлен) в липидную мембрану клетки, что и обеспечивает прочную связь всей молекулы, полисахаридная и, следовательно, высоко гидрофильная, обращена в водную среду, окружающую бактериальную клетку.
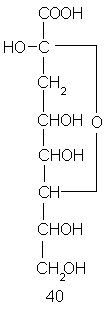
Кор представляет собой линейный или слаборазветвленный (по типу гребнеобразного) полисахарид, содержащий остатки довольно необычных моносахаридов – 2-кето-3-дезоксиоктоновых кислот (общая формула 40). Наконец, О-антигенная цепь – это обычно регулярный полисахарид, построенный из повторяющихся три-гексасахаридных (часто разветвленных) звеньев;причем в их состав нередко входят весьма экзотические моносахариды.
Липидная часть и кор сравнительно мало меняются при переходе от одних микроорганизмов к другим в пределах одного класса, тогда как O-антигенная цепь широко варьирует и строго индивидуальна для каждого вида. Как ясно из сказанного, именно эта часть молекулы составляет самый внешний слой бактериальной клетки, с которым непосредственно входит в контакт организм-хозяин при инфекции.
