
Ионная хроматография (1997)(ru)
.pdf
ЗАО НТК
Синтеко
ИОННАЯ ХРОМАТОГРАФИЯ
Дзержинск 1997
3
В В Е Д Е Н И Е
Определение неорганических и органических ионов является практически важной и достаточно сложной аналитической проблемой. Наиболее общим и универсальным методом решения этой задачи является ионообменная хроматография. Развитие высокоэффективной жидкостной хроматографии высокого давления стимулировало развитие нового направления в ионообменной хроматографии - так называемой ионной хроматографии.
Ионная хроматография - это вариант ионообменной хроматографии, включающий ионообменное разделение ионов и кондуктометрическое определение концентрации хроматографически разделенных ионов. Поскольку высокочувствительное кондуктометрическое определение ионов возможно только при невысокой фоновой электропроводности потока жидкости, поступающей в детектор, были предложены два основных метода ионной хроматографии.
Первый метод, предложенный в 1975 г. Смолом, Стивенсом и Бауманом, основан на компенсации (подавлении) электролита с помощью второй ионообменной колонки, расположенной между детектором и разделяющей колонкой. Этот метод назван ионной хроматографией. В настоящее время этот термин используется в более широком смысле - для обозначения нового направления в целом.
Второй метод, предложенный Гьрде, Фритцем и Шмуклер, основан на использовании для разделения электролита с невысокой электропроводностью. Вторая (подавительная) колонка в этом случае не используется.
Методу ионной хроматографии присущи следующие особенности: 1) использование новых поверхностно-слойных сорбентов с небольшой емкостью (порядка 10-2-10-1 мэкв/г) и небольшим размером частиц (5-50 мкм) для разделения ионов; 2) повышение скорости потока и, следовательно, повышение давления на входе колонки (≈ 2-15 МПа); 3) использование высокочувствительных детекторов с автоматической записью сигнала, пропорционального концентрации разделенных ионов. Например, использование кондуктометрического детектора позволяет определять ионы с концентрацией порядка 10-3 мкг/мл (применение концентрирующей колонки позволяет уменьшить это значение на 2-3 порядка величины).
Широкое распространение ионной хроматографии обусловлено рядом ее достоинств: а) возможность определять очень большое число неорганических и органических ио-
нов, а также одновременно определять катионы и анионы; б) высокая чувствительность определения (до 1 нг/мл без предварительного концен-
трирования); в) высокая селективность и экспрессность (можно определять 10 ионов за 10-15 ми-
нут, а при градиентном элюировании - 22 иона за 25 мин); г) малый объем анализируемой пробы (требуется не более 2 мл образца);
д) широкий диапазон определяемых концентраций (от 1 нг/мл до 1000 мг/л без разбавления);
I.Двухколоночная анионная хроматография
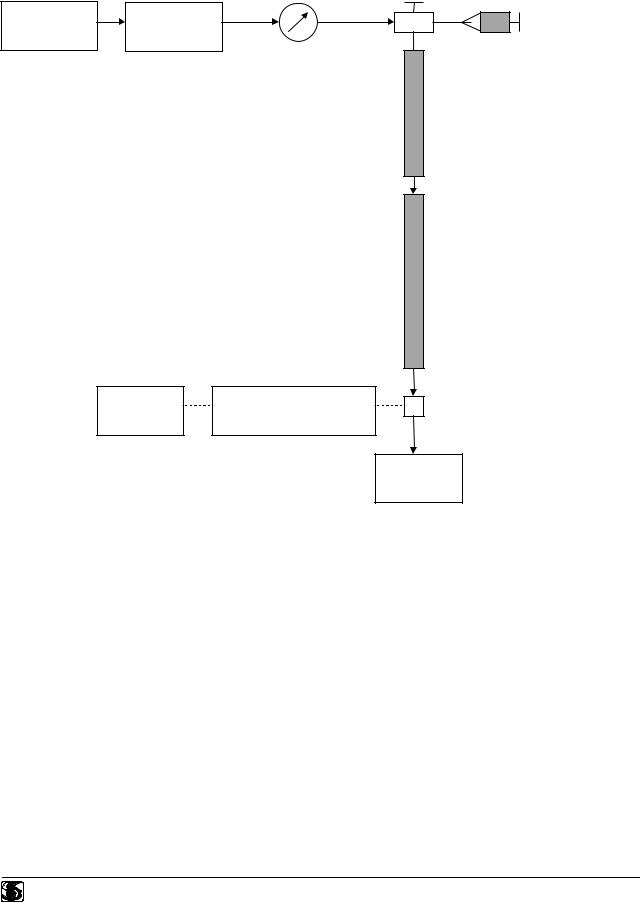
Вионной хроматографии используются принципы высокоэффективной жидкостной хроматографии. Ионный хроматограф состоит из резервуаров для элюента, насосов, крана для ввода пробы, колонок, кондуктометрического детектора и самописца.
Блок-схема прибора представлена на рис. 1.1. Легко видеть, что благодаря применению двух колонок этот ионный хроматограф необычен.
2
Рис 1.1.
Манометр
Емкость |
Насос |
для элюента
Самописец Кондуктометрический детектор
Кран для ввода пробы
Шприц для ввода пробы
Колонка
разделительная
Колонка
подавительная
Ячейка
Слив
Следует отметить, что за исключением кондуктометрической ячейки в ионной хроматографии используют только химически инертные соединительные трубки, колонки и краны. Это позволяет применять сильнокислые и сильноосновные элюенты, которые могли бы вызвать значительную коррозию в обычных хроматографических системах. Допустимое для ионного хроматографа давление не превышает 60 МПа.
1.1. Разделяющая колонка.
Обычные ионообменные смолы готовят путем хлорметилирования сферических частиц сополимера стирола с дивинилбензолом и последующего аминирования. Для большинства смол реакция протекает полностью с образованием обменника с высокой емкостью. В колонках, заполненных обычными анионообменниками с высокой емкостью, скорость разделения может лимитироваться диффузией ионов в объеме частиц смолы и обратно, а также обменными реакциями в смоле. В результате медленного массопереноса и размывания зоны для некоторых колонок наблюдается общая потеря эффективности. Повышения как скорости разделения, так и эффективности колонки достигают путем увеличения скорости переноса.
Синтеко |
606023, г. Дзержинск, Нижегородской обл., ул.Пирогова 37Б |
Тел./факс: (8313) 211-211, 210 –577 E-mail: sinteko@mail.ru |

3
В случае разделяющих колонок фирмы Dionex этого удалось добиться благодаря применению поверхностно-пористых анионообменных смол. Такие смолы готовят, нанося на сферическую частицу стирол-дивинилбензольного сополимера тонкий слой анионообменного латекса.. Затем осуществляют поверхностное сульфирование мелких частиц, так что внешняя оболочка частиц смолы представляет собой тонкий слой сульфогрупп. Потом однородные по размеру частицы смолы (0.1-0.5 мкм) переводят в анионообменную форму, обрабатывая их четвертичным анионообменным материалом. Под действием электростатических сил мелкие частицы латекса притягиваются к поверхности смолы и образуют вторую тонкую оболочку вокруг ядра частиц. Таким образом, получающаяся смола состоит из трех различных слоев: внутреннего ядра, сульфированного слоя и слоя анионообменных частиц. На рис 1.2. схематически изображены частицы различных смол.
Рис 1.2. |
|
|
|
|
|
|
|
|
||
- |
- |
|
|
+ |
- |
+ |
+ |
- |
|
|
- |
- - |
- |
+ |
+ |
- + |
|
+ |
- |
||
- - - - - |
+ |
+ |
- + |
|
|
+ - |
||||
- - - - - |
+ |
+ |
- + |
|
|
+ - |
||||
- |
- - |
- |
+ |
+ |
- |
+ |
|
+ |
- |
|
Обычный |
Катионообменник |
- |
- |
- |
- |
|
||||
Анионообменник |
||||||||||
анионообменник |
с сульфированной |
|||||||||
с |
|
|
|
|
||||||
|
|
|
поверхностью |
|
|
|
|
|||
|
|
|
агломерирован- |
|
||||||
|
|
|
|
|
|
|||||
Преимущество поверхностно-пористых смол перед обычными ионообменниками состоит в резком снижении диффузного пути, что приводит к ускорению обмена или массопереноса ионов элюента и образца и, следовательно, к значительному увеличению эффективности колонки. В отличие от других поверхностно-пористых материалов с сердцевиной из силикагеля или стекла, смолы применяемые в системах фирмы Dionex очень стабильны даже в среде сильноосновных элюентов. Несмотря на то что анионообменный материал, наносимый на смолу, обладает высокой емкостью, общая емкость ионного обмена смолы низка и обычно составляет 0,02-0,05 мэкв/г. Поверхностно-пористая структура и малая емкость смолы позволяют разделять разнообразные анионы в среде сравнительно разбавленных элюентов. Кроме того, благодаря малому диффузному пути эффективность колонки с такой смолой меньше подвержена влиянию скорости потока. Это означает, что можно выбирать относительно большие скорости и быстрее проводить анализ.
1.2.Элюенты
Элюенты, предназначенные для двухколоночной системы, должны отвечать двум основным требованиям. Во-первых, они должны вытеснять анионы из разделительной колонки. Во-вторых, они должны вступать в реакции обмена в компенсационной колонке с образованием воды или других слабодиссоциирующих частиц, обладающих низкой проводимостью.
В идеале элюирующий анион должен иметь несколько большее сродство к разделяющей смоле, чем наиболее прочно удерживаемый анализируемый анион. Тем не менее такой элюент может не обеспечить анализ сложной смеси анионов, поэтому выбор элюента существенно зависит от числа и типа анализируемых частиц. Список элюентов, пригодных для разделения анионов с широко меняющимся сродством, приведен в табл. 1.1.
Синтеко |
606023, г. Дзержинск, Нижегородской обл., ул.Пирогова 37Б |
Тел./факс: (8313) 211-211, 210 –577 E-mail: sinteko@mail.ru |

4
|
Элюенты для анализа анионов |
Таблица 1.1. |
||
|
|
|
||
Элюент |
Элюирующий ион |
Сила |
|
Продукт подави- |
|
|
|
|
тельной реакции |
Na2B4O7 |
B4O72- |
Очень слабый |
|
Н3ВО3 |
NaOH |
OH- |
Слабый |
|
Н2О |
NaHCO3 |
HCO3- |
Слабый |
|
Н2СО3 |
Na2CO3 |
CO32- |
Промежуточный |
|
Н2СО3 |
Элюенты, содержащие тетраборат натрия, обладают очень низкой способностью к вытеснению и применяются редко. Однако они полезны в случае разделения быстроэлюируимых частиц, таких, как фторид, формиат и ацетат. Борат натрия в результате конверсии в компенсационной колонке дает слабодиссоциирующую борную кислоту.
Элюент, содержащий гидрооксид натрия, с точки зрения компенасции фонового сигнала является идеальным, поскольку он конвертируется в воду. Недостатком же этого элюента является его низкое сродство к разделяющей смоле, что обеспечивает вытеснение только слабоудерживаемых анионов. Увеличение концентрации гидрооксида натрия в растворе увеличивает его способность к вытеснению, но вызывает быструю отработку подавительной колонки. Гидрооксид натрия иногда добавляют к некоторым элюентам, таким, как растворы бикарбоната и карбоната натрия.
Благодаря своему заряду карбонат имеет очень хорошие элюирующие свойства, и его можно использовать в сравнительно низких концентрациях. Чаще всего применяются элюенты, которые представляют собой буферные растворы, приготовленные смешением карбоната и бикарбоната. Селективность такого элюента можно легко изменить, меняя соотношение компонентов, т.е. меняя значение рН элюента. Кроме того, чтобы обеспечить быстрое или медленное элюирование, не влияя на порядок выхода анализируемых ионов, можно просто изменить концентрацию элюента.
1.3. Подавляющие системы
Подавляющая система является составной частью системы детектирования и предназначена для обеспечения максимального различия кондуктометрических сигналов элюента и определяемого иона. Широко использую две системы подавления: колоночную и мембранную.
1.3.1. Колоночное подавление.
Колоночная система подавления была предложена в первой работе по ионной хроматографии. Реакция подавления, т.е. перевод элюента и определяемого иона в соединения, сильно различающиеся по своей электропроводности, осуществляется в колонке, заполненной ионообменником высокой емкости. Эта колонка устанавливается после разделяющей перед кондуктометрическим детектором. При определении анионов подавляющую колонку заполняют катионообменником высокой емкости в Н-форме. В большинстве случаев в подавляющей колонке элюент переводят в малодиссоциированную кислоту, а определяемые анионы в сильные кислоты. При определении анионов слабых кислот наблюдается обратная картина: элюент переводят в сильную кислоту, а анионы - в слабые кислоты.
При определении катионов подавляющую колонку заполняют анионообменником высокой емкости в ОН-форме. При этом элюент переводят в воду или малодиссоциирующее основание, а определяемые катионы - в сильно проводящие основания.
Синтеко |
606023, г. Дзержинск, Нижегородской обл., ул.Пирогова 37Б |
Тел./факс: (8313) 211-211, 210 –577 E-mail: sinteko@mail.ru |

5
Вкачестве сорбентов для подавляющей колонки могут быть использованы катионообменники Dowex 50-Х8, КРС, КУ-2. Размер зерен 20-40 мкм, обменная емкость 3.5-5.0 мэкв/г. Мелкое зернение сорбента в подавительной колонке необходимо для уменьшения “мертвого” объема хроматографической системы и повышения эффективности разделения.
Впроцессе работы подавляющая колонка постепенно отрабатывается, т.е. сорбент переходит из протонной или гидрооксильной форм в солевую. Отработанная колонка перестает подавлять фон элюента и ее необходимо регенерировать. Для регенерации подавительную колонку отсоединяют от хроматографической системы, при этом приходится прерывать анализ. Регенерацию катионообменника проводят пропусканием через колонку 0.5н
HNO3 с последующим промыванием колонки водой. Время работы подавительных колонок до регенерации 6-10часов, в зависимости от концентрации элюента и емкости колонок.
Использование подавительных колонок является наиболее дешевым методом, поэтому он находит широкое применение в ионной хроматографии. Однако данному методу присущи следующие недостатки:
- изначально большой “мертвый” объем, что приводит к снижению эффективности системы, увеличению времени анализа, а следовательно производительности прибора,
- по мере отработки подавительной колонки в течение рабочего дня изменяется степень подавления фона элюента, что отрицательно сказывается на стабильности калибровочного графика,
- молекулы малодиссоциированных слабых кислот могут проникать в глубь зерен подавляющего катионообменника и удерживаться на подавляющей колонке; этот эффект наблюдается для анионов многих органических кислот, нитрита, фосфата, цианида, карбоната, бората и фторида.
Знание недостатков этой системы подавления необходимо для правильного ее использования
1.3.2. Мембранное подавление
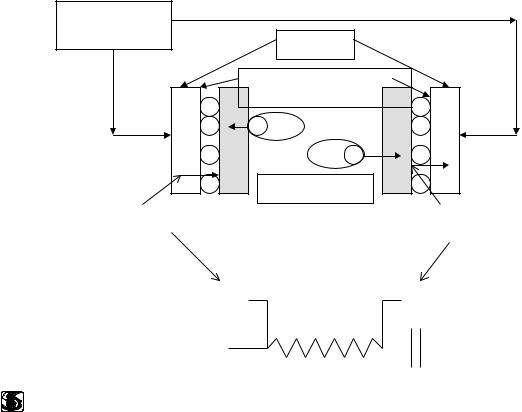
Недостатки колоночной системы подавления можно устранить, используя мембранную систему подавления. Эту систему начали использовать с 1981г.
Принцип действия мембранной системы подавления показан на рис. 1.3. Элюент и определяемые анионы в виде солей направляют после разделяющей колонки внутрь тонкой трубки, стенки которой изготовлены из катионообменного материала.
Рис 1.3. |
NaCl, NaHCO3 |
Na+ H+
H+ H+
HCl, H2CO3
Синтеко |
606023, г. Дзержинск, Нижегородской обл., ул.Пирогова 37Б |
Тел./факс: (8313) 211-211, 210 –577 E-mail: sinteko@mail.ru |

6
Снаружи мембранной трубки противотоком непрерывно подается регенерирующий раствор серной кислоты. Через стенки трубки происходит обмен ионов Na+ на Н+, и на выходе элюент превращается в слабую кислоту, а определяемые анионы - в сильные кислоты. При этом анионы регенеранта, элюента и анализируемого образца в силу доннановской эксклюзии не могут проникать через стенку такой трубки.
Такая система подавления действительно позволяет устранить недостатки, связанные с необходимостью регенерации и эксклюзионным удерживанием на подавляющей колонке. Однако из-за большого “мертвого” объема размывание зон в такой системе даже больше, чем в подавляющей колонке. Кроме того, полный обмен Na+ на Н+ достигается только при скорости подачи элюента не более 1 мл/мин.
Для повышения скорости ионного обмена и уменьшения “мертвого” объема предложено использовать заполненные мембранные трубки, свернутые в спираль. Существует два способа заполнения трубки мембранных подавляющих систем. В первой из них катионную мембранную трубку Nafion 811-Х (внутр. диаметр 0.8 мм) заполняют инертными стиролдивинильными сферическими частицами диаметром 0,5 мм. Другой способ заполнения заключается в том, что для заполнения трубки Nafion 811-Х (внутр. диаметр 0.7 мм) предлагается помещать в нее нейлоновую нить диаметром 0.66 мм. Последняя система создает давление до 30 атм.
В 1985г. фирма Dionex создала новую подавляющую систему, названную микромембранным подавителем (MMS). В микромембранной системе используют тонкие ионообменные пластины, закрывающие с двух сторон пластину, на которую по тонкому каналу подается элюент. Снаружи ионообменные пластины омываются раствором регенеранта. Преимуществом микромембранной системы подавления является малый объем, высокая эффективность ионного обмена и возможность использования для градиентного элюирования.
Таблица 1.2. Сравнительная характеристика систем подавления
Характеристика |
Колоночная |
Мембранная |
Микромембранная |
Возможность непре- |
нет |
да |
да |
рывной регенерации |
|
|
|
Чувствительность |
высокая |
высокая |
высокая |
Емкость |
высокая |
низкая |
высокая |
Свободный объем |
2000 |
200 |
45 |
Возможность гради- |
нет |
нет |
да |
ентного элюирования |
|
|
|
1.4. Детекторы электропроводности.
Детекторы электропроводности пригодны для обнаружения самых разнообразных ионов. Такие детекторы не реагируют на вещества, находящиеся в молекулярном состоянии (воду, этанол или недиссоциированные молекулы слабых кислот). Это важное обстоятельство нужно учитывать при создании кондуктометрической ионохроматографической системы.
1.4.1. Теоретические основы.
Электропроводность есть способность раствора электролита проводить электрический ток между двумя электродами, к которым приложено электрическое напряжение. Этот процесс подчиняется закону Ома (U=IR), согласно которому ток пропорционален приложенному напряжению. Электропроводность раствора есть величина, обратная его сопротивлению, и измеряется в обратных омах (Ом-1):
G = 1 R |
( 1.1.) |
Синтеко |
606023, г. Дзержинск, Нижегородской обл., ул.Пирогова 37Б |
Тел./факс: (8313) 211-211, 210 –577 E-mail: sinteko@mail.ru |

7 |
|
Удельная электропроводность k определяется как |
|
k = G l A |
( 1.2. ) |
где А - площадь электродов (см2), |
|
l - расстояние между электродами (см).
Таким образом, k измеряется в единицах Ом-1см-1. Постоянная ячейки К выражается соотношением
К = l A |
( 1.3. ) |
|
т.е. измеряется в единицах см-1. Из (1.2.) и (1.3.) следует |
||
|
k = G K |
( 1.4. ) |
Эквивалентная электропроводность λ |
связывается с концентрацией вещества в рас- |
творе и выражается как |
|
λ = 1000k C |
( 1.5. ) |
|
где С- концентрация в эквивалентах на 1000 см3. Величина λ измеряется в единицах Ом-1см2экв-1.
Комбинация уравнений 1.4. и 1.5. дает выражение, которое связывает эквивалентную электропроводность с измеряемой концентрацией:
G = λ C 1000K |
( 1.6. ) |
|
|
Детектор электропроводности состоит из ячейки, в которую подается анализируемый |
|
раствор, индикатора и электрической схемы для измерения проводимости и измерения чув- |
|
ствительности. Индикатор градуируется в единицах Ом-1. |
|
Удельную электропроводность можно вычислить из электропроводности, если из- |
|
вестны параметры ячейки (уравнение 1.2.). Однако на практике измеряют проводимость |
|
разбавленного раствора с известной удельной электропроводностью (например, 0.00100 н. |
|
KCl) и вычисляют постоянную ячейки по уравнению 1.4. Если постоянная ячейки известна, |
|
то измерив G, можно рассчитать удельную электропроводность других растворов. |
|
По табличным значениям эквивалентной электропроводности и уравнению (1.6.) для |
|
кондуктометрического детектора с известной постоянной ячейки можно вычислить элек- |
|
тропроводность различных растворов с заданной концентрацией. Предельные значения эк- |
|
вивалентной электропроводности некоторых часто встречающихся на практике ионов при- |
|
ведены в табл. 1.3. Эквивалентная электропроводность ионов обычно снижается с увеличе- |
|
нием их концентрации вследствие межионных взаимодействий. Для разбавленных раство- |
|
ров (10-5 -10-3 н.) эквивалентная электропроводность мало отличается от значений, приве- |
|
денных в табл. 1.3. |
|
|
Таблица 1.3. |
Предельные значения эквивалентной ионной электропроводности в водном растворе |
|
при 25оС. |
|
|
Анионы |
λ , Ом-1.см2.экв-1. |
Катионы |
λ , Ом-1.см2.экв-1. |
1 |
2 |
3 |
4 |
|
|
OH- |
198 |
H+ |
350 |
|
F- |
54 |
Li+ |
39 |
|
Cl- |
76 |
Na+ |
50 |
|
Br- |
78 |
K+ |
74 |
|
I- |
77 |
NH4+ |
73 |
|
NO3- |
71 |
Mg2+ |
53 |
|
HCO3- |
45 |
Ca2+ |
60 |
|
Формиат |
55 |
Sr2+ |
59 |
|
|
|
|
|
Синтеко |
606023, г. Дзержинск, Нижегородской обл., ул.Пирогова 37Б |
Тел./факс: (8313) 211-211, 210 –577 E-mail: sinteko@mail.ru |
|
|
8 |
|
|
|
|
|
|
|
Ацетат |
41 |
|
Ba2+ |
64 |
Пропинат |
36 |
|
Zn2+ |
53 |
1 |
2 |
|
3 |
4 |
Бензоат |
32 |
|
Hg2+ |
53 |
SCN- |
66 |
|
Cu2+ |
55 |
SO42- |
80 |
|
Pb2+ |
71 |
CO32- |
72 |
|
Co2+ |
53 |
C2O42- |
74 |
|
Fe3+ |
68 |
CrO42- |
85 |
|
La3+ |
70 |
PO43- |
69 |
|
Ce3+ |
70 |
Fe(CN)63- |
101 |
|
CH3NH3+ |
58 |
Fe(CN)64- |
111 |
|
N(C2H5)4+ |
33 |
1.4.2.Принцип работы ячейки.
Если к двум электродам, находящимся в растворе электролита, приложено электрическое напряжение, то анионы в растворе будут двигаться к аноду, а катионы - к катоду. Число ионов и скорость их движения в объеме электролита определяют электропроводность раствора. Подвижность ионов (их скорость, деленная на напряженность электрического поля) зависит от заряда и размера иона, температуры, типа среды и концентрации ионов. Относительные подвижности ионов определяются предельными значениями эквивалентной ионной электропроводности, приведенные в табл. 1.3. Скорость движения ионов зависит от величины приложенного напряжения. Напряжение может быть постоянным, либо переменным синусоидальным или прямоугольной импульсной формы.
Ток в ячейке измерить нетрудно, однако сопротивление ячейки определяется напряжением, до которого ионы реагируют на его измерение. Поведение может вызвать изменение эффективного приложенного напряжения. На рис.1.4. показаны некоторые наиболее важные явления, которые могут возникнуть в ячейке. Помимо электролитического сопротивления может появляться емкостное сопротивление двойного слоя, или фарадеев импеданс.
Рис 1.4.
Мост и источник тока
|
|
|
Электрод |
|
|
|
|
Емкостное сопротивление |
|
||
- С+ |
|
двойного слоя |
А- + |
||
- С+ |
С+ |
- |
|
А- + |
|
- |
С+ |
|
+ |
А- |
А- + |
- |
С+ |
Объем электролита |
А- + |
||
Электролиз |
Электролиз |
(фарадеев импеданс) |
(фарадеев импеданс) |
|
|
|
Zr |
|
|
|
Zr |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Емкостное сопротивление |
Сопротивление |
Емкостное сопротивление |
||
Синтеко |
двойного слоя |
электролита606023, г. Дзержинскдвойного, Нижегслояродской обл., ул.Пирогова 37Б |
|
|
|
Тел./факс: (8313) 211-211, 210 –577 E-mail: sinteko@mail.ru |
|||

9
Если потенциал на электроде ниже потенциала разложения, то в слой раствора, непосредственно примыкающий к электроду, будут притягиваться ионы противоположного заряда и образуется заряженный слой. Этот заряженный, или двойной, слой состоит из двух частей: 1) тонкого внутреннего слоя, в котором концентрация ионов (или потенциал) линейно падает с расстоянием от поверхности электрода; 2) размытого слоя, в котором концентрация ионов падает экспоненциально.
Возникновение двойного слоя снижает напряжение, приложенное к объему электролита. Если потенциал на электроде выше потенциала разложения, то будет происходить электролиз. В результате процессов окисления на аноде и восстановления на катоде через границу раздела «электрод-раствор» потечет ток. Возникающий при этом фарадеев импеданс может быть вызван медленными процессами переноса электронов, либо увеличением или уменьшением количества ионов на поверхности электродов. Фарадеев импеданс также меняет эффективное напряжение, приложенное к электроду.
1.4.3. Измерение электропроводности.
Влияние описанных электродных процессов можно устранить путем подачи на электроды переменного напряжения. При изменении знака приложенного напряжения меняются направление перемещения ионов, характер электролиза и характер образования емкостного сопротивления. Время релаксации различно для каждого типа процесса. По мере увеличения частоты влияние электролиза снижается или совсем устраняется, и ток в растворе определяется емкостным сопротивлением. Верхний предел частот соответствует примерно 1 МГц. При этой частоте ионы прекращают движение, хотя переориентация диполей по-прежнему будет происходить. Влиянием емкостного сопротивления можно управлять, подбирая сопротивление в электрической схеме, либо измерять мгновенный ток. Мгновенный ток - это ток, возникающий в момент подачи напряжения, когда двойной слой еще не образовался.
На электроды ячеек некоторых детекторов подают напряжение синусоидальной формы частотой 10-10000 Гц. Детектор электропроводности Wescan 213 работает на частоте 10 кГц при напряжении 20 В при отсутствии электролиза. В этом устройстве используется фазочувствительное детектирование, т.е. измеряется только та составляющая тока, которая находится в фазе с приложенным напряжением.
В других детекторах используется метод биполярной импульсной проводимости. Этот метод состоит в последовательной подаче на ячейку двух импульсов напряжения малой длительности (около 100 мкс). Импульсы имеют противоположную полярность, но одинаковы по амплитуде и длительности. Сразу по окончании второго импульса измеряют ток в ячейке и определяют ее сопротивление, пользуясь законом Ома. Такой импульсный способ питания предотвращает электролиз.
Поскольку при биполярном импульсном питании в ячейке измеряют величину мгновенного тока, емкостное сопротивление не влияет на измерения, и потому этот метод позволяет точно определить сопротивление ячейки.
1.4.4. Особенности работы.
В ячейках последних детекторов электропроводности электроды, как правило, делают из нержавеющей стали марки 316. Мертвый объем ячеек не превышает 2 мкл. Чтобы “дезактивировать” новую ячейку и стабилизировать сигнал, ее промывают 50%-ным раствором азотной кислоты в течение нескольких минут.
Подвижность ионов в растворе меняется с температурой. Электропроводность большинства растворов ионов возрастает примерно на 2% при увеличении температуры на 1оС.
Синтеко |
606023, г. Дзержинск, Нижегородской обл., ул.Пирогова 37Б |
Тел./факс: (8313) 211-211, 210 –577 E-mail: sinteko@mail.ru |
