
Кокорев Лабораторный практикум по термодинамике 2008
.pdf
где удельная энтропия s и газовая постоянная R выражаются в одинаковых единицах, например, кДж/(кг К) или кДж/(моль К).
Изотермическая сжимаемость
|
|
= − 1 |
|
∂v |
|
(10.3) |
|
β |
T |
|
|
||||
|
|||||||
|
v |
|
|
|
|
||
|
|
|
∂p T |
|
|||
в безразмерной форме с логарифмическими переменными v и р
|
|
∂lnv |
|
+ |
pβT |
|
|
||
= − |
|
|
≡ βT |
|
|
||||
|
|
∂lnp T |
|
|
выражается конечно-разностной аппроксимацией
βT+ = ln(v1v2 / v3v4 ) .
Коэффициент сжимаемости
Z = ( pV ) / RT
выражается через среднелогарифмические координаты
Z = ( pv)/RT .
Для вычисления оставшихся коэффициентов βS , cv требуются два термодинамических уравнения
|
∂p |
|
∂v 2 |
|
cp |
|
β |
T , |
|
cp −cv = −T |
|
|
|
, |
|
= |
|
||
|
cv |
|
|||||||
|
∂v T |
∂T p |
|
|
βS |
||||
которые в безразмерной форме имеют вид
71
(10.3а)
(10.3б)
(10.4)
(10.4а)
иа нам по-
(10.5а, б)

|
(α+p )2 |
|
|
|
|
|
c+ |
|
|
c +p −cV+ = Z |
|
, |
|
|
β+S = βT+ |
v |
, |
(10.6а, б) |
|
βT+ |
|
|
|
||||||
|
|
|
|
|
|
c+p |
|
||
откуда последовательно определяются коэффициенты с+ |
и β+ . |
||||||||
|
|
|
|
|
|
|
|
V |
S |
Скорость звука |
|
|
|
|
|
|
|
|
|
|
a |
2 |
= −v |
2 |
|
∂p |
|
|
(10.7) |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
∂v S |
|
|
|
в безразмерной форме выражается через адиабатическую сжимаемость
a+ ≡ a(pv)− |
1 |
= (β+S )− |
1 |
. |
(10.8) |
|
2 |
||||
2 |
Результаты вычислений сводятся в табл. 10.1.
_
Таблица 10.1. Термодинамические коэффициенты (вещество), T =
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n+ = |
|
|
|
|
|
|
α+ |
c+ |
β+ |
_ |
c+ |
β+ |
a+ |
|
|
|
= n / n |
|
p |
|
|
|
n |
|||||||||||
|
|
V |
||||||||||||||
|
|
|
|
|
|
P |
P |
T |
Z |
V |
S |
|
кр |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ВЫЧИСЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ КОЭФИЦИЕНТОВ ПО УРАВНЕНИЮ ВАН ДЕР ВААЛЬСА
Используя известное уравнение Ван дер Ваальса
p = |
RT |
− |
a |
(10.9) |
|
v −b |
v2 |
||||
|
|
|
72
или в приведенных координатах |
p+ = p / pкр , v+ |
= v / vкр (v – удель- |
|||||||||||||||||
ный |
объем), T+ = T / Tкр , |
|
n+ =1/ v+ , |
|
( vкр |
= 3b , |
RTкр = 8a /( 27b ) , |
||||||||||||
pкр |
= a /( 27b2 ) ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p+ = 8 |
n+T+ |
−3n+2 |
, |
|
|
|
(10.10) |
||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
3 (1− n+ / 3 ) |
|
|
|
|
|
|
|
|||
можно найти α+ и |
|
β+ . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
P |
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Проведя преобразования, получим: |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
1 |
= A − |
B |
, |
( A = |
1 |
|
, |
B = |
9 |
|
n+ |
), (10.11) |
||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
α+P |
|
|
T+ |
|
1 − n+ / 3 |
|
4 A |
|
||||||||
|
|
βT+ = |
Z |
1 |
|
, |
|
|
|
|
|
|
(10.12) |
||||||
|
|
A2 |
|
(1 − D / T+ ) |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
где Z = A −C / T+ ; |
D = B / A; C = (9 / 8)n+ . |
|
|
|
|
|
|
|
|||||||||||
Изохорическая теплоемкость по Ван дер Ваальсу, при невысоких температурах, когда можно пренебречь возбуждением колебательных степеней свободы, равна соответствующей величине для идеального газа
cv = (δпост + δвращ )/2R ,
или в безразмерном виде
c+ |
= (δ |
пост |
+ δ |
вращ |
) / 2 . |
(10.13) |
V |
|
|
|
|
73
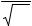
Для одноатомного газа (δпост = 3, δвращ =0) имеем: cV+ = 3/2, для двухатомного (δвращ = 2) cV+ = 5/2, а для трехатомного (δвращ = 3) cV+ = 3.
Изобарическая теплоемкость определяется с помощью известного термодинамического уравнения
|
|
∂p |
|
∂V |
|
|
cP = cV |
+T |
|
|
|
|
, |
|
||||||
|
|
∂T V |
∂T P |
|||
откуда
c+ |
= c+ + α+ |
A . |
(10.14) |
|
P |
V |
P |
|
|
Адиабатическая сжимаемость и скорость звука определяются как
β+ |
= β+ |
c+ |
(10.15), a+ = |
1 |
|
V |
|
(10.16). |
|||
cP+ |
|
||||
S |
T |
|
β+ |
|
|
|
|
|
|
S |
|
Сравнение термодинамических коэффициентов, рассчитанных по таблицам p – (S, V) – T и уравнению Ван дер Ваальса для аргона, приведено на рис. 10.2. Можно отметить не только качественное, но во многих случаях близкое количественное соответствие этих результатов.
ЗАДАНИЕ ЛАБОРАТОРНОЙ РАБОТЫ
1.Проведите расчет термодинамических коэффициентов для
одного из веществ (Приложение 6) по таблице p – (s, v) – Т состояний и уравнению Ван дер Ваальса. Результаты расчетов представьте в виде таблицы и графически (см. рис. 10.2).
74
2. На графиках изобразите термодинамические коэффициенты для идеального газа.
|
α+p |
|
2.0 |
|
|
1.0 |
|
|
0.0 |
|
n+ |
|
|
|
0.0 |
1.0 |
2.0 |
1.0 |
β+ |
|
T |
|
|
0.5 |
β+S |
|
0.0 |
|
n+ |
|
|
|
0.0 |
1.0 |
2.0 |
6.0 |
|
|
5.0 |
c+p |
|
|
|
|
4.0 |
|
|
3.0 |
|
|
2.0 |
|
c+v |
1.0 |
|
n+ |
|
|
|
0.0 |
1.0 |
2.0 |
4.0 |
|
|
3.0 |
|
|
2.0 |
a+ |
|
1.0 |
|
Z |
|
|
|
0.0 |
|
n+ |
|
|
|
0.0 |
1.0 |
2.0 |
Рис. 10.2. Термодинамические коэффициенты аргона при T = 210 K .
– расчет по таблице p – (s, v) – T состояний; - - - - – по уравнению Ван дер Ваальса.
Отчет о работе
В отсчете необходимо представить:
1.результаты расчетов в табличной и графической форме;
2.заключение по результатам работы.
75
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Поясните, в чем заключается смысл 4-точечной конечноразностной схемы расчета?
2.Какие преимущества дает использование логарифмичесих переменных для расчета производных по таблицам термодинамических величин?
3.Используя предположение «cv не зависит от v (но возможно
зависит от Т)», покажите, что из уравнения Максвелла (∂p/∂T)v = - (∂s/∂v)T следует уравнение типа Ван дер Ваальса p = A(v)T – B(v) с произвольными функциями объема A(v) и B(v).
4. Какие факторы могут вызывать возрастание cv с увеличением плотности вещества?
Список литературы
1. Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. М.: Наука, 1972.
76
РАБОТА 11
УРАВНЕНИЕ СОСТОЯНИЯ
Цель работы: исследование составляющих внутреннего давления (молекулярного и кинетического) для реальных веществ, используя дифференциальные уравнения термодинамики и таблицы термодинамических свойств.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
В термодинамике существует понятие термического и калорического уравнений состояния в неявной форме, например, p(v, T) и s(v, T). Аналитический вид этих функций точно определен лишь для идеального газа и, приближенно, для газа Ван дер Вальса.
Из уравнений 1-го и 2-го начал термодинамики
dq = du + pdv , |
(11.1) |
T ds = dq |
(11.2) |
можно получить дифференциальное уравнение изотермы
|
∂u |
|
∂s |
|
|
p + |
|
=T |
|
. |
(11.3) |
|
|||||
|
∂v T |
|
∂v T |
|
|
Все три члена в уравнении (11.3) имеют размерность давления и, соответственно, физический смысл внешнего p, внутренних молекулярного pм и кинетического pк давлений (см. Приложение 7)
p + pм = pк .
В расчетах вместо размерных составляющих давления удобнее воспользоваться безразмерными коэффициентами сжимаемости
Z + Zм = Zк , |
(11.4) |
77

где Z = RTpv , Z м = pRTмv , Zк = pRTкv .
ПЕРВЫЙ СПОСОБ РАСЧЕТА
Уравнение Максвелла
|
∂s |
|
∂p |
||
|
|
|
= |
|
|
|
|
||||
|
∂v T |
|
∂T v |
||
и дифференциальная форма уравнения состояния
|
∂p |
|
∂p |
|
|
dp = |
|
dv + |
|
|
dT |
|
|||||
|
∂v T |
|
∂T v |
||
(11.5)
(11.6)
позволяют выполнить следующие преобразования для кинетического давления
|
∂s |
|
∂p |
|
T (∂v / ∂T )p |
|
Tαp |
, |
(11.7) |
||
pк =T |
|
|
=T |
|
|
= |
|
= |
|
||
|
|
−(∂v / ∂p)T |
βT |
||||||||
|
∂v T |
|
∂T V |
|
|
|
|
||||
где αр – изобарический коэффициент термического расширения, βТ – изотермический коэффициент сжатия.
Далее вычисления производных осуществляется в системе логарифмических переменных lnp, lnv, lnT :
|
T |
∂v |
|
∂lnv |
+ |
||
Tαp = |
|
|
|
= |
|
|
≡ αp , |
|
|
||||||
|
v |
∂T p |
|
∂lnT p |
|
||
|
|
|
p |
|
∂v |
|
|
∂lnv |
|
≡ β+ . |
|
pβ |
T |
= − |
|
|
= − |
|
|||||
|
|
|
|||||||||
|
|
v |
|
|
|
|
|
|
T |
||
|
|
|
|
∂p T |
|
∂lnp T |
|
||||
(11.8)
(11.9)
78
Здесь индекс «+» означает величину, приведенную к безразмерному виду. С целью численного расчета, эти уравнения представим в конечно-разностной форме (см. рис. 11.1 и Приложение 5):
α+ = ∆lnv p ∆lnT
= |
(lnv2 −lnv1 )+ (lnv4 |
−lnv3 ) |
= |
ln(v2v4 / v1v3 ) |
, |
||||
2(lnT |
−lnT ) |
|
2ln(T |
/ T ) |
|
||||
|
2 |
1 |
|
|
|
2 |
1 |
|
|
β+ = ln(v1(v2 / v3v4)).
Т 2ln p2 / p1
(11.10а)
(11.10б)
|
T1 |
T2 |
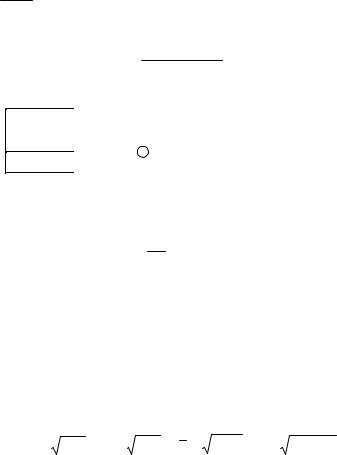
Рис. 1. Фрагмент таблицы |
p1 |
|
|
исходных данных |
v1 |
v2 |
||
p2 |
|
|
|
v3 |
v4 |
|
Кинетический коэффициент сжимаемости равен
α+
ZK = Z +p . (11.10в)
βТ
Затем согласно уравнению (11.4) определим молекулярный коэффициент сжимаемости
Zм =Zк – Z. |
(11.10г) |
Все расчетные величины в уравнениях 11.10, а, б, в отнесены к центру ячейки на рис. 11.1
− |
|
− |
|
p = |
p p |
|
− |
|
|
|
. |
ln T = ln T T |
, T = T T , |
2 |
, v = 4 v v v v |
4 |
|||||||
1 |
2 |
1 |
2 |
|
1 |
1 |
2 |
3 |
|
||
79

ПРЕДСТАВЛЕНИЕ РЕЗУЛЬТАТОВ
Результаты расчетов α+p , βТ+ , Z , Zк и Zм |
необходимо свести |
в табл. 11.1 наряду с молярной плотностью n |
или в безразмерном |
виде n+ = n / nкр , а также представить на графике (рис. 11.2).
Таблица 11.1. Расчет внутренних составляющих давления по изотерме для (вещество), T =
− |
− |
Z |
+ |
βТ+ |
Zк |
Zм |
n+ |
a+ |
p |
v |
αp |
||||||
|
|
|
|
|
|
|
|
|
α+p Z к
|
|
|
м |
|
|
β+ |
n+ |
|
|
T |
|
0 |
1 |
2 |
3 |
Рис. 11.2. Результаты расчетов для н-Н2 по изотерме T+ =T / Tкр =1,348
80
