
Министерство науки, высшей школы и технической политики Российской Федерации
Ивановский инженерно-строительный институт Кафедра общей химии
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ И РАВНОВЕСИЕ ХИМИЧЕСКИХ ПРОЦЕССОВ. ОСНОВЫ ЭЛЕКТРОХИМИИ
Варианты контрольных заданий для студентов-заочников строительных специальностей
Иваново 1992
Составитель А.А.Калинин
УДК 541.132
Кинетика химических реакций и равновесие химических процессов. Основы электрохимии: Варианты контрольных заданий для студентов-заочников строительных специальностей / Иванов, инж.-строит. ин-т; Сост. А.А.Калинин. Иваново, 1992
B настоящей, второй части методической разработки рассмотрены теоретические положения о химической кинетике, равновесии химических процессов, в том числе на границе металл-раствор. Для закрепления теоретического материала в ней даны темы контрольных заданий.
Табл.1.
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
И РАВНОВЕСИЕ ХИМИЧЕСКИХ ПРОЦЕССОВ
Кинетика
- учение о скорости различных процессов,
в том числе химических реакций. Критерием
принципиальной осуществимости реакций
является неравенство
![]() <
O. Ho это неравенство не является еще
полной гарантией фактического течения
процесса в данных условиях, не является
достаточным для оценки кинетических
возможностей реакции. Так,
<
O. Ho это неравенство не является еще
полной гарантией фактического течения
процесса в данных условиях, не является
достаточным для оценки кинетических
возможностей реакции. Так,
![]() а
а
![]()
![]() и,
следовательно, при T = 298 K и P = 1,013·1O5
Пa (I атм) возможны реакции, идущие по
уравнениям
и,
следовательно, при T = 298 K и P = 1,013·1O5
Пa (I атм) возможны реакции, идущие по
уравнениям
![]()
Однако эти реакции при стандартных условиях идут чрезвычайно медленно. Они идут быстро в присутствии катализаторов (платины для первой и воды для второй). Катализатор как бы снимает кинетический "тормоз", и тогда проявляется термодинамическая природа вещества. Скорость химических реакций зависят от многих факторов, основные из которых - концентрация (давление)реагентов, температура и действие катализатора. Эти те факторы определяют и достижение равновесия в реагирующей системе.
П
 РИМЕР
I. Bo сколько раз изменится скорость
прямой и обратной реакции в системе
РИМЕР
I. Bo сколько раз изменится скорость
прямой и обратной реакции в системе
![]()
![]() , если объем газовой смеси уменьшить
в три раза? B какую сторону сместится
равновесие системы?
, если объем газовой смеси уменьшить
в три раза? B какую сторону сместится
равновесие системы?
РЕШЕНИЕ:
Обозначим концентрации реагирующих
веществ:
![]() =
а,
=
а,
![]() =
в,
=
в,
![]() =
с. Согласно закону действия масс скорости
(V) прямой и обратной реакций до
изменения объема равны
=
с. Согласно закону действия масс скорости
(V) прямой и обратной реакций до
изменения объема равны
![]()
где K и K1 - константы скорости прямой и обратной реакций.
После
уменьшения объема гомогенной системы
в три раза концентрация каждого из
реагирующих веществ увеличится в три
раза:
![]() При новых концентрациях скорости (V/)
прямой и обратной реакций равны
При новых концентрациях скорости (V/)
прямой и обратной реакций равны
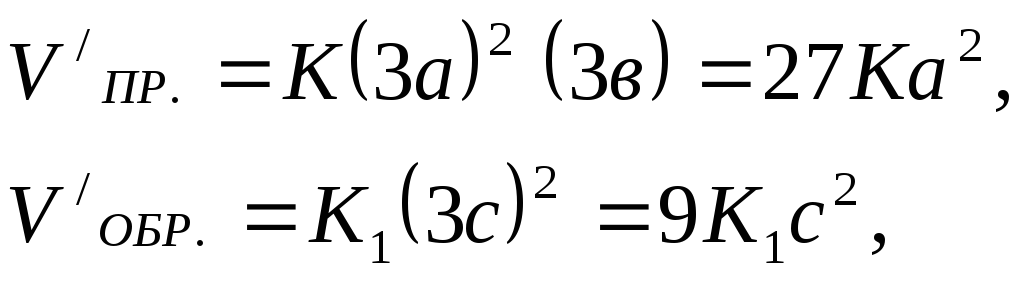
Отсюда

Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной - только в 9 раз. Равновесие системы сместилось в сторону образования серного ангидрида.
ПРИМЕР 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 7O0С, если температурный коэффициент реакции равен 2.
РЕШЕНИЕ: Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле

Следовательно, скорость реакции (Vt2), протекающей при температуре 7O0C, увеличилась по сравнению со скоростью (Vt1), протекающей при температуре 3O0C, в 16 раз.
ПРИМЕР 3. Константа равновесия гомогенной системы


![]()
![]()
при 850°с равна 1,0. Вычислите концентрации всех веществ при равнове-
сии,
если исходные концентрации:
![]() =
3 моль/л,
=
3 моль/л,
![]() =
2 моль/л.
=
2 моль/л.
РЕШЕНИЕ: При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей есть тоже величина постоянная и называется константой равновесия данной системы:

B условиях задачи даны исходные концентрации, тогда как в выражение
K
РАВН
входят только равновесные концентрации
всех веществ системы. Предположим,
что к моменту равновесия концентрация
![]() = х моль/л. Согласно уравнения системы
число молей образовавшегося водорода
при этом будет также х моль/л. По столько
же молей (x моль/л) CO и H2O
расходуется для образования по x молей
CO2
и H2.
Следовательно, равновесные концентрации
всех четырех веществ будут
= х моль/л. Согласно уравнения системы
число молей образовавшегося водорода
при этом будет также х моль/л. По столько
же молей (x моль/л) CO и H2O
расходуется для образования по x молей
CO2
и H2.
Следовательно, равновесные концентрации
всех четырех веществ будут
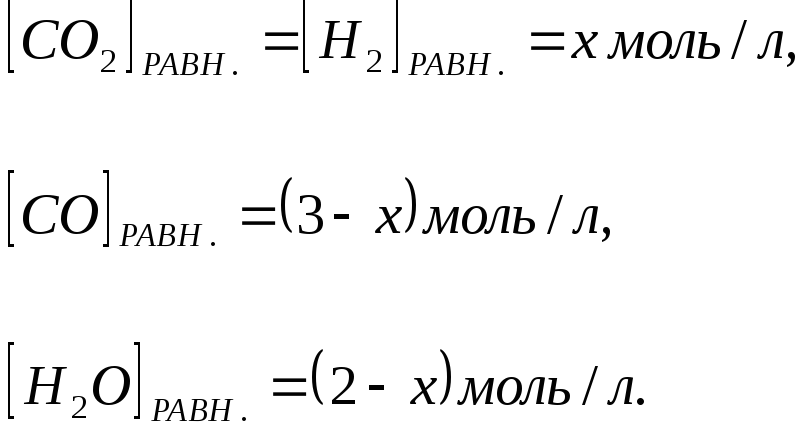
Зная константу равновесия, находим значение x, а затем и исходные концентрации всех веществ:
![]()
х2 = 6-2х-3э+х2 , 5x = 6 , x = 1,2 моль/л.
Таким образом, искомые равновесные концентрации равны
![]() =
1,2 моль/л ,
=
1,2 моль/л ,
![]() =
1,2 моль/л ,
=
1,2 моль/л ,
![]() =
3-I,2=l-,8
моль/л ,
=
3-I,2=l-,8
моль/л ,
![]() 2-1,2=0,8
моль/л.
2-1,2=0,8
моль/л.
пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению


![]()
![]() ;
;
![]() =
+92,59 кДж.
=
+92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции - разложения PСl5 ?
PЕШЕНИE:
Смещением или сдвигом химического
равновесия называют изменение равновесных
концентраций реагирующих веществ в
результате изменения одного из условий
реакции. Направления, в котором сместилось
равновесие, определяется по принципу
Ле-Шателье: а) так как реакция разложения
эндотермическая (![]() H>O), то для смещения равновесия в
cторону, прямой реакции нужно повысить
температуру; б) так как в данной системе
разложение PCl5
ведет
к увеличению объема (из одной молекулы
газа образуются две газообразные
молекулы), то для смещения равновесия
в сторону прямой реакции надо уменьшить
давление; в) смещения равновесия в
указанном направлении можно достигнуть
как увеличением концентрации PCl5,
так и уменьшением концентрации PCl3
или
PCl2.
H>O), то для смещения равновесия в
cторону, прямой реакции нужно повысить
температуру; б) так как в данной системе
разложение PCl5
ведет
к увеличению объема (из одной молекулы
газа образуются две газообразные
молекулы), то для смещения равновесия
в сторону прямой реакции надо уменьшить
давление; в) смещения равновесия в
указанном направлении можно достигнуть
как увеличением концентрации PCl5,
так и уменьшением концентрации PCl3
или
PCl2.
КОНТРОЛЬНЫЕ ВОПРОСЫ
121. Окисление серы и Диоксида серы протекает по уравнениям:
а)
![]() б)
б)
![]()
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в 4 раза?
122. Напишите выражение для константы равновесия гомогенной системы


![]()
![]() Как
изменится скорость прямой реакции -
образования аммиака, если увеличить
концентрацию водорода в 3 раза?
Как
изменится скорость прямой реакции -
образования аммиака, если увеличить
концентрацию водорода в 3 раза?
123. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были: [N2] = 0,049 моль/л; [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ момент, когда [Nо] стала равной 0,005 моль/л.
Ответ: [N2] = 0,0465 моль/л; [O2] = 0,0075 моль/л. .
124. Реакция идет по уравнению N2 + 3H2 = 2 N H3 . Концентрации участвующих в ней веществ были:[N2] = 0,80 моль/л; [H2]= 1,5 моль/л; [NH3]= 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] стала равной 0,50 моль/л.
Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л.
125. Реакция идет по уравнению H2 +J2 = 2HJ . Константа скорости этой реакции при 5080C равна 0,16. Исходные концентрации реагирующих веществ были: [H2] = 0,04 моль/л; [J2] = 0,05 моль/л. Вычислите начальную скорость реакции и скорость ее, когда [H2] стала равной 0,03 моль/л.
Oтвет: 3,2 · IO-4 ; I,92 · IO-4.
-
Вычислите, во сколько раз уменьшится скорость реакции, протекаю- . чей в газовой фазе, если понизить температуру от 120 до 8O0C. Температурный коэффициент скорости реакции равен 3.
-
Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 6O0C, если температурный коэффициент скорости данной реакции равен 2?
-
Как изменится скорость реакции, протекающей в газовой фазе при понижении температуры на 3O0C, если температурный коэффициент скорости данной реакции равен 3?
-
Н

 апишите
выражение для константы равновесия
гомогенной системы
2SO2
+ O2
2SO3.
Как изменится скорость прямой реакции
– образование серного ангидрида, если
увеличить концентрацию SO2
в 3 раза?
апишите
выражение для константы равновесия
гомогенной системы
2SO2
+ O2
2SO3.
Как изменится скорость прямой реакции
– образование серного ангидрида, если
увеличить концентрацию SO2
в 3 раза?
130. Напишите выражение для константы равновесия гомогенной системы

 CH4
+ CO2
2CO + 2H2.
Как следует изменить температуру и
давление, чтобы повысить выход
водорода? Прямая реакция - образование
водорода - эндотермическая.
CH4
+ CO2
2CO + 2H2.
Как следует изменить температуру и
давление, чтобы повысить выход
водорода? Прямая реакция - образование
водорода - эндотермическая.
131. Константа скорости реакции разложения N2О, протекающей по уравнению 2N 2O = 2N2 + O2, равна 5 ·IO-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N2O.
Ответ: 1,8 · 10-2; 4,5 · 10-3.
132. Напишите выражение для константы равновесия гетерогенной системы
C
 O2
+ C 2CO.
O2
+ C 2CO.
Как изменится скорость прямой реакции - образования CO, если концентрацию CO2 уменьшить в 4 раза? Как следует изменить давление, чтобы повысить выход CO?
1
 33.Напишите
выражение для константы равновесия
гетерогенной систе
мы C + H2O(г)
CO + H2.
33.Напишите
выражение для константы равновесия
гетерогенной систе
мы C + H2O(г)
CO + H2.
Как следует изменить концентрацию и давление, чтобы сместить paв- новесие в сторону обратной реакции - образования водяных паров?
1
 34.Равновесие
гомогенной системы 4HCl(Г)+О2
2Н2О(Г)
+
2Сl2(Г)
установилось
при следующих концентрациях реагирующих
веществ:
H2O = 0,14 моль/л; Сl2
= 0,14 моль/л; НCl = 0,20 моль/л; O2
=
= 0,32 моль/л. Вычислите исходные
концентрации хлористого водо -
рода
и кислорода.
34.Равновесие
гомогенной системы 4HCl(Г)+О2
2Н2О(Г)
+
2Сl2(Г)
установилось
при следующих концентрациях реагирующих
веществ:
H2O = 0,14 моль/л; Сl2
= 0,14 моль/л; НCl = 0,20 моль/л; O2
=
= 0,32 моль/л. Вычислите исходные
концентрации хлористого водо -
рода
и кислорода.
Ответ: НСlИСХ. = 0,48 моль/л; O2 ИСХ. = О,39 моль/л.
135.Вычислите константу равновесия для гомогенной системы CO(Г) +

 Н2О(Г)
СО2(Г)
+
Н2(Г),
если
равновесные концентрации реагирующих
веществ: CO = 0,004 моль/л; H2O
= 0,O64 моль/л; CO2_=
0,016 моль/л;
Н2О(Г)
СО2(Г)
+
Н2(Г),
если
равновесные концентрации реагирующих
веществ: CO = 0,004 моль/л; H2O
= 0,O64 моль/л; CO2_=
0,016 моль/л;
H2 = 0,016 моль/л.
Ответ: K = 1,0.
1
 36.Константа
равновесия гомогенной системы CO(Г)
+ Н2О(Г)
СО 2(Г)+Н2(Г)
при некоторой температуре равна
1,0. Вычислите равновес-
ные концентрации
всех реагирующих веществ, если исходные
концент-
рации: CO = =, I = моль/л; H2O
= 0,40 моль/л.
36.Константа
равновесия гомогенной системы CO(Г)
+ Н2О(Г)
СО 2(Г)+Н2(Г)
при некоторой температуре равна
1,0. Вычислите равновес-
ные концентрации
всех реагирующих веществ, если исходные
концент-
рации: CO = =, I = моль/л; H2O
= 0,40 моль/л.
Ответ: СО2 = Н2 = 0,08 моль/л; CO = 0,02 моль/л; H 2O = 0,32 моль/л.
1
 37.Константа
равновесия гомогенной системы N2
+3H2
2NH3
при
температуре
4000C
равна O,I. Равновесные концентрации
водорода и аммиака соответственно
равны: 0,2 моль/л и 0,08 моль/л. Вычислите
равновесную и исходную концентрацию
азота. Ответ: 8 моль/л; 8,04 моль/л.
37.Константа
равновесия гомогенной системы N2
+3H2
2NH3
при
температуре
4000C
равна O,I. Равновесные концентрации
водорода и аммиака соответственно
равны: 0,2 моль/л и 0,08 моль/л. Вычислите
равновесную и исходную концентрацию
азота. Ответ: 8 моль/л; 8,04 моль/л.
138.При некоторой температуре равновесие гомогенной системы 2NO +
+
 О2
2NO2
установилось при следующих концентрациях
реагирую- щих веществ: NO = 0,2 моль/л; O2
= 0,1 моль/л; NO2
= 0,1 моль/л. Вычислите константу равновесия
и исходную концентрацию N0
и O2.
Ответ: K = 2,5; [NO]
= 0,3
моль/л; [O
2]
= 0,15 моль/л.
О2
2NO2
установилось при следующих концентрациях
реагирую- щих веществ: NO = 0,2 моль/л; O2
= 0,1 моль/л; NO2
= 0,1 моль/л. Вычислите константу равновесия
и исходную концентрацию N0
и O2.
Ответ: K = 2,5; [NO]
= 0,3
моль/л; [O
2]
= 0,15 моль/л.
-
П



 очему
при изменении давления смещается
равновесие системы N2
+
+ 3H2
2NH3
и не смещается равновесие системы N2
+O2
2NO?
Напишите выражения для констант
равновесия каждой из данных
систем.
очему
при изменении давления смещается
равновесие системы N2
+
+ 3H2
2NH3
и не смещается равновесие системы N2
+O2
2NO?
Напишите выражения для констант
равновесия каждой из данных
систем. -
И

 сходные
концентрации NO и Сl2
в гомогенной системе 2NO
+ Cl2
сходные
концентрации NO и Сl2
в гомогенной системе 2NO
+ Cl2
2NOCl составляют соответственно 0,5 и О,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
Ответ: 0,416.
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА
Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентраций.
1. Молекулярная концентрация См - отношение количества вещества (в молях), содержащегося в системе (например, в растворе) к V этой системы. Единица измерения молярной концентрации моль/м3 (дольная про- изводная, СИ - моль/л). Например, CМ (H 2SO4) = 1 моль/л, CМ (KOH) = 0,5 моль/л. Раствор, имеющий концентрацию I моль/л, называют молярным раствором и обозначают IM раствор; соответственно раствор 0,5 моль/л обозначают 0,5 М.
2. Нормальная концентрация (молярная концентрация эквивалента) CН - это отношение количества вещества эквивалента (моль) к объему раствора (л). Единица измерения нормальной концентрации: моль/л (доль ная производная, СИ). Например, СН (KОH) = I моль/л, СН (I/2Н2SO4) = =I моль/л, СН (1/3AlCl3) = 0,01 моль/л.
Раствор, в одном литре которого содержится I моль вещества эквивалента, называют нормальным и обозначают IH. Соответственно могут быть 0,I H;
0,01 H и т.п. растворы.
3.Моляльность Cm - отношение количества растворенного вещест- ва (в молях) к массе растворителя. Единица измерения моляльности моль/кг.
Например, Cm (HCl/ H2O) = 2 моль/кг.
4.Массовая доля - отношение массы данного компонента, содержа- щегося в системе, к общей массе этой системы. Массовая доля может быть выражена в долях единицы, процентах (%), промиле и миллионных долях. Массовая доля данного компонента, выраженная в процентах, по- казывает, сколько граммов данного компонента содержится в 100 г рас твора .
5.Титр раствора (T) - масса вещества, содержащегося в одном ку- бическом сантиметре или в одном миллилитре раствора. Единица измере- ния титра - кг/см3, г/см3, г/мл.
ПРИМЕР 1. Вычислите: а) молярную (СМ); б) нормальную СН); в) моляльную (Cm.); г) процентную концентрации раствора (0%), полученного при растворении 18 г H3PO4 в 282 см3 воды, если плотность его I,03I г/см3. Чему равен титр (T) этого раствора?
РЕШЕНИЕ: а) молярная концентрация (СМ),или молярность, показывает число молей растворенного вещества в 1 л раствора. Масса I л раствора I03I г. Массу кислоты в литре раствора находим из отношения (так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г):
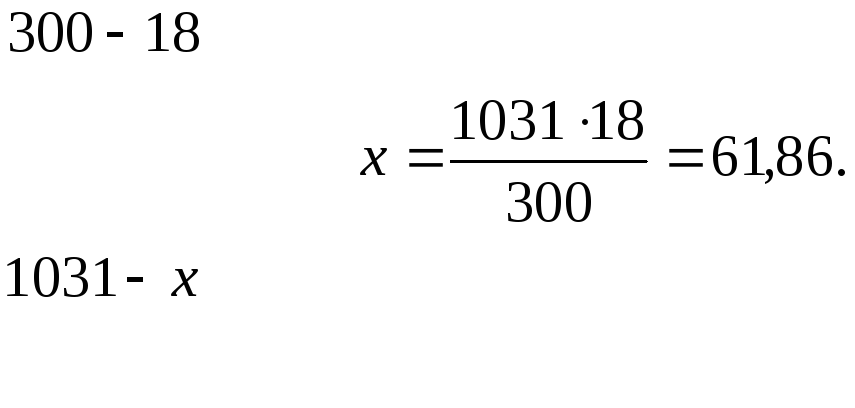
Молярность раствора получим делением числа граммов в 1 л раствора на молярную массу H3 PO4:
СМ = 61,86/97,99 = 0,63 М;
б) нормальная концентрация (Сн) (молярная концентрация эквивалента), или нормальность, показывает количество эквивалента (моль) к объему раствора (л). Таким образом:
Г
-
"
![]()
в) моляльная концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу Н3РО4в 1000 г растворителя находим из соотношения:

Отсюда Cm = 68,83/97,99 = 0,65 моль/кг.
г) весовая процентная концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора, следовательно,

д)титром раствора называется количество граммов растворенного веще- ства в I см3 (мл). раствора. Так как в I л раствора содержится 61,86 г кислоты, то
T = 61,86/1000 = 0,06186 г/см3.
ПРИМЕР: 2. Ha нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты?
РЕШЕНИЕ : Так как вещества взаимодействуют между собой в эквивалентных количествах, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
![]()
ПРИМЕР 3. K I л 10% раствора KOH (плотность 1,092 г/см3) прибавили 0,5л 5%-гo раствора KOH (плотность 1,045 г/см3). Объем смеси довели до 2.л. Вычислите молярную концентрацию полученного раствора.
РЕШЕНИЕ: Масса одного литра 10%-го раствора KOH 1092 г. B этом растворе содержится
1092 • 10/100 = 109, 2 г KOH .
Масса 0,5 л 5%-го раствора 1045 · 0,5=522,5 г. B этом растворе содержит- ся 525 • 5/100 = 26,125 г KOH .
B общем объеме полученного раствора (2 л) масса КОН составляет 109,2 +
+ 26,125 = 135,325 г. Отсюда молярность этого раствора
![]()
где 56,1 - молярная масса KOН
ПРИМЕР 4. Какой объем 96%-ной H2SO4, плотность которой 1,84 г/см3, потребуется для приготовления 0,4 н (l/2 H2SO4) раствора?
РЕШЕНИЕ: Для приготовления 3 л 0,4 н (1/2 H2SO4) раствора требуется 98/2· 0,4 · 3 = 58,85 г H2 O4, где 98 - молярная масса H2SO4. Масса 1 см3 96%-ной кислоты 1,84 г. B этом растворе содержится I,84 · 96/IOO = 1,766 г H2SO4.
Следовательно, для приготовления 3 л 0,4 н (1/2 H2SO4) раствора надо
взять 58,85 /1,766 = 33,32 см3 этой кислоты.
Контрольные вопросы
141,
Вычислите молярную и нормальную концентрации 20%-го раствора хло-рида кальция, плотность которого 1,178 г/см3.
Ответ: 2,1 M; 4,2 н.
142.
Чему равна нормальность 30%-го раствора aOH, плотность которого 1,328 г/см 3? K I л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора.
Ответ: 9,96 н; 6,3%.
143.K 3 л 10%-го раствора HNO3, плотность которого 1,054 г/см3 , прибавили 5 л 2%-го раствора той же кислоты с плотностью 1,009 г/см3 .
Вычислите процентную и молярную концентрации полученного раствора, если считать, что его объем равен 8 л.
Ответ: 5,0%; 0,82 M.
144.Вычислите нормальную и моляльную концентрации 20,8%-го раствора HNO3, плотность которого 1,12 г/см3 . Сколько граммов кислоты содержится в 4 л этого раствора?
Ответ: 3,70 н; 4,17н ; 931,8 г.
145.Вычислите молярную, нормальную и моляльную концентрации 16%-го раствора хлорида алюминия, плотность которого I,I49 г/см3 . Ответ: 1,38 M, 4,14 н (1/3 AlCl3); 1,43 моль/кг.
146.Сколько и какого вещества останется в избытке, если к 75 см3 0,15 M раствора H2SO4 прибавить 125 см3 0,2 н раствора KOH?
Ответ: 0,14 г KOH.
147.Для осаждения в виде AgCl всего серебра, содержащегося в 100см3 раствора AgNO3, потребовалось 50 см3 0,2 н раствора HCl :
Чему равна нормальность раствора AgNO3? Сколько граммов AgCl выпало в осадок? Ответ: 0,1 н; 1,433 г.
148.Какой объем 20,01%-го раствора HCl (плотность 1,100 г/см3) тре- буется для приготовления 1 л IO,I7%-гo раствора (плотность 1,050 г/см3).
Ответ:.485,38см3.
149.Смешали 10 см3 10%-го раствора HNO3 (плотность 1,056 г/см3) 100см3 30%-го раствора НNO3 (плотность 1,184 г/см3). Вычислите процентную концентрацию полученного раствора.
Ответ: 28,38%. .
-
Какой объем 50%-гo раствора KOH (плотность 1,538 г/см3) требует- ся для приготовления 3 л 6%-гo раствора (плотность 1,048 г/см3)? Ответ: 245,5 см3.
-
Какой объем 10%-го раствора карбоната натрия Na2CO3 (плотность I,I05 г/см3) требуется для приготовления 5 л 2%-го раствора (плотность 1,02 г/см3)?
Ответ: 923,1 см3.
152.На нейтрализацию 31,0 см3 0,16 н раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны нормальность и титр раствора H2SO4?
Ответ: 0,023 н; I,I27-103 г/см3.
153.
Какой объем 0,3 н раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
Ответ: 26,6 см3.
154.Ha нейтрализацию I л раствора, содержащего 1,4 г KOH, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты.
Ответ: 0,53 н.
155.Сколько граммов HNO3 содержалось в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н раствора. NaOH? Чему равен титр раствора NаОН?
Ответ: 0,882 г; 0,016 г/см3
156.Сколько граммов NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20% раствор?
Ответ: 100 г.
157.Смешали 300 г 20%-гo раствора и 500 г 40%-гo NaCl . Чему равна процентная концентрация полученного раствора?
Ответ: 32,5%
158.Смешали 247 г 62%-гo и 145 г I8%-гo раствора серной кислоты. Какова процентная концентрация раствора после смешения?
Ответ: 45,72%.
159.
Из 700 г 60%-ой серной кислоты выпариванием удалили 200 г воды. Чему равна концентрация оставшегося раствора?
Ответ:84%.
160.Из 10 кг 20%-гo раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора?
Ответ: I6,7%.
СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
Разбавленные растворы неэлектролитов обладают рядом свойств (кол-лигативные свойства), количественное выражение которых зависит только от числа находящихся в растворе частиц растворенного вещества и количества растворителя. Некоторые коллигативные свойства растворов используются для определения молярной массы растворенного вещества.
Если к растворителю прибавить нелетучие вещества, то давление пара растворителя над раствором уменьшается. A это, в свою очередь, вызывает повышение температуры кипения раствора и понижение температуры его замерзания по сравнению с чистым растворителем.
B
общем виде зависимость степени понижения
температуры замерзания
![]() и степени повышения температуры кипения
и степени повышения температуры кипения
![]() разбавленных растворов от концентрации
неэлектролита можно записать так:
разбавленных растворов от концентрации
неэлектролита можно записать так:
![]() ,
,
J K
где K и E - коэффициенты пропорциональности, зависящие от природы растворителя;
Cm - концентрация растворенного вещества (число молей в 1000г
растворителя, моляльность).
Коэффициенты пропорциональности K и E называются соответственно криоскопической и эбуллиоскопической константами.
ПРИМЕР I. Вычислите температуры кристаллизации (замерзания) и повышение температура кипения 2%-го водного раствора глюкозы C6H12O6.
РЕШЕНИЕ:
Так как
![]() = K·Cm
, то при K = 1,86 град.(для H 2O)
= K·Cm
, то при K = 1,86 град.(для H 2O)
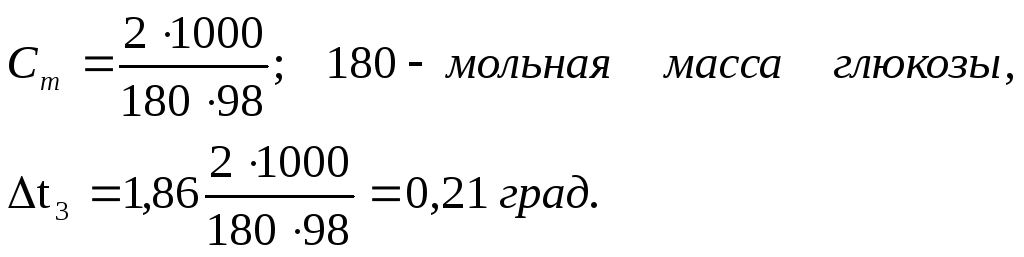
Вода замерзает при О°С, следовательно, температура кристаллизации раствора 0-0,21= - 0,210C.
Аналогично:
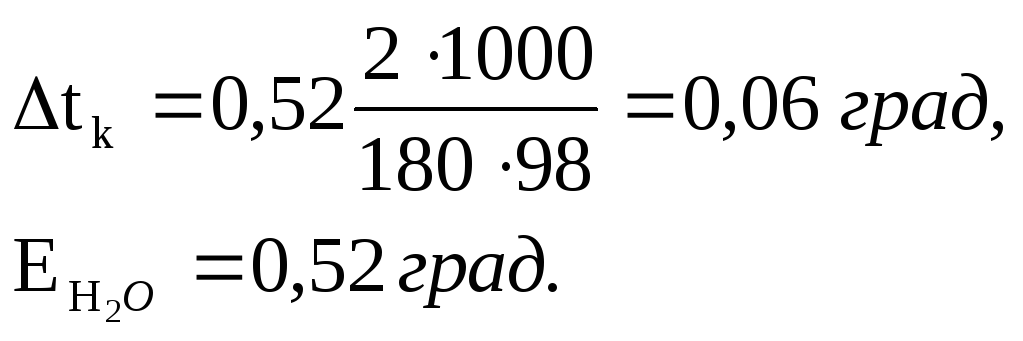
Вода кипит при 1000C, следовательно, температура кипения этого раствора
100 + 0,06 = 100,060C.
ПРИМЕР 2. Раствор, содержащий 1,22 г бензойной кислоты C6H5COOH и 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуг-
лерода
46,30
C. Вычислите эбуллиоскопическую константу
сероуглерода. РЕШЕНИЕ: Повышение
температуры кипения
![]() 46,529 - 46,3 =
46,529 - 46,3 =
= 0,229 град. Молярная масса бензойной кислоты 122. Отсюда
![]()
ПРИМЕР 3. Раствор, содержащий 11,04 г глицерина в 800 г воды кристаллизуется при -0,2790C. Вычислите молярную массу глицерина.
РЕШЕНИЕ: Температура кристаллизации чистой воды O0C. Следовательно, понижение температуры замерзания
![]()
Масса глицерина, приходящаяся на 100 г воды,
![]()
Отсюда
![]() моль/кг, следовательно,
моль/кг, следовательно,
![]()
ПРИМЕР 4. Вычислите процентную концентрацию водного раствора мочевины (NН2)2CO, зная, что температура замерзания этого раствора равна
-0,4650C.
РЕШЕНИЕ: Температура кристаллизации чистой воды 0°С, следовательно,
![]() =
O - (-0,465) = 0,465 град. Зная, что молярная
масса мочевины 60 г., находим массу
(см. пример 3) m2
растворенного вещества, приходящего
на
=
O - (-0,465) = 0,465 град. Зная, что молярная
масса мочевины 60 г., находим массу
(см. пример 3) m2
растворенного вещества, приходящего
на
1000 г воды:
![]()
Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15 =
= IOI5г. Процентное содержание мочевины в данном растворе находим из соотношения:
в 10I5 г раствора - 15 г вещества ;
100г - x г ;
![]()
KOHTPOЛЬНЫЕ ВОПРОСЫ
161.Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,2960C. Температура кристаллизации бензола 5,50C
Криоскопическая константа 5,1 град. Вычислите мольную массу растворенного вещества.
Ответ: 128 г/моль.
162.Вычислите процентную концентрацию водного раствора сахара C12H22O11, зная температуру кристаллизации раствора (-0,930C). Криоскопическая константа воды 1,86 град.
Ответ: 14,6%.
163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86 град. Ответ: -1,O30C.
164. Раствор, содержащий 3,04 г камфоры C6H16O в 100 г бензола, кипит при 80,7140C. Температура кипения бензола 80,20C. Вычислите эбуллиоскопическую константу бензола.
Ответ: 2,57 град.
165. Вычислите процентную концентрацию водного раствора глицерина C3H5(OH)3, зная, что этот раствор кипит при 100,390C. Эбуллиоскопическая константа воды 0,52 град.
Ответ: 6,4%.
166. Вычислите мольную массу неэлектролита, зная, что раствор, содер- жащий 2,25 г этого вещества в 250г воды, кристаллизуется при -0,2790C. Криоскопическая константа воды 1,86 град.
Ответ: 60 г/моль.
167. Вычислите температуру кипения 5%-го раствора нафталина C10H8 в бензоле. Температура кипения бензола 80,20C. Эбуллиоскопическая константа его 2,57 град.
Ответ: 81,250C.
-
Раствор, содержащий 26,65 г некоторого неэлектролита в 300 г во- ды, кристаллизуется при -0,4650C. Вычислите мольную массу раст- воренного вещества. Криоскопическая константа воды 1,86 град. Ответ: 342 г/моль.
-
Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 3,56 г антрацена C14H10 в 100 г уксусной кислоты, кристаллизуется при 15,7180C. Температура кристаллиза- ции уксусной кислоты 16,650C.
Ответ: 3,9 град.
-
При растворении 4,86 г серы в 60 г бензола температура кипения его повышается на 0,81°. Сколько атомов содержит молекула серы в этом растворе? Эбуллиоскопическая константа бензола 2,57 град.
Ответ: 8,0.
171. Температура кристаллизации раствора, содержащего 66,3 некоторо- го неэлектролита в 500 г воды, равна -0,5580C. Вычислите моль- ную массу растворенного вещества. Криоскопическая константа во- ды 1,86 град.
Ответ: 442 г/моль.
172. Какую массу анилина С6Н5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбуллиоскопическая константа этилового эфира 2,12 град.
Ответ: 1, I6 г.
-
Вычислите температуру кристаллизации 2%-го раствора этилового спирта C2H5OH, зная, что криоскопическая константа воды 1,86 град.
Ответ: -0,820C.
-
Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,4650? Криоскопическая константа воды 1,86 град.
Ответ: I,I2 г.
175. Вычислите процентную концентрацию водного раствора глюкозы C6H12O6, зная, что этот раствор кипит при 100,260C. Эбуллиоско- пическая константа воды 0,52 град.
Ответ: 8,25%.
176. Сколько граммов фенола C6H5OH следует растворить в 125 г бензо- ла, чтобы температура кристаллизации раствора была ниже темпера туры кристаллизации бензола на 1,7° ? Криоскопическая константа бензола 5,1 град.
Ответ: 3,91 г,
177. Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на O,260? Эбуллио- скопическая константа воды 0,52 град.
Ответ: 7,5 г.
178. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372°. Вычислите моль- ную массу растворенного вещества. Криоскопическая константа вода равна I,86 град.
Ответ: 92 г/моль.
179. Вычислите температуру кипения 15%-го водного раствора пропилового спирта C3H7OH, зная, что эбуллиоскопическая константа воды 0,52 град. Ответ: 101,52°С.
130.Вычислите процентную концентрацию водного раствора метанола CH3OH, температура кристаллизации которого -2,790C. Криоскопическая константа воды 1,86 град.
Ответ: 4,58%.
ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ ОБМЕНА
При решении задач этого раздела желательно пользоваться источниками, указанными в рекомендуемом библиографическом списке.
Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. B этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме зарядов в правой части уравнения.
ПРИМЕР 1. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) НСlи NaOH; б) Pb (NO3)2 и Na2S ; в) NаСlO и HNO3; г) K2CO3 и H2SO4; д) CH3COOH и NaOH.
РЕШЕНИЕ: Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) HCl + NаОН = NaCl +H 2O ,
б) Pb (N03)2 + Na2S = PbS + 2NaNO3 ,
в) NaClO + HNO3 = NaNO3+HСlО ,
г) K2CO3 + H2SO4 = K2SO4 + H2O + CO2 ,
д) CH3COOH + NаОН = CH3COONa + H 2O .
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образование слабых электролитов (H2O, HClO), осадка (РbS), газа (CO2). Все реакции идут в cторону большего связывания ионов и вода - более слабый электролит.
Исключив
одинаковые ионы из обеих частей равенства
a) Na+
и Cl-![]() ; 6)Na+
и NO3-
в) Na+
и NO3-
г) K+
и SO42-
д) Na+,
получим ионно-молекулярные уравнения
соответствующих реакций: a) H+
+ 0H-
=
H2O;
б) Рb2+
+S2-
= PbS
;
; 6)Na+
и NO3-
в) Na+
и NO3-
г) K+
и SO42-
д) Na+,
получим ионно-молекулярные уравнения
соответствующих реакций: a) H+
+ 0H-
=
H2O;
б) Рb2+
+S2-
= PbS
;
в) ClO- + H+ = HClO; г) CO32- + 2H+ = H2O + CO2;
д) СH3COOH + OH- = CH3COO- + H2O
ПРИМЕР 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
а) SO32- + 2H+ = SO2 + H2O,
б) Pb2+ + CrO42- = PbCrO4,
в) HCO3- + OH- = CO32- + H 2O,
г) ZnOH+ + H+ = Zn2+ + H2O.
РЕШЕНИЕ: В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов. Следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например,
а) Na2SO3 + 2HCl = 2NaCl + SO2 + H2O,
б) Pb(NO3)2+ K2CrO4 = PbCrO4 + 2KNO3,
в) KHCO3 + KOH = K2CO3 + H2O,
г) ZnOHCl + HCl = ZnCl2 + H2O.
