
|
Номер варіанту |
Номери задач |
|||||||||
|
01 |
3 |
14 |
25 |
36 |
47 |
58 |
69 |
80 |
81 |
92 |
|
02 |
4 |
15 |
26 |
37 |
48 |
59 |
70 |
71 |
82 |
93 |
|
03 |
5 |
16 |
27 |
38 |
49 |
60 |
61 |
72 |
83 |
94 |
|
04 |
6 |
17 |
28 |
39 |
50 |
51 |
62 |
73 |
84 |
95 |
|
05 |
7 |
18 |
29 |
40 |
41 |
52 |
63 |
74 |
85 |
96 |
|
06 |
8 |
19 |
30 |
31 |
42 |
53 |
64 |
75 |
86 |
97 |
|
07 |
9 |
20 |
21 |
32 |
43 |
54 |
65 |
76 |
87 |
98 |
|
08 |
10 |
11 |
22 |
33 |
44 |
55 |
66 |
77 |
88 |
99 |
|
09 |
1 |
12 |
23 |
34 |
45 |
56 |
67 |
78 |
89 |
100 |
|
10 |
2 |
13 |
24 |
35 |
46 |
57 |
68 |
79 |
90 |
91 |
|
11 |
1 |
14 |
28 |
32 |
46 |
60 |
64 |
78 |
82 |
96 |
|
12 |
2 |
15 |
29 |
33 |
47 |
54 |
65 |
79 |
83 |
97 |
|
13 |
3 |
16 |
30 |
34 |
48 |
55 |
66 |
80 |
84 |
98 |
|
14 |
4 |
17 |
21 |
35 |
49 |
56 |
67 |
71 |
85 |
99 |
|
15 |
5 |
18 |
22 |
36 |
50 |
57 |
68 |
72 |
86 |
100 |
|
16 |
6 |
19 |
23 |
37 |
41 |
58 |
69 |
73 |
87 |
91 |
|
17 |
7 |
20 |
24 |
38 |
42 |
59 |
70 |
74 |
88 |
92 |
|
18 |
8 |
11 |
25 |
39 |
43 |
60 |
61 |
75 |
89 |
93 |
|
19 |
9 |
12 |
26 |
40 |
44 |
53 |
62 |
76 |
90 |
94 |
|
20 |
10 |
13 |
27 |
31 |
45 |
52 |
63 |
77 |
81 |
95 |
|
21 |
5 |
19 |
23 |
37 |
41 |
55 |
69 |
73 |
87 |
91 |
|
22 |
7 |
13 |
27 |
32 |
45 |
59 |
65 |
78 |
84 |
95 |
|
23 |
9 |
14 |
28 |
38 |
49 |
53 |
67 |
71 |
85 |
98 |
|
24 |
6 |
18 |
26 |
33 |
46 |
54 |
66 |
74 |
83 |
99 |
|
25 |
3 |
15 |
30 |
39 |
47 |
60 |
68 |
78 |
86 |
92 |
|
26 |
8 |
16 |
29 |
36 |
48 |
52 |
62 |
75 |
88 |
100 |
|
27 |
1 |
11 |
21 |
36 |
42 |
51 |
61 |
72 |
89 |
93 |
|
28 |
2 |
17 |
25 |
40 |
43 |
56 |
64 |
76 |
90 |
94 |
|
29 |
10 |
20 |
22 |
34 |
44 |
57 |
70 |
79 |
85 |
97 |
|
30 |
4 |
12 |
24 |
33 |
50 |
58 |
69 |
80 |
81 |
100 |
-
Визначте еквівалент та масу моль еквівалента фосфору, кисню та брому у сполуках
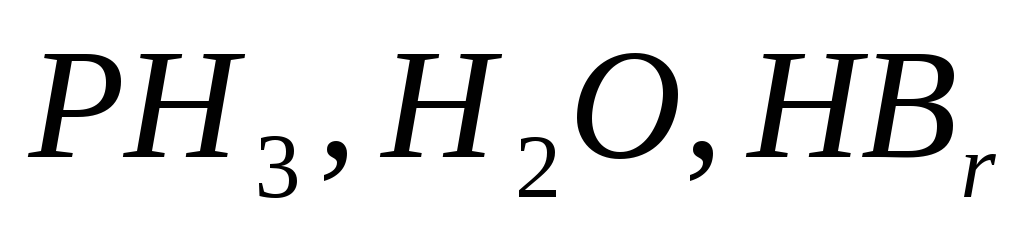 .
. -
0,0547 r металу виділяє із кислоти 50,4 мл водню при стандартних умовах. Визначте масу моль еквівалента металу.
-
При спалюванні 0,5 r металу пішло 231 мл кисню при стандартних умовах. Визначте масу моль еквівалента металу.
-
Оксид металу містить 39,69 % кисню. Визначте масу моль еквівалента металу.
-
0,477 г металу утворює 0,597 г оксиду. Визначте масу моль еквівалента металу.
-
При взаємодії 1,525 г металу з кислотою виділилося 1,4 г водню при стандартних умовах. Визначте масу моль еквівалента металу.
-
5 г металу утворюють 9,44 г оксиду. Визначте масу моль еквівалента металу.
-
5,6 г заліза при взаємодії з сіркою утворюють 7,05 г сульфіду. Визначте масу моль еквівалента заліза, якщо еквівалентна маса сірки 16 г/моль.
-
1,8 г металу при взаємодії з хлором утворюють 7,05 г хлориду. Визначте масу моль еквівалента металу, якщо еквівалентна маса хлору 35,5 г/моль.
-
2,28 г металу при взаємодії з киснем утворюють 3,78 г оксиду. Визначте масу моль еквівалента металу.
-
Запишіть електроні формули атомів елементів з порядковими номерами 17 та 28 за правилом Клечковського. Виділіть валентні електрони. Розпишіть їх в квантові комірці. До якої родини вони належать?
-
Які орбіталі атома заповнюються раніш: 4d чи 5s; 6s чи 5p? Чому? Запишіть електрону формулу атома елемента №43 за правилом Клечковського. Виділіть валентні електрони.
-
Скільки електронів може максимально розміститися на s-, p-, d-, f-, орбіталях даного енергетичного рівня? Чому? Запишіть електронну формулу атома елемента №31. Укажіть валентні електрони.
-
Запишіть електрону формулу атомів елементів з порядкованими номерами 16 та 26 за правилом Клечковського. Виділіть валентні електрони, розпишіть їх в квантові комірці. До якої родини вони належать.
-
Які орбіталі атомів заповнюються раніш: 4s чи 3d; 5s чи 4d? Чому? Запишіть електрону формулу атома елемента з порядковим номером 25 за правилом Клечковського. Укажіть які електрони є валентні.
-
Запишіть електрону формулу атома елементів з порядковими номерами 21 та 23 за правилом Клечковського. Скільки d – орбіталей у атомів цих елементів не зайняті електронами/вакантні?
-
Скільки і які значення приймає магнітне квантове число M1, якщо орбітальне число I = 0; I = 1; I = 2; I = 3? Які елементи у періодичній системі називаються s-, p-, d-, f-елементами? Запишіть приклади.
-
Запишіть електроні формули атомів елементів з порядковими номерами 15 та 28 за правилом Клечковського. Чому дорівнює максимальний спін р- електронів у атома елемента №15 та d– електронів у атома елементу №28.
-
Запишіть електроні формули атомів елементів з порядковими номерами 14 та 40 за правилом Клечковського. Скільки вільних / вакантних / d- орбіталей у атома елементів №40?
-
Запишіть принцип Паулі. Чи може бути на якому – не будь підрівні -, p7, d12, f20 електронів? Чому? Запишіть електрону формулу атома елемента №22 за правилом Клечковського. Укажіть його валентні електрони.
-
Визначте зміну ентальпії реакції
![]()
При стандартних умовах.
22. Чи можливе самодовільне протікання реакції при стандартних умовах?
![]()
Якщо
![]()
23. При пропусканні водяної пари понад розжареним вугіллям утворюється водень та оксид вуглецю (II). Визначте зміну ентальпії при стандартних умовах.
24.
Розрахуйте
![]() реакції CaO(m)
+ SiO2(m)
= CaSiO3(m).
реакції CaO(m)
+ SiO2(m)
= CaSiO3(m).
Зробіть висновок: яка це реакція – екзотермічна чи ендотермічна.
25.
Розрахуйте
![]() для реакції
для реакції
![]() якщо
якщо
![]()
![]()
![]()
Зробіть висновок про можливість протікання реакцій при стандартних умовах.
26. Визначте зміну ентропії процесу випарювання води при стандартних умовах якщо:
![]()
27. В
замкнутій системі проходить реакція
![]()
Як при цьому змінюється ентропія, якщо
![]()
28.
Визначте зміну стандартної ентропії
для реакції
![]() якщо
якщо
![]()
![]()
![]()
29.
Визначити
![]() реакцій FeO
(mв)+CO(г)
= Fe(m)+
CO2(газ)
реакцій FeO
(mв)+CO(г)
= Fe(m)+
CO2(газ)
Зробіть висновок яка реакція – екзотермічна чи ендотермічна.
30.
Визначити
![]() реакції
реакції
![]() реакції
реакції
![]() якщо
якщо
![]()
31. Як змінюється швидкість реакцій 2A+B = 2AB, якщо концентрацію А збільшити у два рази, а концентрацію В зменшити у три рази.
32. Як
зміниться швидкість реакцій
![]() ,
якщо тиск в системі збільшується у три
рази.
,
якщо тиск в системі збільшується у три
рази.
33. Приймаючи, що температурний коефіцієнт дорівнює 2, визначити, на скільки градусів необхідно підвищити температуру, щоб швидкість реакції збільшилася у 16 разів.
34. Як
зміниться швидкість реакції
![]() ,якщо об”єм
системи збільшити у три рази.
,якщо об”єм
системи збільшити у три рази.
35. Під
час синтезу аміаку
![]() , за умовою рівноваги концентрація
, за умовою рівноваги концентрація
![]()
![]() ;
;
![]()
![]() .
Визначити константу рівноваги та
початкові концентрації H2
та N2.
.
Визначити константу рівноваги та
початкові концентрації H2
та N2.
36.
Розрахуйте, як зміниться швидкість
прямої та зворотної реакції
![]() ,
якщо зменшити об’єм системи в два рази.
,
якщо зменшити об’єм системи в два рази.
37. Як
зміниться швидкість реакції
![]() ,
якщо парціальний тиск водню збільшити
у три рази?
,
якщо парціальний тиск водню збільшити
у три рази?
38. Як зміниться швидкість реакції, якщо збільшити температуру на 60 К, а температурний коефіцієнт дорівнює 3?
39.
Розрахуйте константу рівноваги для
гомогенної системи
![]() , якщо концентрації речовин за умовою
складають
, якщо концентрації речовин за умовою
складають
![]()
![]() ;
;
![]() ;
;
![]()
40. Як змінюється швидкість реакції, що протікає у газовій фазі, якщо знизити температуру від 320 до 280К. Температура коефіцієнт реакцій дорівнює 3.
41. Визначити масову долю розчину та молярну концентрацію H3PO4 при розчині 18 г її у 282г води, якщо густина розчину 1,031 г/см3.
42. До 1л 10%-ного розчину КОН густиною 1,092 г/см3 додали 0,5л 5%-ного розчину КОН густиною 1,045 г/см3. Об’єм одержаного розчину довели до 2л. Визначити його молярну концентрацію.
43. Визначити молярну концентрацію та концентрацію моль еквівалента 20%-го розчину хлориду кальцію густиною 1,178 г/см3.
44. До 1л 30%-го розчину NaOH густиною 1,328 г/см3 додали 5л води. Визначити процентну концентрацію одержаного розчину та концентрацію моль еквівалента.
45. Визначити концентрацію та концентрацію моль еквівалента 16%-го розчину хлориду алюмінію густиною 1,149 г/см3.
46. Визначити молярну концентрацію розчину хлориду кальцію густиною 1,178 г/см3, якщо масова доля CaCL2 у розчині 20%.
47. До 100 см3 розчину Na2CO3 з концентрацією.13,5 та густиною 1,14 г/см3 додали 200 см3 води. Одержали розчин густиною 1,09 г/см3. Визначити масову та молярну концентрацію цього розчину.
48. Скільки см3 96%-ної сірчаної кислоти густоти 1,84 г/см3 необхідно для приготування 3л 0,4н розчину?
49. Скільки грамів мідного купоросу CuSO4-5H2O необхідно щоб приготувати 5л 0,1н розчину?
50. До 1л 10%-ного розчину HNO3 густиною 1,054г/см3 додали 2л 2%-ного розчину тієї ж кислоти густиною 1,009 г/см3. Визначити молярну концентрацію одержаного розчину.
51. Складіть молекулярне, повне іонне та скорочене іонне рівняння взаємодії
А) BaCL2 і Na2SO4; ) NaHCO3 і NaOH ) K2SiO3 і HCL.
Під час рішення завдання користуйтесь таблицею розчинності.
52*. А) Pb(NO3) і H2SO4 б) K2CO3 і BaCI2 в) CdS↓ і HCI.
53*. А) AgNO3 і NaCI б) FeCI3 і NaOH в) MgCO3 і HNO
54*. А) Ba(OH2) і Na2SO4 б) Sn(OH)2 і HCI в) K2S і HCI
55*. А) Pb(NO3)2 і K2CrO4 б) CaCI2 і AgNO3 в) K2CO3 і H2SO4
56*. А) H2SO4 і KOН б) Na3PO4 і CaCI2 в) Zn(OH)2↓ і HCI
57*. А) Pb(NO3)2 і KJ б) CuSO4 і NaOH в) CaCO3 і H2SO4
58*. А) FeS і HCI б) NiCI2 і H2S ↑ в) Na2S і H2SO4
59*. А) AIBr3 і AgNO3 б) K2CO3 і HCI в) NiSO4 і Na2S
60*. А) HCI і Ba(OH)2 б) CuCI2 і KOH в) CaCI2 і Na2CO3
* - Дивись умову задачі 51
61. Визначити коефіцієнт в окисно-відновних реакціях. Укажіть окисник, відновник, що окислюється та що відновлюється.
KI+KMnO4+H2SO4 → I2+MnSO4+K2SO+H2O.
Cu2O↓+HNO3 → Cu(NO3)2+NO+H2O.
62**. Na2SO3+K2Cr2O7+H2SO4 → K2SO4+Cr2(SO4)3+Na2SO4+H2O
P+HNO3+H2O → H3PO4+NO
63**. H3AsO3+KMnO4+H2SO4 → H3A5O4+MnSO4+H2O
HI+H2SO4 → H2S↑+I2+H2O
64**. H2S↑+KMnO4+H2SO4 → S+MnSO4+K2SO4+H2O
As+HNO3+H2O → H3AsO4+NO
65**. K2Cr2O7+HCI → CrCI3+CI2+KCI+H2O
H2S↑+HNO3 → H2SO4+NO+H2O.
66**. FeSO4+KCIO3+H2SO4 → Fe(SO4)3+KCI+H2O
H2SO3+HCIO4 → H2SO4+HCI.
67**. H2S↑+K2Cr2O7+H2SO4 → S+Cr(SO4)3+K2SO4+H2O.
FeS↓+HNO3 → Fe(NO3)3+S+NO2↑+H2O
68**. NaNO2+Na2Cr2O7+H2SO4 → NaNO3+Cr2(SO4)3+Na2SO4+H2O.
Ag+H2S↑+O2 → Ag2S+H2O.
69**. FeSO4+K2Cr2O7+H2SO4 → Fe2(SO4)3+Cr2(SO4)3+K2SO4+H2O.
H2S↑+CI2+H2O → H2SO4+HCI.
70**. MnSO4+KMnO4+H2O → MnO2+K2SO4+H2SO4
H2S↑+H2SO3 → S+H2O
**- Дивись умову задачі 61.
71. Запишіть схему гальванічного елемента, у якому електроди виконано з срібла (Ag) та свинцю (Pb), а електролітом є їх солі з концентрацією 1 моль/л. Запишіть рівняння електродних процесів та визначить ЕРС.
72. Складіть схему та запишіть рівняння електродних процесів гальванічного елемента, в якому електроди виконано з міді (Cu) та кадмію (Cd), а електроліти-їх солі з концентрацією 1 моль/л. Визначити ЕРС елемента.
73. Запишіть схему та рівняння електродних процесів гальванічного елемента, у якому магнієвий (Mg) та кадмієвий (Cd), електроди занурені у розчин їх солі з концентрацією 1 моль/л. Визначити ЕРС елемента.
74. Запишіть схему та рівняння електродних процесів гальванічного елемента, у якому цинковий (Zn) та олов’яний (Sn), електроди занурені у розчин їх солей з концентрацією 1 моль/л. Визначити ЕРС елемента.
75. Складіть схему гальванічного елемента, у якому електроди з кадмію (Cd) та ртуті (Hg). Запишіть електроні рівняння на катоді і на аноді. Визначте ЕРС елемента при стандартних умовах.
76. Складіть схему гальванічного елемента, у якому електроди з цинку (Zn) та алюмінію (Al), а електроліти їх солі концентрації 1 моль/л. Укажіть кадот, анод, реакції на аноді і на катоді, НРС елемента.
77. Складіть схеми двох гальванічних елементів у одному з яких мідь була б катодом, а в другому – анодом. Запишіть рівняння на катоді і на аноді, визначте ЕРС елемента.
78. Складіть схеми двох гальванічних елементів у одному з яких цинк був би катодом а в другому – анодом. Запишіть рівняння на катоді і на аноді, визначте ЕРС елемента.
79. Складіть схеми двох гальванічних елементів у одному з яких залізо було б катодом а в другому – анодом. Запишіть рівняння на катоді і на аноді, визначте ЕРС елемента.
80. Складіть схеми двох гальванічного елемента, у якого електроди з олова (Sn) та срібла (Ag). Укажіть катод, анод, реакцій на аноді та катоді, ЕРС елемента.
81. Запишіть реакції на аноді та катоді при електролізі розчину солі FeSO4з інертними електродами. Визначте маси речовин, що вилучалися на аноді та катоді при силі струму 2А за 10 хвилин.
82. Запишіть реакції на катоді та аноді при електролізі розчину Ni(NO3)2 з інертними електродами. Визначте маси речовин, що вилучалися на електродах при силі струму 5 А за 5 хв.
83. Запишіть реакції на катоді і на аноді при електролізі розчину K2SO4 з інертними електродами. Визначте маси речовин, що вилучалися на електродах при силі струму 4А за 30 хв.
84. Запишіть реакції на катоді і на аноді при електролізі розчину CuCI2 з інертними електродами. Визначте маси речовин, що вилучалися на електродах при силі струму 5А за 5 хв.
85. Запишіть реакції на катоді і на іноді при електролізі розчину CuSO4 з мідним анодом. Визначте масу міді, що вилучалася на катоді при силі струму 3А за 30 хв.
86. Електроліз розчину AICI3 проводили при силі струму 1А 12 хв. Запишіть реакції на катоді і на аноді і визначте маси речовин, що вилучалися на електродах.
87. Електроліз розчину NaNO3 проводили при силі струму 2А 10 хвилин. Запишіть реакції на катоді і на аноді і визначте маси речовин, що вилучалися на електродах.
88. Електроліз розчину AI(NO3)3 проводили при силі струму 2.5А 15 хвилин. Запишіть реакції на катоді і на аноді і визначте маси речовин, що вилучалися на електродах.
89. Електроліз розчину NiSO3 з нікелевим анодом. Запишіть реакції на катоді і на аноді і визначте масу розчинного нікелю, якщо процес проводили при силі струму 3А за 10 хвилин.
90. Електроліз розчину ZnSO4 проводили 5 хв при силі струму 5А. Запишіть реакції на катоді і на аноді , якщо електроди інертні. Визначте маси речовин, що вилучалися на електродах.
91. Залізна деталь покрита свинцем. Яке це покриття – катодне чи анодне?
Запишіть електроні рівняння на катоді при корозії у вологому повітрі, якщо покриття пошкоджене.
92. Як проходить атмосферна корозія алюмінієвого проводу, якщо він знаходиться у контакті з залізом. Запишіть електронні рівняння катодного та анодного процесів.
93. Визначте протектор у парі Fe-Co. Запишіть рівняння реакції на катоді при атмосферній корозії.
94. Залізо покрито сріблом. Яке це покриття – катодне чи анодне? Запишіть реакції на катоді і на аноді при корозії у кислому середовищі, якщо покриття пошкоджене.
95. Срібний виріб покритий золотом Ag-Au. Яке це покриття - катодне чи анодне? Запишіть електронні рівняння якщо покриття пошкоджене. У розчину соляної кислоти, якщо покриття пошкоджене.
96. Залізний виріб покритий нікелем. Яке це покриття - катодне чи анодне? Запишіть електронні рівняння реакції на катоді і аноді при корозії у вологому повітрі, якщо покриття пошкоджене.
97. Контактна корозія Fe-Mg. Реакції на катоді і аноді у вологому повітрі. Що з протектором?
98. Визначте протектор у парі Mg-AI. Запишіть реакції на катоді і аноді при атмосферній корозії.
99. Контактна корозія алюмінію, покритого мідію, якщо мідне покриття порушено. Запишіть реакції на катоді і аноді у вологому повітрі.
100. Визначте протектор у парі Fe-Zn. Запишіть реакції на катоді і на аноді при атмосферній корозії.
