
- •05201051003 Мазепа
- •1Тцр — полимеразная цепная реакция
- •Внедрение в практику.
- •1.2.2 Диагностика хеликобактерной инфекции
- •2.3. Диагностика парентеральных вирусных гепатитов. Парентеральные вирусные гепатиты - группа инфекционных
- •1.3 Внедрение и использование пцр в практическом здравоохранении Российской Федерации.
- •2.Собственные исследования
- •2.1. Материалы и методы
- •2.1.2. Методы.
- •2,5 Мкл праймеров по 5-15 пмоль/мл каждого; 5 мкл 10-кратного реакционного буфера 2,5 мкл dNtp по 1мМ каждого; 1 мкл Tag-пoлимepaзы 0,5 е.А. 29 мкл деионизованной воды
- •1. Готовили реакционную смесь для амплификации из расчета на 1 пробу: буфер — Змкл, аЫтр - 3 мкл,
- •2.2.1.1. Выбор приборов для проведения пцр и фиксирования результатов.
- •2, 3, 4, 5, 6, 7, 8, 9 - Фрагменты гена шигоподобного токсина vt1.
- •2.2.2.4, Алгоритм использования метода пнр в диагностике бактериальных оки
- •Первичное обследование лиЦ—
- •2.2.3.2. Сравнительный анализ результатов детекции h.Pylori. Полученных традиционными и молекулярно-биологическими методами.
- •2.2.3.3. Изучение распространенности h.Pylori у больных с различными формами гастродуоденальной патологии
- •Тип патологии
- •2.2.4.4. Изучение вероятности вертикального пути передачи вгс и вгв.
- •Положительный результат
- •Продолжение лечения
- •Отрицательный результат
- •Назначение лечения
- •Назначение лечения
- •Отрицательный результат Продолжение лечения
- •2.2.5.1. Место пцр в общей системе методов диагностики нуги.
- •Выявлены u.Urealyticuym m hominis
- •IПри необходимости выявление возбудителей в отдельных субстратах
- •Список источников литературы.
- •307 307Приложение 1
- •310Частота выявления возбудителей нуги по сезонам 1998-2008 годов.
2.2.3.3. Изучение распространенности h.Pylori у больных с различными формами гастродуоденальной патологии
Поскольку до появления ПЦР тест-систем, выявление Н. pylori у больных с гастродуоденальной патологией г. Нижнего Новгорода проводилось недостаточно специфичными методами, на наш взгляд представлялось важным получить более объективную информацию о распространении данного инфекционного агента. Для этого нами проведено обследование больных разных возрастных групп с различными типами гастродуоденальной патологии методом ПЦР.
Одной из актуальных проблем хеликобактерной инфекции является вопрос о детской инфицированности Н. pylori. Для его изучения проведено ПЦР обследование детей с различными заболеваниями органов пищеварительной системы - пациентов ФГУ «Нижегородский НИИ детской гастроэнтерологии Росмедтехнологий». Материалом для выявления Н. pylori у детей являлся желудочный сок.
При обследовании 285 детей в возрасте от 8 до 17 лет Н. pylori выявлен у 168 человек, что составило 58,9±2,9%. Полученные нами данные о частоте выявления Н. pylori среди детей с гастродуоденальной патологией согласуются с результатами целого ряда отечественных исследователей [13, 36, 93], которые свидетельствуют о достаточно высокой инфицированности (60-70%) детского населения в России.
Частота выявления Н. pylori у детей разных возрастов и при различных типах гастродуоденальной патологии представлена на рисунках 15 и 16
.45
□ Всего
обследовано
■
НР+
8л
9л
Юл
11л 12л 13л 14л 15л 16л возраст
Рис. 15. Частота выявления Helicobacter pylori у детей с гастродуоденальной патологией в разных возрастных группах; «НР+» - Н. pylori выявлен
|
|
|
|
о HPf,% | ||||||||
|
|
|
|
|
| |||||||
|
|
|
|
|
|
|
| |||||
|
|
|
|
|
| |||||||
|
|
|
|
|
| |||||||
|
|
|
|
|
| |||||||
|
|
|
|
|
| |||||||
ХГД ХЭГД ЯБДПК
ЯБДПКХГДТип патологии
Рис. 16 Частота выявления Helicobacter pylori у детей с различными типами гастродуоденальной патологии
«НР+» - Н. pylori выявлен
ХГД - хронический гастродуоденит
ХЭГД - хронический эрозивный гастродуоденит
ЯБДПК - язвенная болезнь ДНК
ЯБДПК ХГД - язвенная болезнь ДНК на фоне хронического гастродуоденит
а
Высокая частота выявления возбудителя хеликобактерной инфекции у детей в возрасте 8 лет (57,1± 13,2%), позволяет говорить о ранней инфицированности населения нашей страны. Подобная ситуация характерна для стран с развивающейся экономикой, низким социально-экономическим уровнем, что наряду с несоблюдением санитарно-гигиенических правил приводит к ранним клиническим проявлениям хеликобактерной инфекции [93].
Установлены следующие показатели инфицированности Н.ру1оп детей с различными типами гастродуоденальных заболеваний (рис. 16): -при хроническом гастродуодените — 60,3±4,9%; -при хроническом эрозивном гастродуодените - 45,7±5,0%; -при язвенной болезни двенадцатиперстной кишки — 71,6±6,4%;
I
НР-
I
НР+
гба
гдба гса
рдл
ядпк гкж упядк упяж
гдса
эг эгд яж эб
тип
патологии
Рис.
17. Частота выявления Helicobacter
pylori методом
ПЦР при различных типах гастродуоденальной
патологией среди взрослого населения
«НР+»
- Н. pylori
выявлен,
«НР-» - Н. pylori
не
выявлен,
ГДБА
- гастродуоденнт без признаков атрофии;
ГСА - гастрит с признаками атрофии;
ГДСА -гастродуоденнт с признаками
атрофии; ЭГ - эрозивный гастрит; ЭГД -
эрозивный
гастродуоденнт; ЯЖ — язва желудка; ЭБ
- эрозивный бульбит; РДЛ -
рубцовая
деформация луковицы двенадцатиперстной
кишки; ЯДПК - язва двендцатиперстной
кишки; ГКЖ- гастрит культи желудка;
УПЯДК - состояние после ушивания язвы
двенадцатиперстной кишки; УПЯЖ -
состояние поле ушивания язвы желудка.
100% 90% 80% 70% 60% 50% 40% 30% 20% f- 10% 0
%
При всех типах гастродуоденальной патологии наблюдается высокая инфицированность больных H.pylori, что свидетельствует о способности этого микроорганизма провоцировать развитие и осложнять течение различных форм гастродуоденальных заболеваний. Особо следует отметить 100%-ную частоту выявления H.pylori у лиц с резекцией желудка (20 человек) и ушиванием перфоративной язвы (46 человек). Эти данные позволяют сделать вывод о недостаточной эффективности эррадикации H.pylori только при хирургических вмешательствах и необходимости проведения своевременной специфической антибактериальной терапии.
Полученная информация о распространенности Н. pylori среди больных с различными типами гастродуоденальной патологии объективна, согласуется с имеющимися отечественными и зарубежными литературными данными по распространенности H.pylori, что свидетельствует о достаточно высокой специфичности использованной ПЦР тест-системы [4, 32, 73, 214, 356].
2.2.3.4. Использование полуколичественного варианта ПЦР-детекции H.pylori для оценки эффективности антихеликобактерной терапии.
Большинство существующих методов диагностики не позволяют осуществлять ранний контроль эффективности антихеликобактерной терапии. Для контроля эффективности эрадикации H.pylori нами разработан полу количественный вариант ПЦР, позволяющий оценивать изменения уровня обсемененности слизистых H.pylori до и после лечения.
Ранее проведенные исследования показали, что наиболее интегративным и информативным субстратом для ПЦР-детекции H.pylori является утренняя тощаковая порция желудочного сока. Испытание метода проведено при обследовании 46 человек - мужчин в возрасте 17-58 лет, находящихся на реабилитации после ушивания перфоративной язвы желудка или двенадцатиперстной кишки в стационаре ООО «Санаторий им. ВЦСПС» [33].
Метод базируется на ПЦР детекции хеликобактера в десятикратных разведениях ДНК, выделенной из проб желудочного сока. Предварительно, до лечения, H.pylori был выявлен в желудочном соке у 40 человек (78,3±6,1% больных). После проведенного лечения они были повторно обследованы. Желудочный сок отбирали через 1-2 недели после окончания терапии. У 18 человек (45±7,9%) H.pylori не выявлялся, у остальных 22 пациентов (55±7,9%) Н. pylori был обнаружен и после лечения. ДНК из проб этих пациентов (взятых до и после лечения) разводили в 10, 100, 1000 и в каждом из разведений проводили ПЦР-детекцию H.pylori. Сравнивали электрофореграммы образцов, полученных до и после лечения. При этом в 13 случаях (32,5±7,4%) не наблюдалось изменений концентрации возбудителя в пробах, забранных до и после лечения. H.pylori выявлен во всех разведениях (рис 18, 19.), что свидетельствовало о необходимости продолжения лечения с использованием других схем эррадикации.
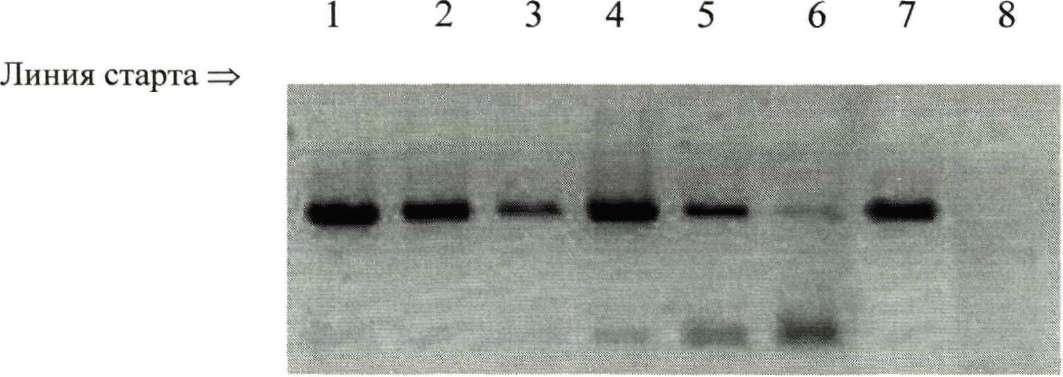
10"' Ю"2 10"3 10"1 10"2 10"3 К+ К- до лечения после лечения
Рис. 18. Электрофореграмма продуктов ПЦР разведений ДНК Helicobacter pylori из проб желудочного сока
У 9 пациентов (22,5±6,6% ) ДНК H.pylori выявлена во всех разведениях до лечения, а после терапии - только в исходной пробе желудочного сока (на электрофореграмме наблюдалось слабое свечение специфического фрагмента - рис. ). Детекция низких концентраций Н.ру1оп может быть объяснена амплификацией ДНК погибшего возбудителя. Такой результат ПЦР рассматривался нами как показатель успешной терапии, что в последствие было подтверждено анализом отдаленных результатов.
1 23456789 10
исх
10"' 10"2
10"3
исх 10"' 10"2
Ю-3
К+ К-
проба проба
до
лечения после лечения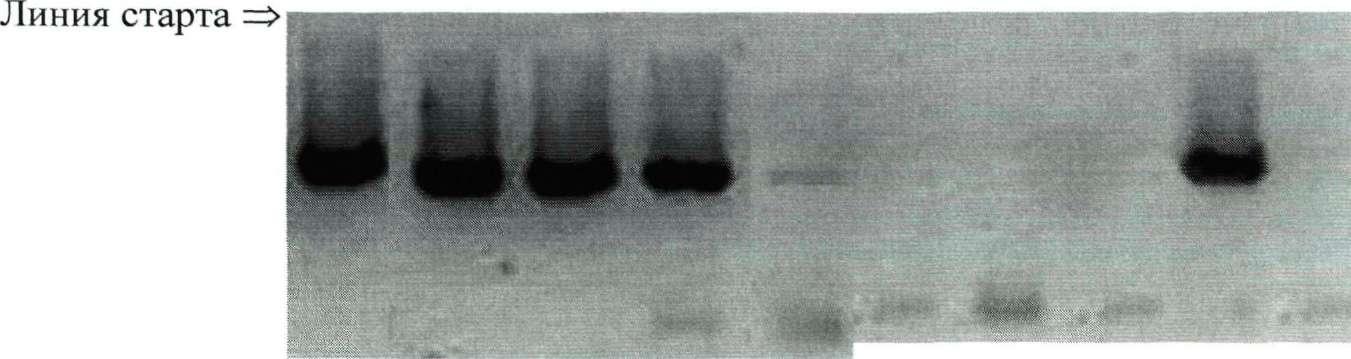
Рис. 19. Электрофореграмма продуктов ПЦР разведений ДНК Helicobacter pylori из проб желудочного сока.
У пациентов с упешной эррадикацией H.pylori (сигнал на электрофореграмме не выявлялся или был слабый для исходной пробы), при проведении контрольной эзофагогастродуоденоскопии наблюдались эндоскопические и клинические улучшения: рубцевание язв, эпителизация эрозий, уменьшение активности гастродуоденита. В течение года больные этой группы отмечали хорошее самочувствие, не обращались за медицинской помощью. В то же время, у трех больных без эффекта эррадикации H.pylori (титр H.pylori до и после лечения одинаков), отказавшихся от повторного курса лечения, через 17-18 месяцев отмечен рецидив язвенной болезни.
Проведенные исследования показали, что наряду с высокой чувствительностью, специфичностью и низкой инвазивностью (за счет исследования желудочного сока) метод ПЦР является информативным при оценке эффективности противохеликобактерной терапии через 1-2 недели после ее окончания. Результаты, полученные с использованием полуколичественного варианта ПЦР-детекции H.pylori, имеют прогностическое значение при оценке предполагаемой успешности проведенного лечения.
Использование ПЦР для определения резистентности H.pylori к атибиотикам-макролидам.
Антибиотики ряда макролидов являются одними из важнейших препаратов, применяемых при лечении гастродуаденальной патологии ассоциированной с хеликобактером. В связи с этим представляло интерес оценить распространение резистентных форм H.pylori в микробной популяции. Устойчивость к антибиотикам определяли с помощью ПЦР тест- системы «Эритропол» (фирма «Литех», г. Москва), выявляющей ген метилазы, которая модифицирует бактериальные рибосомы и делает бактерию устойчивой к макролидам . Исследованы 97 образцов, в которых ранее выявлена ДНК Н. pylori. Устойчивые варианты выявлены в 3 случаях (3,1±1,8%), что свидетельствует о том, что в Нижегородском регионе преобладают штаммы Н. pylori чувствительные к макролидам. Проблем с интерпретацией результатов не возникало. Диагностикум может быть рекомендован для использования в практике.
Изучение возможности использования метода ПЦР для выявления генов факторов патогенности Helicobacter pylori
Способность Н. pylori обусловливать развитие гастродуоденальных заболеваний связывают с наличием у него комплекса факторов патогенности. Наиболее значимыми факторами патогенности Н. pylori являются: уреаза, вакуолизирующий цитотоксин, белки, кодируемые островком патогенности [264]. Одной из задач нашей работы являлась апробация отечественных ПЦР тест-систем для выявления генов факторов патогенности Н. pylori: гена CagA, присутствующего у, так называемых, токсигенных штаммов Н. pylori (тест-система «ДиаГен-Helicobacter» фирма «Лагис», г. Москва) и гена вакуолизирующего цитотоксина VacA (тест-система «Хеликопол VA», фирма «Литех». Москва).
Материалом для исследования служили биоптаты слизистой, желудочный сок, собранные у пациентов с различными формами гастродуоденальной патологии. В ходе работы все пробы были предварительно исследованы на наличие H.pylori ПЦР тест-системой «АмплиСенс-Helicobacter pylori-520». Пробы, в которых хеликобактер был выявлен (п=127), проанализированы на наличие гена CagA - маркера «острова патогенности».
Ген CagA был обнаружен в 97 пробах, что составило 76,4±3,8%. В 30 пробах (23,6±3,8%) ген CagA не выявлен. Было отмечено, что пробы, имевшие слабый сигнал на электрофореграмме при детекции H.pylori давали отрицательный результат при использовании тест-системы на ген CagA. При использовании этой тест-системы также наблюдалось значительное ослабление сигнала на электрофореграмме по сравнению с системой «АмплиСенс-Helicobacter pylori-520». На основании этого мы предположили, что тест-система на маркер «острова патогенности» обладает меньшей чувствительностью, чем тест-система для ПЦР-детекции Н. pylori, базирующаяся на выявлении 16S рРНК гена.
Для подтверждения данного предположения была проведена полуколичественная оценка содержания ДНК Н. pylori в «CagA+» и «CagA-» пробах. Исследования показали, что все «CagA+» пробы, давали положительный результат на наличие гена 16S рРНК при разведении в 10, 100 и 1000 раз. Среди «CagA-» проб, наряду с пробами с низкой концентрацией ДНК Н. pylori (дававшими сигнал на электрофореграмме только с исходной пробой), выявлено 6 проб с высокой концентрацией ДНК. Полученные результаты позволили сделать следующие заключения:
1. Тест-система для выявления гена CagA уступает в чувствительности тест-системе на ген 16S рРНК H.pylori.
Выявления гена CagA целесообразно проводить в пробах с высоким содержанием ДНК H.pylori.
При работе с пробами с низкой концентрацией ДНК возможно получение ложноотрицательного результата.
В дальнейшем при выявлении гена CagA мы исследовали пробы, в которых H.pylori выявлялся при разведении как минимум в 10 раз. Из-за низкой чувствительностьи тест-системы на ген токсигенности в 8 случаях из 127 определить наличие или отсутствие гена CagA не удалось. По остальным параметрам апробированная тест-система для выявления гена CagA зарекомендовала себя удовлетворительно - была удобна в работе, не давала неспецифического синтеза и ложноположительных результатов.
Проведенные исследования выявили широкую распространенность «CagA+»-urraMMOB в популяции H.pylori. Было показано, что такие штаммы чаще колонизируют слизистую оболочку желудка (64,3±4,9% всех «CagA+»- штаммов) и ассоциированы преимущественно с заболеваниями желудка. Большинство CagA-отрицательных вариантов Н. pylori (82±7,0%) выделено от больных с поражением двенадцатиперстной кишки.
Были также проведены испытания ПЦР тест-системы «Хеликопол VA» фирмы «Литех», Москва для выявления и определения аллельного варианта гена вакуолизирующего цитотоксина VacA. Для исследования взяты образцы, содержащие «CagA+» и «CagA-» варианты Н. pylori, (всего 43 «CagA+» и 7 «CagA-» изолятов). Из данных литературы известно, что ген VacA может быть представлен несколькими аллельными вариантами двух вариабельных участков гена (s и ш) [295]. Предполагается, что генотипы H.pylori slml и slm2 имеют максимальный или средний уровень секреции цитотоксина, H.pylori с генотипом s2m2 проявляет незначительную токсическую активность.
После проведения оптимизации состава тест-системы «Хеликопол VA» и программы амплификации (см. раздел 2.2.1. Формирование материальной
базы для проведения исследований) получены следующие данные распространении гена VacA у H.pylori (таблица 18)
Таблица 18
Выявления вариантов Vac А гена с использованием тест тест-системы «Хеликопол VA» у ПЦР-изолятов H.pylori (п=50)
|
Кол-во VacA образцов |
Выявленные варианты гена Vac А | ||||||
|
slml |
slm2 |
s2m2 |
slml/m2 |
sl |
ml |
т2 | |
|
Абс. 33 |
5 |
9 |
1 |
3 |
5 |
1 |
9 |
|
100% |
10,0±5,5 |
18,0±6,7 |
2,0±2,4 |
6,0±4,1 |
10,0±5,2 |
2,0±2,4 |
18,0±6,7 |
Ген VacA выявлен у 33 (66±6,7%) ПЦР-изолятов H.pylori, что совпадает с показателями других исследователей. По данным литературы ген VacA встречается у 50-60% штаммов Н pylori [61, 398].
Из 33 VacA+ проб полная аллельная структура гена Vac А была установлена только у 18 образцов. В 5 случаях был выявлен аллельный вариант slml; в 9 - slm2; в 1 - s2m2. Кроме того, в 3 случаях был обнаружен вариант slml/m2, что позволяет предположить наличие в образце двух штаммов H.pylori с различной структурой гена VacA - slml и slm2 или присутствие возбудителя с гибридным вариантом гена VacA - ml-подобный фрагмент/т2 [295]. В 15 пробах амплифицировался только один из пары исследуемых фрагментов гена VacA (либо т, либо s). В одном случае был определен ml; в 9 - т2; в 5 — sl. Такие результаты расценивались как выявление гена VacA. Значительное количество образцов, в которых не удалось установить полный вариант гена VacA, объясняется низкой чувствительностью тест-системы «Хеликопол VA», которая обусловлена конкуренцией за праймеры и другие компоненты реакционной смеси между специфическими и неспецифическими мишенями, причем конкуренция в
случае праймеров к sl, s2, rn2 аллелям складывается не в пользу специфических фрагментов.
Полученные результаты не позволяют рекомендовать тест-систему «Хеликопол VA» для проведения практических исследований по выявлению токсигенных штаммов Н. pylori. Она сложна в работе и малоэффективна. 2.2.3.7. Изучение гетерогенности нуклеотидных последовательностей фрагментов гена CagA Н. pylori методом гетеродуплексного анализа.
Недоступность бактериологических методов работы с H.pylori большинству практических лечебных учреждений крайне затрудняет проведение эпидемиологических исследований этой инфекции, в частности, изучение штаммового разнообразия H.pylori.
Одной из альтернатив микробиологическому методу для получения внутривидовых характеристик может быть сравнение нуклеотидных последовательностей средневариабельных фрагментов хромосомной ДНК бактерий. Нами проведено исследование возможности дифференцирования ПЦР-изолятов H.pylori на основе сравнения фрагментов гена CagA.
Наиболее простым и доступным методом для оценки вариабельности нуклеотидных последовательностей фрагментов ДНК размером не более 1000 п.н. является метод гетеродуплексного анализа [148]. Он не требует использования дорогостоящих реактивов и оборудования. Метод основан на электрофоретическом разделении денатурированных, а затем ренатурированных комплементарных и частично комплементарных фрагментов ДНК. При гибридизации цепей с неполной гомологией образуются единичные нарушения структуры двойной спирали - петли, шпильки. Такой частично гомологичный фрагмент ДНК носит название гетеродуплекс. Участки нарушения структуры двойной спирали в гетеродуплексе приводят к уменьшению его подвижности при электрофорезе в полиакриламидном геле. Контролем подвижности является фрагмент ДНК, образовавшийся в результате гибридизации полностью комплементарных последовательностей - гомодуплекс [148].
Этот метод и был использован нами для сравнения фрагментов гена CagA десяти ПЦР-изолятов H.pylori (исследовалось 10 проб в которых ранее методом ПЦР установлено наличие H.pylori CagA+). Предварительно была оценена вариабельность фрагментов CagA отдельных изолятов. Для этого ампликоны всех проб была денатурирована, затем ренатурированы и подвергнуты электрофорезу в полиакриламидном геле. Для 9 из 10 образцов на электрофореграмме наблюдали формирование гомодуплексов, что свидетельствовало о полном совпадении нуклеотидных последовательностей фрагментов. Один из изолятов образовывал два фрагмента, следовательно, в нем присутствовали отличающиеся последовательности ДНК, что могло свидетельствовать о наличии двух штаммов Н. pylori с отличающимися нуклеотидными последовательностями гена CagA.
Для получения гетеродуплексов 10 фрагментов гена CagA попарно смешивали во всех возможных комбинациях денатурировали, ренатурировали и анализировали подвижность электрофорезом в полиакриламидном геле. При неполной гомологии исследуемых фрагментов на электрофореграмме наблюдали образование двух полос: нижняя, соответствующая гомодуплексу, образована гибридизацией фрагментов одного из изолятов; верхняя - гетеродуплекс, результат реассоциации фрагментов из разных проб (рис. 20, треки 6 и 7). Если смешанные изоляты имели полностью гомологичные фрагменты, то на электрофореграмме регистрировалась только полоса гомодуплекса (рис 20. треки с 1 по 5 и с 9 по 12). Результаты гетеродуплексного анализа фрагментов гена CagA представлены в таблице 19.wm
frfiltf
1 2 3 4 5 6 7 8 9 10 11 12 K+ Рис. 20. Электрофореграмма гомодуплексов и гетеродуплексов фрагментов гена CagA Helicobacter pylori. Треки 6 и 7 содержат гетеродуплексы
Проведенные исследования показали, что фрагмент гена CagA одной из 10 проб (проба №3) образовывал гетеродуплексы в комбинациях со всеми остальными образцами, что свидетельствует об отличии последовательности нуклеотидов гена CagA этого изолята от остальных. Фрагменты гена CagA восьми проб (пробы №№ 1, 2, 4, 5, 8, 9, 10) в комбинациях между собой гетеродуплексов не давали. По-видимому, они имели высокую степень гомологии. Кроме того, на предварительном этапе выявлена одна проба (№6), которая при ее денатурации и ренатурации формировала гетеродуплекс. Этот вариант также дал гетеродуплексы со всеми другими 9 изолятами. Данный факт, возможно, объясняется высокой степенью гетерогенности гена CagA этого изолята. Но наиболее вероятно, что в данном случае пациент был инфицирован двумя штаммами Н. pylori, несущими отличающиеся по нуклеотидному составу гены CagA
.
|
Таблица 19 №№проб |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1 |
- |
- |
+ |
- |
- |
+ |
- |
- |
- |
- |
|
2 |
|
- |
+ |
- |
- |
+ |
- |
- |
- |
- |
|
3 |
|
|
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
4 |
|
|
|
- |
- |
+ |
- |
- |
- |
- |
|
5 |
|
|
|
|
- |
+ |
- |
- |
- |
- |
|
6 |
|
|
|
|
|
+ |
+ |
+ |
+ |
+ |
|
7 |
|
|
|
|
|
+ |
- |
- |
- |
- |
|
8 |
|
|
|
|
|
+ |
|
- |
- |
- |
|
9 |
|
|
|
|
|
+ |
|
|
- |
- |
|
10 |
|
|
|
|
|
+ |
|
|
|
- |
«+»
- наблюдалось образование гетеродуплекса,
«-» - образования гетеродуплекса не наблюдалось
Результаты
гетеродуплексного анализа фрагмента
гена CagA
H.pylori
.
2.2.3.8. Разработка алгоритма обследования больных с гастродуоденальной патологией на инфицированность H.pylori методом ПНР
Проведенные исследования позволили выработать оптимальный алгоритм обследования больных с гастродуоденальной патологией на инфицированность H.pylori методом ПЦР. Предлагаются следующий порядок исследования:
При поступлении больного в стационар рекомендуется провести анализ пробы биоптата и (или) желудочного сока на присутствие Н. pylori (препарат нуклеиновых кислот, сохраняется при минус 20°С до завершения лечения). При выявлении возбудителя целесообразно проверить его методом ПЦР на устойчивость к антибиотикам-макролидам.
В случае проведения антихеликобактерной терапии, после ее завершения повторяют исследование желудочного сока на наличие H.pylori.
При положительном результате в повторном анализе необходимо проведение полуколичественного исследования образцов желудочного сока, отобранных до и после проведения терапии, а также определение устойчивости H.pylori к макролидам методом ПЦР.
При отсутствии эрадикации (концентрация Н. pylori в желудочном соке после лечения не изменилась или уменьшилась незначительно (в 10, 100 раз) целесообразно повторение терапии с использованием измененной схемы. После завершения второго этапа лечения также проводится контрольный анализ на присутствие H.pylori.
При наличии финансовых и методических возможностей в диагностическую схему может быть внесено следующее изменение. При положительном результате в первичном анализе целесообразно проведение полуколичественного исследования на H.pylori и выявление гена CagA. Результаты титрования и определения токсигенности следует учитывать при назначении антихеликобактерной терапии. Как правило, высокие титры возбудителя (1/100, 1/1000) и наличие гена CagA являются показанием к проведению Нр-эррадикации. При обнаружении хеликобактера только в неразведенном желудочном соке и в его разведении 1/10, а также при отсутствии гена токсигенности CagA и клинических проявлений вопрос о проведении эрадикации H.pylori однозначного решения не имеет. С одной стороны, такое состояние может рассматриваться как носительство, при котором нет необходимости в проведении терапии, а с другой стороны - как начальная, бессимптомная стадия развития хеликобактерной инфекции, и в этой ситуации своевременное профилактическое лечение позволит избежать формирования тяжелой гастродуоденальной патологии.
При
проведении исследований направленных
на совершенствование системы диагностики
хекобактерной инфекции был разработан
комплекс методов базирующихся на
отечественных ПЦР тест-системах
позволяющий проводить прямую детекцию
H.pylori,
контролировать
эффективность противохеликобактерной
терапии, не прибегая к культивированию
получать ряд штаммовых характеристик
H.pylori
(наличие
генов токсигенности, устойчивости к
макролидам, вариабельность фрагментов
генома). В сравнительных испытаниях
комплекс методов показал существенные
преимущества над методами выявления
хеликобактера традиционно используемыми
в отечественном практическом
здравоохранении методами и позволил
получить более объективную информацию
о распространенности H.pylori
среди
больных разных возрастных групп с
различными типами гастродуоденальной
патологии в Нижегородском регионе. На
базе методического комплекса предложен
оптимальный алгоритм обследования
больных с гастродуоденальной патологией
на инфицированность H.pylori
методом
ПЦР (рис. 21).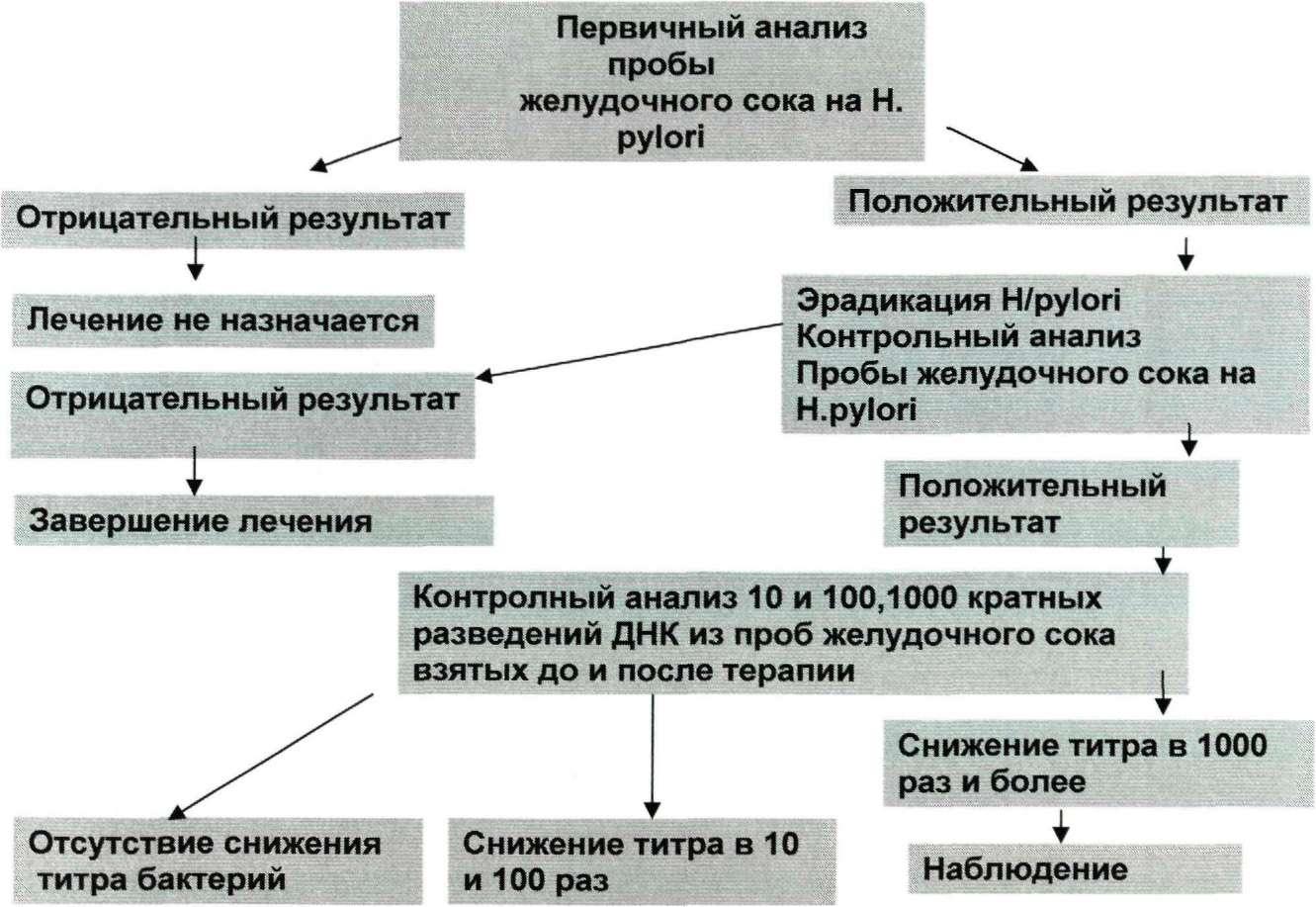
Смена курса лечения. Повторная терапия
I
Контрольный анализ пробы желудочного сока на Н. pylori
Рис. 21. Рекомендуемый алгоритм использования ПЦР для детекции Н.pylori при проведении диагностики и лечения больных с различными типами гастродуоденальной патологии
.2.2.4. Возможные направления использования ПЦР в диагностике парентеральных вирусных гепатитов.
На данном этапе работы проводилось, определение наиболее значимых проблем в диагностике вирусных гепатитов, которые не могут быть решены без использования метода ПЦР и разработка оптимальных алгоритмов обследования больных и контроля эффективности терапии вирусных гепатитов,
2.2.4.1. Сопоставление результатов диагностики ВГВ и ВГС, полученных методами ПЦР и ИФА
Наиболее важным, значимым и часто используемым тестом в диагностике вирусного гепатита В является определение НВз-антигена методом ИФА. Нами проведено ПЦР исследование 765 НВэ - положительных образцов крови. В 79,1±1,5% из них выявлена вирусная ДНК. В пробах, где ДНК обнаружить не удалось, как правило, определялись низкие концентрации НВз-антигена (титры 1/4 - 1/64). В образцах крови с титрами НВз-антигена 1/128 и выше ДНК выявлялась в 100% случаев. Несмотря на более высокую чувствительность, метод ПЦР оказался менее эффективным, чем ИФА—тест на НВБ-антиген. Это может быть объяснено тем, что концентрация НВз-антигена в крови больных намного превышает концентрацию ДНК-содержащих частиц Дейна. Полученные результаты свидетельствуют о нецелесообразности использования метода ПЦР для первичной диагностике вирусного гепатита В.
Для вируса гепатита С к настоящему времени не разработано ИФА тестов, для выявления компонентов вирусной частицы, сопоставимых по чувствительности и эффективности с ПЦР. При диагностике ВГС проводят исследования на наличие антител к одному или нескольким антигенам вируса. Недостатком этого варианта исследования является то, что он не позволяет получить объективную информацию о размножении вируса.
В связи с этим, представляло интерес проанализировать частоту обнаружения вирусной РНК у больных хроническим ВГС. Для этого было проведено ПЦР исследование образцов крови, от пациентов с различными спектрами антител к разным антигенам ВГС. Кроме этого обследованы пациенты с клиническими признаками вирусного гепатита, у которых не обнаружено белковых маркеров ВГВ и ВГС. Полученные результаты представлены в таблице 20.
Таблица 20.
Выявление вирусной РНК у больных хроническим ВГС, имеющих различные классы антител и у пациентов с подозрением на вирусный гепатит.
|
Антитела к антигенам ВГС |
Кол-во обследованных |
Выявлена РНК |
% РНК . позитивных |
|
Cor суммарн. |
1280 |
697 |
54,5±1,4 |
|
Cor IgG |
264 |
135 |
51,1±3,1 |
|
Cor IgM |
326 |
213 |
65,3±2,6 |
|
NS 5 |
284 |
169 |
59,5±2,9 |
|
NS3 4 5 |
240 |
155 |
64,5±3,1 |
|
Cor суммарн. NS 3 4 5 |
129 |
85 |
65,9±4,2 |
|
Cor IgG NS3 4 5 |
107 |
71 |
66,4±4,6 |
|
Cor IgM NS3 4 5 |
113 |
81 |
71,7±4,2 |
|
Cor IgG IgM NS3 4 5 |
68 |
52 |
76,5±6,1 |
|
Антитела не выявлены |
342 |
4 |
1,2±0,6 |
Во всех образцах, содержащих антитела, независимо от их класса, более чем в 51,1% случаев выявлена РНК ВГС. Реже всего она обнаруживалась у пациентов с антителами класса IgG к Cor антигену и суммарными антителами к Cor антигену - 51Д±ЗД - 54,5±1,4%. У больных с антителами класса IgM к Cor антигену и антителами к неструктурным белкам NS3, NS4, NS5 эффективность репликации несколько выше: РНК выявлена в 59,5±2,9 - 65,3±2,6%. При наличии антител нескольких классов, как правило, репликация вируса отмечается чаще. Наивысшая активность вируса (частота выявления РНК ВГС - 76,5±6,1%) наблюдалась у больных, имеющих антитела IgM и IgG к Cor - антигену и антитела к антигенам NS3, NS4, NS5. Полученные результаты согласуются с данными литературы, из которых известно, что неструктурные белки NS3, NS4, NS5 являются активными участниками репликации вирусной РНК [90].
У пациентов, не имеющих антител к ВГС, РНК обнаружена в 1,2±0,6% случаев. Очевидно, в данном случае, выявлено серонегативное окно в процессе развития заболевания. Несмотря на то, что количество больных ВГС в период серонегативного окна невелико, считаем целесообразным и необходимым проведение ПЦР обследования пациентов с клиническими признаками вирусных гепатитов, не имеющих антител к ВГС, поскольку чем раньше установлен диагноз и начато специфическое лечение, тем больше шансов на положительный исход и меньше вероятность хронизации процесса.
2.2.4.2. Активность вирусов при хронических ВГВ и ВГС, возрастные особенности хронических гепатитов В и С, репликация вирусных НК при гепатитах смешанной этиологии.
Представляло интерес исследовать активность вирусов гепатитов С и В у пациентов разных возрастных групп с хронической формой заболевания. Для этого определяли частоту выявления вирусных нуклеиновых кислот у больных, имеющих установленные диагнозы. Данные о частоте выявления вирусной РНК у пациентов разного возраста с хроническим ВГС представлены в таблице 21
.Таблица 21.
Частота выявления вирусной РНК у больных хроническим ВГС различных возрастных групп
|
Возрастная группа |
Обследовано больных |
Содержат РНК ВГС |
%РНК позитивных |
|
1-5 лет * |
359 |
70 |
19,4±2,1 |
|
6-10 лет * |
246 |
74 |
30,2±2,9 |
|
11-15 лет |
477 |
234 |
41,9±2,3 |
|
16-20 лет |
901 |
406 |
45,1±1,7 |
|
21 - 25 лет |
1083 |
555 |
51,2±1,5 |
|
26 - 30 лет |
702 |
351 |
50,0±1,9 |
|
31-35 лет |
442 |
217 |
49,1±2,4 |
|
36 - 40 лет |
322 |
145 |
45,0±2,8 |
|
41 - 45 лет |
300 |
147 |
49,0±2,9 |
|
46 - 50 лет |
210 |
116 |
55,2±3,4 |
|
51-55 лет |
144 |
77 |
53,5±4,2 |
|
56 - 60 лет |
54 |
34 |
63,0±6,5 |
|
61 - 65 лет |
39 |
20 |
51,3±8,0 |
|
66 - 75 лет |
27 |
15 |
55,6±9,5 |
*
- В возрастной группе 1-7
лет наряду с пациентами с диагнозом
хронический ВГС, обследованы дети,
имеющие антитела к ВГС без установленного
диагноза.
В результате установлено, что в группе детей в возрасте от 1 года до 5 лет частота выявления РЕК ВГС не превышала 19,4±2,1%, что достоверно ниже, чем у взрослых (1 > 2,6). У детей от 6 до 10 лет активность репликации увеличивается, она составила 30,2±2,9%, что также достоверно ниже, чем у взрослых (1 > 2,6). В группе 11-ти - 15-ти летних данный показатель превышает 40% и приближается к таковому у взрослых.
Для юношей и взрослых различных возрастов частота обнаружения вирусной РНК колеблется от 45 до 63% и, как правило, превышает 50%
.
Определенной динамики активности вирусного процесса у взрослых больных не выявлено. У более пожилых людей (60 - 75 лет) выраженного снижения или повышения активности репликации ВГС не наблюдалось.
Среди обследованных преобладала группа пациентов от 16 до 30 лет. Представители этих возрастов составили более 50% от общего количества обследованных. Очевидно, это наиболее пораженный ВГС контингент.
Частота
выявления вирусной ДНК у больных
хроническим ВГВ в различных возрастных
группах.
|
Таблица 22. Возрастная группа |
Обследовано больных |
Содержат ДНК ВГВ |
% ДНК позитивных |
|
1-5 лет |
213 |
31 |
14,6±2,4 |
|
6-10 лет |
160 |
76 |
47,5±3,9 |
|
11-15 лет |
268 |
135 |
50,4±3,1 |
|
16-20 лет |
346 |
156 |
45,1±2,7 |
|
21-25 лет |
210 |
100 |
47,1±3,4 |
|
26 - 30 лет |
161 |
77 |
47,8±3,9 |
|
31-35 лет |
97 |
46 |
47,4±5,1 |
|
36 - 40 лет |
87 |
30 |
49,5±5,4 |
|
41 - 45 лет |
90 |
38 |
42,2±5,2 |
|
46 - 50 лет |
51 |
26 |
51,0±7,0 |
|
51-55 лет |
46 |
19 |
41,3±7,3 |
|
56 - 79 лет |
44 |
22 |
50,0±7,3 |
В отличие от больных хроническим ВГС у больных хроническим ВГВ низкая активность репликации наблюдается только в возрастной группе от 1 года до 5 лет - 14,6±2,4%, что достоверно ниже, чем у взрослых (1 > 2,6). У больных других возрастов вирусная ДНК выявляется в 41,3±7,3 - 51,0±7,0% случаев. Динамики активности вирусного процесса в зависимости от возраста больных при хроническом ВГВ не установлено. У детей с 6 лет, у юношей, зрелых людей и стариков показатели частоты выявления вирусной ДНК имеют близкие значения.
В настоящее время имеется группа риска по парентеральным вирусным гепатитам представленная так называемыми "шприцевыми наркоманами". У данного контингента велика вероятность инфицирования разными видами возбудителей гепатита, что связано с многократными внутривенными инъекциями, проводимыми в антисанитарных условиях.
При обследовании больных, инфицированных несколькими видами вирусов, методом ИФА невозможно определить, все ли вирусы активизированы или размножается только один из них. Для получения объективной информации о репликации вирусных НК целесообразно использование ПЦР.
Проведена ПЦР-детекция вирусных НК при гепатитах смешанной этиологии, выявляли НК вирусов, маркеры которых были ранее обнаружены методом ИФА. Исследованы следующие варианты микстов: 1) ВГС + ВГВ; 2) ВГС + ВГС; 3) ВГВ + ВГБ; 4) ВГВ + ВГС + ВГС. Полученные результаты представлены на рисунках 22, 23, 24, 25.
На наличие ДНК ВГВ и РНК ВГС исследованы сыворотки от 1018 больных. В 260 случаях (25,5±1,4%) отмечалась репликация хотя бы одного из вирусов, входящих в ассоциацию. Варианты, в которых выявлялись нуклеиновые кислоты обоих вирусов, составили 8,1±1,7% от числа положительных проб
.
На наличие РНК ВГС и РНК В ГС было обследовано 414 больных. Реликация вирусов, входящих в ассоциацию отмечалась в 153 случаях, что составило 37,4±2,4%. Варианты РНК ВГС+ и РНК ВГС+ выявлены в 29 случаях, что составило 19,0±3,2% от числа положительных проб.
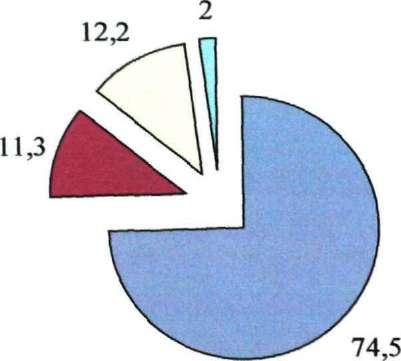
РНКС-днкв- ■ РНК с + днк в-
РНК с - днк в+
РНК с + днк в+
Рис. 22. Частота выявления НК вирусов (в %) при микст гепатите В+С
Рис.23.
Частота выявления НК (в %)вирусов при
микст гепатите С+О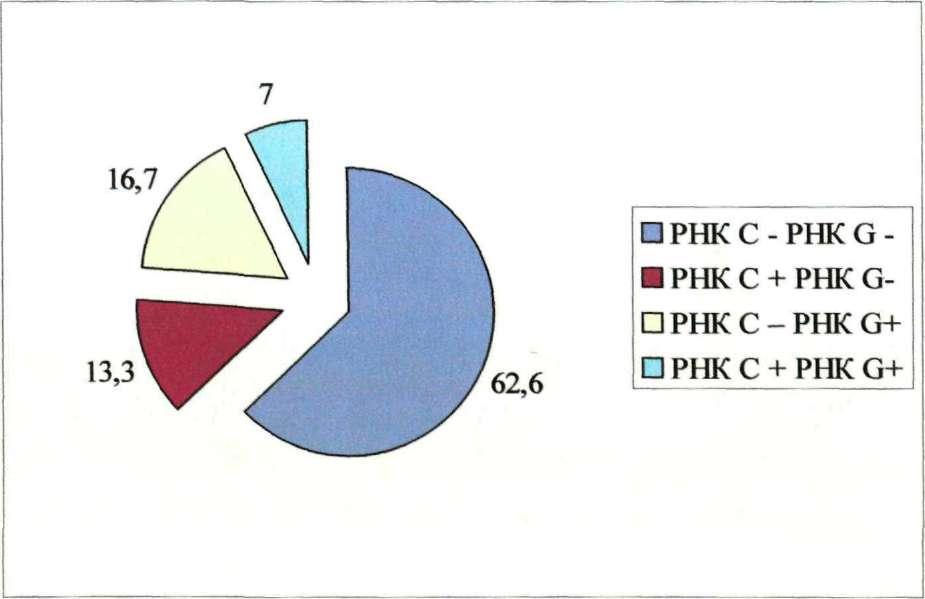
6,9
ДНК
ВГВ-РНК О-
■
ДНКВГВ+РНКО-
ДНК
ВГВ - РНК э +
ДНК
ВГВ + РНК о +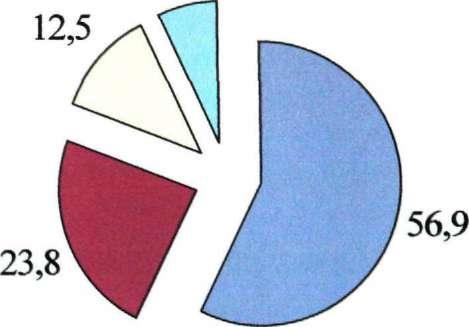
Рис. 24.Частота выявления НК (и %) вирусов при микст гепатите В+Э
вгв- вгс - вгс-
вгв + вгс - вгс -
вгв - вгс + вгс-
вгв - вгс - вгс +
вгв + вгс - вгс +
вгв - вгс + вгс +
Рис. 25.Частота выявления НК (в %) вирусов при микст гепатите В+С+в
1,8
2,7
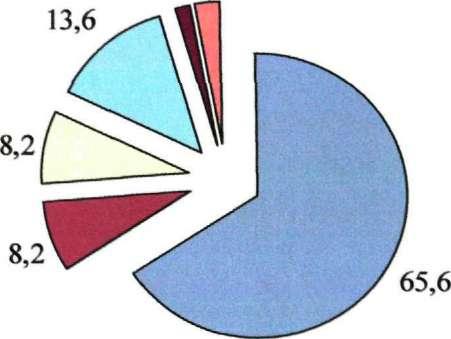
случаях реплицировались ВГВ и ВГв; в 3-х - ВГС и ВГС), сочетаний из трех вирусов не выявлено.
Проведенные исследования позволили выявить ряд особенностей репликации вирусных НК при гепатитах смешанной этиологии:
Интенсивность размножения вирусов при гепатитах смешанной этиологии ниже, чем при моноинфекциях. При вирусных гепатитах В, С, в (моноинфекции) вирусные нуклеиновые кислоты выявлялись более, чем в 45 - 50% случаев. В случае микст-инфекции репликация вирусных НК при гепатитах ВГВ+ВГС отмечалась в 25,5±1,4% случаев, что достоверно ниже, чем при моноинфекциях В и С (1 > 2,6), и максимально составила 43,1 ±3,9% для ассоциации ВГВ и ВГО. Такое ингибирование репликации возможно обусловлено явлением интерференции вирусов в клетке-хозяине.
При смешанном инфицировании у большинства пациентов размножается только один из вирусов ассоциации. Случаи выявления одновременной репликации нуклеиновых кислот двух вирусов составили 19,0±3,2% от числа положительных проб при миксте ВГС+ВГС и 8,1±1,7% от числа положительных проб при ассоциации ВГС+ВГВ, что достоверно ниже частот выявления НК каждого из вирусов по отдельности . Одновременной репликации нуклеиновых кислот трех вирусов не наблюдалось.
Как в ассоциациях из двух, так и трех вирусов не выявлено явного доминирования одного из вирусов над другими. Их НК, как правило, выявлялись с близкими • или практически одинаковыми частотами. Исключение составила ассоциация ВГВ+ВГБ. Репликация ВГВ при смешанной инфекции наблюдалась в 2 раза чаще, чем репликация ВГО. Вероятно это объясняется тем, что ВГО является сателлитом ВГВ, а не самостоятельным полноценным вирусом [90].
Максимальное взаимное подавление наблюдалось в паре неродственных вирусов ВГВ и ВГС. Для двух представителей семейства Иаумпс1а ВГС и ВГС этот процесс выражен в меньшей степени - их
суммарная репликативная активность их РНК на 12% выше, чем в ассоциации ВГВ и ВГС, а совместная репликация их РНК составила 19,0±3,2%, что является максимальным показателем одновременного размножения двух вирусов среди всех вариантов парных ассоциаций. При микст инфекции ВГВ+ВГО, несмотря на явное доминирование ВГВ суммарная репликативная активность составила 43,1 ±3,9%, а совместная репликация нуклеиновых кислот этих вирусов - 15,9±4,1%. 2.2.4.3. Изучение распространения ВГС ведущих генотипов в Нижегородском регионе.
Использование в практических исследованиях мультиплексной ПЦР тест-системы для генотипирования ВГС разработки и производства ФГУН «ЦНИИЭ Роспотребнадзора» позволило изучить распространение в Нижегородском регионе 4 основных генотипа вируса гепатита С - 1а, 1Ь, 2а, За. Эти генотипы доминируют на Европейском континенте и составляют суммарно от 86,7% до 97,8% всех выявляемых вариантов вируса. В таблице 23 представлены данные о частоте их выявления в Нижнем Новгороде и на ряде других территорий Российской Федерации.
Таблица 23
Выявление доминирующих генотипов вируса гепатита С на территориях Российской Федерации
|
Регион |
Генотипы | |||
|
1Ь |
1а |
2 |
За | |
|
Москва и область |
50,4% |
3,6% |
8,3% |
35,3% |
|
Волгоград |
34,5% |
0,7% |
10,3% |
41,2% |
|
Екатеринбург |
41% |
- |
9,8% |
41% |
|
Казань |
55,4% |
2,1% |
6,6% |
33,7% |
|
Саратов |
42,5% |
5,0% |
10,0% |
40,0% |
|
Нижний Новгород |
52,2±1,5% |
0,7±0,2% |
2,4±0,4% |
48,1±1,5% |
(По Нижнему Новгороду п=1160
)
Наиболее распространенными оказались генотипы 1Ь и За. Преобладает генотип 1Ь, но имеется тенденция к смене доминирования на ряде территорий (Екатеринбург, Саратов). Генотип За встречается практически также как и 1Ь, а в Волгограде даже чаще, чем генотип 1Ь. Генотипы 2 и 1а встречаются существенно реже на всех территориях Российской Федерации, представленных в таблице 25, особенно ярко это выражено в Нижнем Новгороде. Генотип 1а редко встречается также в Екатеринбурге и Волгограде.
Выявление
доминирующих генотипов ВГС на территории
Нижнего Новгорода и Нижегородской
области за период 2002-2006 гг.
|
Таблица 24. Период исследования |
Частота выявления генотипов в % | |||
|
1Ь |
За |
2 |
1а | |
|
2001 г. (п=119) |
52,1±4,6 |
48,7±4,6 |
0,8±0,8 |
- |
|
2002 г. (п=198) |
52,5±3,5 |
46,5±3,5 |
2,0±1,0 |
- |
|
2003 г. (п=192) |
48,4±3,6 |
51,6±3,6 |
1,6±0,9 |
- |
|
2004 г. (п=221) |
54,3±3,4 |
46,2±3,4 |
3,6±1,3 |
0,5±0,5 |
|
2005 г. (п=289) |
54,2±2,9 |
49,5±2,9 |
2,7±1,0 |
2,1±0,8 |
|
2006 г. (п=141) |
51,8±2,9 |
46,1±4,2 |
2Д±1,2 |
0,7±0,7 |
|
Всего (п—1160) |
52,3±1,5 |
48,2±1,5 |
2,4±0,4 |
0,7±0,2 |
Как следует из результатов, представленных в таблице, существенных изменений в распространении генотипов 1Ь и За за последние 5 лет н
е
происходило. В 2001, 2002, 2003, 2005 и 2006 гг. они выявлялись в 48,4±3,6- 54,3% и 46,1-51,6±3,6% случаев соответственно (разница не достоверна 1 < 2,6). Исключение составил 2004 г., когда генотип За обнаруживался чаще, чем генотип 1Ь.
Установлено, что за последние годы чаще стали выявляться вирусы генотипа 1а. Этот генотип не был зарегистрирован в течение первых трех лет наблюдения, а в 2005 году вирусы генотипа 1а были обнаружены в 6 случаях (2,1±0,8%). Вирусы генотипа 2 стабильно обнаруживались каждый год, но частота их выявления была невелика и колебалась от 0,8±0,8 до 3,6±1,3%.
Выявление
ассоциаций разных генотипов ВГС за
период 2001-2005 гг.
|
Таблица 25 Период |
Тип |
Частота выявления | |
|
исследования |
ассоциации |
В абс.ч. |
В% |
|
2001г. (п=119) |
1Ь За |
2 |
1,7±1,2 |
|
2002г. (п=198) |
1Ь За |
2 |
1,0±0,7 |
|
2003г. (п=192) |
1Ь За |
о |
1,6±0,9 |
|
2004г. (п=221) |
1Ь За |
9 |
4,1±1,3 |
|
|
1а 1Ь |
1 |
0,5±0,4 |
|
2005г. (п=289) |
1Ь За |
18 |
6,2±1,4 |
|
|
1а 1Ь |
1 |
0.35±0,3 |
|
|
1Ъ2 |
2 |
0,7±0,5 |
|
|
1а 2 |
2 |
0,7±0,5 |
|
Всего (п=1019) |
|
40 |
3,9±0,6 |
За период наблюдений 2001-2003 гг. ассоциации были представлены одним вариантом - комбинацией ВГС двух ведущих генотипов 1Ь и За и частота их выявления не превышала 1,7±1,2%. В 2004 г. ассоциации составили 4,6±1,4% и были представлены 2 видами, к варианту 1Ь За добавился вариант 1а и 1Ь. К 2005 году частота выявления ассоциаций ВГС разных генотипов достигла 8±1,6% и зарегистрировано 4 типа ассоциаций: 1Ь За; la lb; 1Ь 2; 1а 2. Возрастание частоты выявления ассоциаций ВГС разных генотипов отмечено рядом отечественных исследователей [62, 85]
Появление и увеличение количества микст-инфекций ВГС, по- видимому, связано с неоднократным инфицированием больных, такое явление возможно в среде «шприцевых» наркоманов.
Результаты анализа распространения доминирующих генотипов ВГС в Нижегородском регионе показали практическую значимость исследований с использованием мультиплексной ПЦР тест-системы. Высокая частота выявления вирусов генотипа lb и вероятность реинфекции ими отдельных контингентов больных, у которых ранее выявлены ВГС других генотипов, свидетельствует не только о необходимости включения теста по определению генотипа в первичное обследование пациентов перед назначением лечения, но и о целесообразности повторного определения генотипа в случае, если в период успешного лечение неожиданно происходит активизация репликации вируса.
