
Салицилат натрия
.doc-
Общие сведения.
Формула:
С6Н4(ОН)СООNa
Натрия салицилат ( Natrii salicylas ). Натриевая соль орто -оксибензойной кислоты.
Белый кристаллический порошок или мелкие чешуйки без запаха, сладковато-соленого вкуса. Очень легко растворим в воде (1:1), растворим в спирте (1:6). Растворы (pН 6,0 - 7,0) стерилизуют при + 100 С в течение 30 мин.
-
Получение.
Растворяется 40г. гидроксида натрия (или пищевой соды 84г.) в 160мл. воды, нагреваем полученный раствор до 70-80оС и малыми порциями прибавляем 140г. салициловой кислоты. Греем ещё 10-15мин. после добавления всей кислоты, и упариваем при температуре 70-80оС до появления кристаллической плёнки. Охлаждаем и выпавшие кристаллы отсасываем на воронке Бюхнера, промываем 3 раз по 15мл. ледяной водой. Сушим при температуре 100-110оС. До получения сыпучей массы.Выход 130-120г.
-
Качественный анализ.
-
Аналитические реакции на катион натрия.
-
1. Реакция с ацетатом диоксоуран(VI)цинка Zn(UO2)3(CH3COO)8 c образованием жёлтого кристаллического осадка (фармакопейная реакция - ГФ) или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте (МКС). Для повышения чувствительности реакции следует нагреть исследуемую смесь на предметном стекле.
NaCl
+ Zn(UO2)3(CH3COO)8
+ CH3COOН
+ 9 H2O
![]()
NaZn(UO2)3(CH3COO)9 · 9 H2O + HCl
Мешающие ионы: избыток ионов K+, катионы тяжёлых металлов (Hg22+, Hg2+, Sn2+, Sb3+, Bi3+, Fe3+ и др.). Реакция используется как дробная после удаления мешающих катионов.
2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ).
3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС).
Error: Reference source not found
Реакция используется как дробная только в отсутствие мешающих ионов (K+, NH4+, Ag+).
4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах.
NaCl
+ K[Sb(OH)6]
![]() Na[Sb(OH)6]
+ KCl
Na[Sb(OH)6]
+ KCl
Условия проведения реакции: а) достаточная концентрация Na+; б) нейтральная реакция раствора; в) проведение реакции на холоду; г) потирание стеклянной палочкой о стенку пробирки. Мешающие ионы: NH4+, Mg2+ и др.
В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3.
K[Sb(OH)6]
+ HCl
![]() KCl + H3SbO4
+
2 H2O
KCl + H3SbO4
+
2 H2O
H3SbO4
![]() HSbO3
+ H2O
HSbO3
+ H2O
-
Аналитические реакции на салицилат-ион.
-
С хлоридом железа(III) (ГФ, МФ) с образованием окрашенного комплексного соединения.
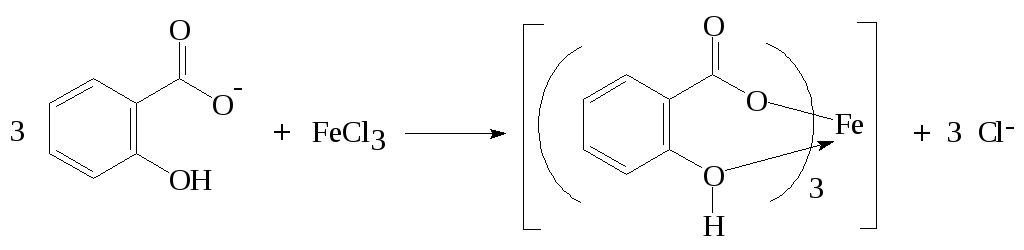
Методика: к нейтральному раствору, содержащему салицилат-ионы, прибавляют раствор хлорида железа(III), появляется интенсивное синефиолетовое или красно-фиолетовое окрашивание. Цвет сохраняется при добавлении разведённой уксусной кислоты, но исчезает при прибавлении разведённой хлороводородной кислоты с образованием белого кристаллического осадка салициловой кислоты.
-
С сульфатом меди(II) с образованием растворимой в воде медной соли зелёного цвета.
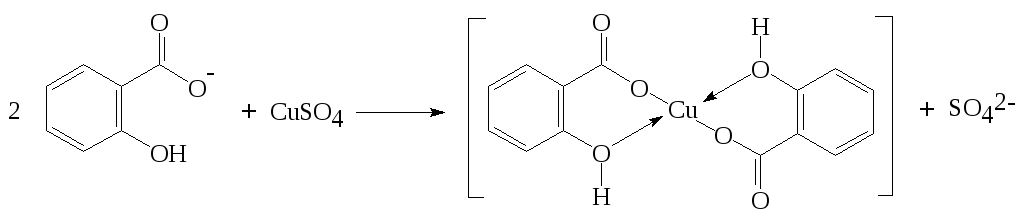
Методика: к 2 см3 нейтрального раствора салицилата прибавляют 0,2 см3 раствора сульфата меди(II).
-
Количественный анализ.
-
Определение массовой доли бензоата (салицилата) натрия в растворе ацидиметрическим методом (вариант прямого титрования).
-
Определение основано на нейтрализации бензоата (салицилата) натрия (соли сильного основания и слабой кислоты) сильной минеральной кислотой.
C6H5COONa + HCl = C6H5COOH + NaCl
C6H4(OH)COONa + HCl = C6H4(OH)COOH + NaCl
М(C6H5COONa) = 144,12 г/моль
М(C6H4(OH)COONa) = 161,01 г/моль
Методика: Определённый объём раствора бензоата натрия помещают в колбу для титрования, прибавляют 2 капли раствора метилового оранжевого, 1 см3 эфира и титруют 0,1 М раствором хлороводородной кислоты до розовой окраски водного слоя.
Методика: Определённый объём раствора салицилата натрия помещают в колбу для титрования, прибавляют 2 капли раствора метилового оранжевого, 1 каплю метиленовой сини и титруют 0,1 М раствором хлороводородной кислоты до сиренево-фиолетовой окраски раствора.
-
Применение.
Действующее вещество (МНН) Натрия салицилат (Sodium salicylate)
Применение: Острый ревматизм, экссудативный плеврит, неревматический артрит, подагра, невралгия, миалгия, ревматический эндокардит, миокардит.
-
Список литературы.
-
Лурье Ю.Ю. Справочник по аналитической химии. Москва, 1972;
-
Методическое указание «Инструментальные методы анализа», Пермь, 2004;
-
Методическое указание «Качественный химический анализ», Пермь, 2003;
-
Методическое указание «Количественный химический анализ», Пермь, 2004;
-
Рабинович В.А., Хавин З.Я. Краткий химический справочник, Ленинград, 1991;;
-
«Форум пиротехников»// www.pirotehnika.ruhelp.com//.
