
Нитрат натрия
.doc-
Общие сведения.
Формула:
NaNO3
Натриевая селитра, Натронная селитра, Чилийская селитра
Нитрат натрия (чилийская селитра) NaNO3. Бесцветные ромбоэдрические или тригональные кристаллы. Кристаллическая решетка кальцита СаСО3. tпл=308°С, плотность равна 2,26 г/см3. Гигроскопичен, хорошо растворяется в воде. Проявляет окислительные свойства. Молярная электропроводность при бесконечном разведении при 25оС равна 121,56 Cм.см2/моль.
|
|
-466,70 кДж/моль; |
|
-365,97 кДж/моль; |
|
116,50 Дж/моль.K. |
Обычно есть примеси галогенидов, основные месторождения в Чили (провинции Тарапака и Антофагаста). Цвет белый, желтоватый, красно-коричневый, серый. Твёрдость по шкале Мооса 1,5—2;. Плотность 2,3 г/см³. Образуется в основном за счёт вулканической деятельности или окисления азота. Гигроскопична.
-
Получение.
Получают взаимодействием гидроксида или карбоната натрия с азотной кислотой, а также пропусканием смеси оксидов азота через раствор гидроксида или карбоната натрия.
-
Качественный анализ.
-
Аналитические реакции на катион натрия.
-
1. Реакция с ацетатом диоксоуран(VI)цинка Zn(UO2)3(CH3COO)8 c образованием жёлтого кристаллического осадка (фармакопейная реакция - ГФ) или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте (МКС). Для повышения чувствительности реакции следует нагреть исследуемую смесь на предметном стекле.
NaCl
+ Zn(UO2)3(CH3COO)8
+ CH3COOН
+ 9 H2O
![]()
NaZn(UO2)3(CH3COO)9 · 9 H2O + HCl
Мешающие ионы: избыток ионов K+, катионы тяжёлых металлов (Hg22+, Hg2+, Sn2+, Sb3+, Bi3+, Fe3+ и др.). Реакция используется как дробная после удаления мешающих катионов.
2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ).
3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС).
Error: Reference source not found
Реакция используется как дробная только в отсутствие мешающих ионов (K+, NH4+, Ag+).
4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах.
NaCl
+ K[Sb(OH)6]
![]() Na[Sb(OH)6]
+ KCl
Na[Sb(OH)6]
+ KCl
Условия проведения реакции: а) достаточная концентрация Na+; б) нейтральная реакция раствора; в) проведение реакции на холоду; г) потирание стеклянной палочкой о стенку пробирки. Мешающие ионы: NH4+, Mg2+ и др.
В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3.
K[Sb(OH)6]
+ HCl
![]() KCl + H3SbO4
+
2 H2O
KCl + H3SbO4
+
2 H2O
H3SbO4
![]() HSbO3
+ H2O
HSbO3
+ H2O
-
Аналитические реакции на нитрат-ион.
1. С дифениламином в среде концентрированной H2SO4 (ГФ).
Дифениламин окисляется азотной кислотой вначале в бесцветный N,N-дифенилбензидин, затем в "дифенилбензидин фиолетовый":
Методика: в сухую фарфоровую чашку (тигель) помещают кристаллик дифениламина, прибавляют несколько капель концентрированной H2SO4 и 1-2 капли раствора, содержащего нитрат-ион. Появляется интенсивная синяя окраска. Реакция чувствительна, но неспецифична. Мешают окислители - NO2-, Fe3+, MnO4- и т.д., и восстановители – S2- , SO32- , S2O32-, I- и др.
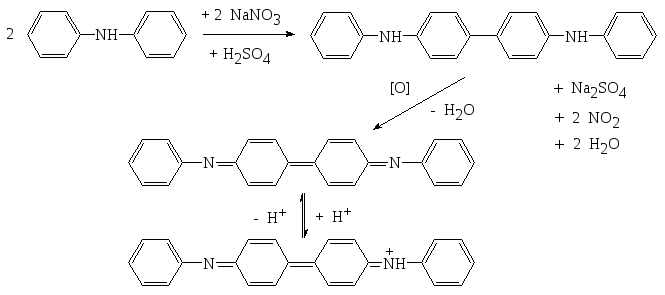
2. С металлической медью в среде концентрированной H2SO4 (ГФ).
2
NaNO3
+ Cu + 2 H2SO4
![]() CuSO4
+ 2 NO2
+ Na2SO4
+ 2 H2O
CuSO4
+ 2 NO2
+ Na2SO4
+ 2 H2O
Методика: к сухому веществу (0,002-0,005 г нитрата-иона) прибавляют по 2-3 капли воды и концентрированной серной кислоты, кусочек металлической меди и нагревают, выделяются бурые пары оксида азота(IV).
3. С сульфатом железа(II).
2
NaNO3
+ 6 FeSO4
+ 4 H2SO4
![]() 3 Fe2(SO4)3
+ Na2SO4
+ 4 H2O
+ 2 NO
3 Fe2(SO4)3
+ Na2SO4
+ 4 H2O
+ 2 NO
NO
+ FeSO4
![]() [Fe(NO)]SO4
[Fe(NO)]SO4
Методика: к 2 каплям испытуемого раствора нитрата на холоду прибавляют кристаллик FeSO4 и осторожно по стенке пробирки концентрированную H2SO4. Наблюдают коричневое кольцо вследствие образования сульфата нитрозожелеза(II) [Fe(NO)]SO4. Мешают I-, Br-, а также анионы-окислители.
4.С антипирином в среде концентрированной серной кислоты с образованием нитроантипирина красного цвета.

Методика: в сухую фарфоровую чашку помещают 2 капли исследуемого раствора, добавляют 1 каплю 5% водного раствора антипирина и 4-8 капель концентрированной серной кислоты, осторожно перемешивают. Наблюдают интенсивное красное окрашивание, последующее разбавление водой приводит к переходу красной окраски в карминово-красную.
5. С раствором KMnO4 в сернокислой среде (ГФ). Наблюдают неисчезающую розовую окраску раствора (в отличие от NO2- аниона, обесцвечивающего раствор KMnO4).
Обнаружению NO3--иона реакциями с дифениламином и сульфатом железа(II) мешает присутствие NO2--иона, поэтому необходимо знать способы разрушения нитрит-ионов.
-
Количественный анализ.
-
Фотоколориметрия.
-
Определение нитрат-ионов осуществляли электрофотоколориметрическим методом при длине волны l = 540 нм после реакции исследуемых растворов с сульфаниловой кислотой [6]. Для количественного определения нитрат-ионов использовали их способность восстанавливаться на ртутной капле при потенциале –1,75 … –1,78 В на фоне 20 %-го водного хлорида кальция [5]. Определение проводили методом калибровочных линий в интервале концентраций 0,001 … 0,020 мг/мл. На анализ отбирали 0,05 … 0,10 мл исследуемых растворов и после нейтрализации (щелочью или кислотой в зависимости от рН) объем доводили до 20 мл 20 %-м хлоридом кальция.
После продувки растворов гелием записывали полярограммы на полярографе ПУ-1 в интервале от –1,2 … –1,3 до 2,0 В в переменно-токовом режиме ТАСТ с принудительным отрывом ртутных капель при времени задержки 1,1 с. В качестве электрода сравнения использовался хлорсеребряный электрод, индикаторным электродом служила ртутная капля (время задержки 7 с). Для определения цианид-ионов использовали полярографический метод [2, 3].
Результаты анализа щелоков и поглотительных растворов после обработки древесины (без отделения пропиточного раствора) представлены в табл. 1.
Как видно из данных табл. 1, основное количество нитрат-инов определено в кислом щелоке и промывной воде I стадии. Оно составляет 11,60 … 32,30 % от древесины (или 35 … 55 % от загруженной кислоты) и зависит от концентрации и количества загружаемой на варку кислоты. В щелоке после II стадии количество нитрат-ионов составляло 1,00 … 5,00 % и зависело как от тщательности промывки массы на I стадии, так и от концентрации кислоты, используемой на варку. Содержание нитрат-ионов () в щелоках было незначительным и в сумме не превышало 0,10 % от древесины (в пересчете на ).
В щелочных поглотителях, где улавливались двуокись азота и синильная кислота, количество определяемого нитрат-иона составляло 0,42…1,93 %, нитрит-ионов – 0,70 … 0,90 %, цианид-ионов – 1,00 … 2,10 % от древесины (в пересчете на ). Большая часть летучих азотосодержащих продуктов (3,25 … 9,14 %), образующихся из окиси азота, поглощалась в поглотителе с перекисью водорода. В присутствии этанола количество нитрат-ионов, образующихся в перекисном поглотителе, увеличивалось до 13,00 %. Суммарное количество летучих азотсодержащих продуктов составило 5,66 … 12,09 % при использовании водной среды. Найденное по разности (между количеством загруженной и определяемой в виде остаточного нитрат-иона) количество кислоты (14,43 … 17,66 %) асходовалось на реакции с лигнином и углеводами и образование органически связанного азота (нелетучие нитросоединения), а также терялось в виде нерегенерируемых азота и закиси азота, количество последних при пересчете на в сумме равнялось 17,00 … 19,00 % [9].
-
Применение.
-
Как химическая добавка для бетона (усиливает морозостойкость);
-
В качестве азотного удобрения;
-
Применяется в производстве стекла;
-
как консервант пищевых продуктов,;
-
компонент пиротехнических смесей;
-
минеральных удобрений.
-
Список литературы.
-
Лурье Ю.Ю. Справочник по аналитической химии. Москва, 1972;
-
Методическое указание «Инструментальные методы анализа», Пермь, 2004;
-
Методическое указание «Качественный химический анализ», Пермь, 2003;
-
Методическое указание «Количественный химический анализ», Пермь, 2004;
-
Рабинович В.А., Хавин З.Я. Краткий химический справочник, Ленинград, 1991.
