
- •Пятигорский филиал Государственного бюджетного образовательного учреждения высшего профессионального образования
- •«Волгоградский государственный медицинский университет» Министерства здравоохранения рф
- •Кафедра биологической химии и микробиологии
- •Методические рекомендации для самоконтроля знаний студентов 2-ого курса очного отделения по биологической химии
- •Пятигорск 2013
- •Вопросы для самоконтроля усвоения основных понятий темы
- •Учебное издание
Пятигорский филиал Государственного бюджетного образовательного учреждения высшего профессионального образования
«Волгоградский государственный медицинский университет» Министерства здравоохранения РФ
Кафедра биологической химии и микробиологии
Ю.К. Василенко, Л.А. Саджая, Е.О.Сергеева, И.В. Скульте, С.Ю. Маширова
Простые и сложные белки: структура и функции. Ферменты и витамины как их кофакторы. Строение, свойства, механизм действия, номенклатура и классификация ферментов
Методические рекомендации для самоконтроля знаний студентов 2-ого курса очного отделения по биологической химии
С.2.Б.13.
Пятигорск 2013
УДК 577.112’16(076)
ббк 28.072 я 73
П 24
Рецензент: доцент кафедры фармакологии и патологии Пятигорского филиала ГБОУ ВПО ВолгГМУ, канд. фармац. наук А.Ю. Терехов
Ю.К. Василенко, Л.А. Саджая, Е.О. Сергеева, И.В. Скульте, С.Ю. Маширова
П 24. Простые и сложные белки: структура и функции. Ферменты и витамины как их кофакторы. Строение, свойства, механизм действия, номенклатура и классификация ферментов: методические рекомендации для самоконтроля знаний студентов 2-го курса очного отделения по биологической химии (С.2.Б.13) ./ Ю.К. Василенко [и др.]. – Пятигорск: Пятигорский филиал ГБОУ ВПО ВолгГМУ, 2013. – 74 с.
Методические рекомедации составлены в соответствии с примерной Программой по биохимии, утверждённой в соответствии с ФГОС ВПО - 3 для студентов 2-го курса очной формы обучения. Методические указания составлены в виде билетов, содержащих по пять вопросов, и правильных ответов на них. Методические рекомедации предназначены для самоконтроля знаний студентов при подготовке к занятиям.
УДК 577.112’16(076)
ббк 28.072 я 73
Печатается по решению ЦМК
Пятигорского филиала ГБОУ ВПО «ВолгГМУ» Минздрава РФ
© Пятигорский филиал ГБОУ ВПО ВолгГМУ, 2013 г.
Пятигорский филиал Государственного бюджетного образовательного учреждения высшего профессионального образования
«Волгоградский государственный медицинский университет» Министерства здравоохранения рф
Кафедра биологической химии и микробиологии
Методические рекомендации для самоконтроля знаний студентов 2-ого курса очного отделения по биологической химии
С.2.Б.13.
Курс II
Семестр 4
Раздел «Введение в биохимию. Структура и биологические функции белков. Аминокислоты, простые и сложные белки. Иммуноглобулины. Биомембраны. Нуклеино-вые кислоты. Ферменты и витамины как их кофакторы»
К занятиям:2, 3, 5,8,9,10 Объем в часах: лабораторные занятия 15
Пятигорск 2013
Занятие № 2
Тема: химическое строение белков. Качественные реакции на функциональные группы белков и аминокислот. Качетвенный и количественный анализ некоторых белковых препаратов.
Вопросы для самоконтроля усвоения основных понятий темы
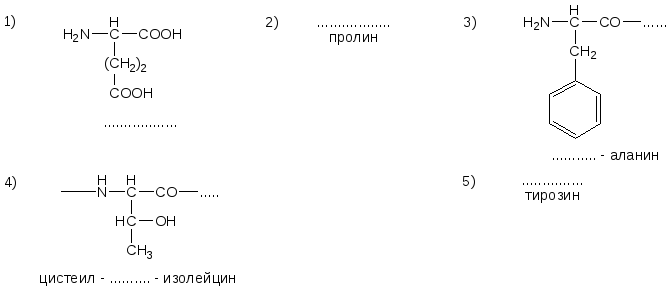
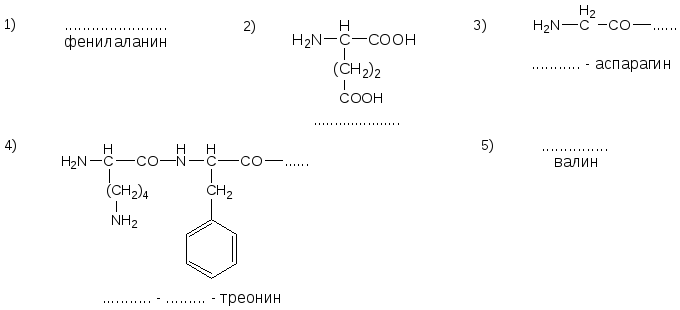
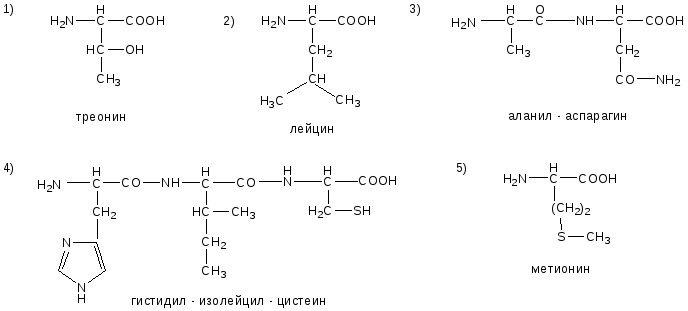
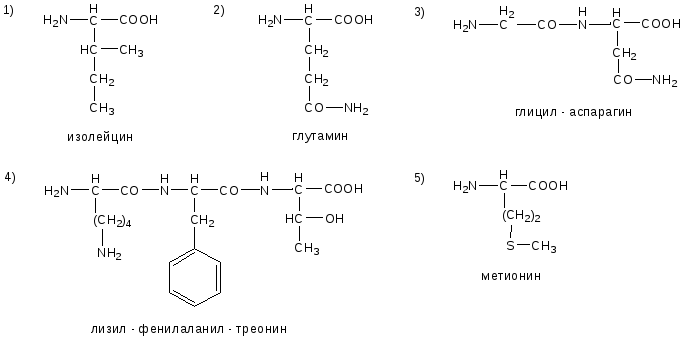
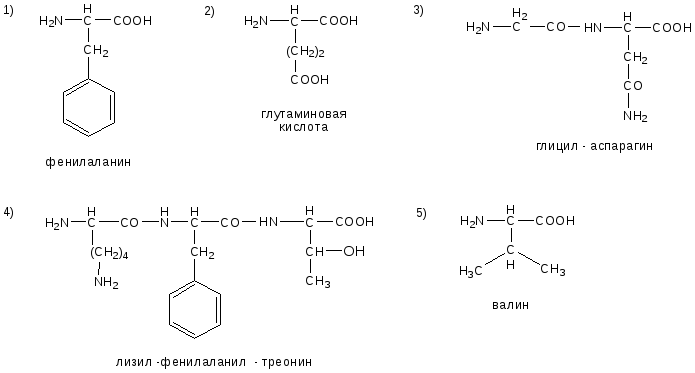
№1. Напишите недостающие формулы, названия аминокислот и пептидов.

№2. Напишите недостающие формулы, названия аминокислот и пептидов.

№3. Напишите недостающие формулы, названия аминокислот и пептидов.

№4. Напишите недостающие формулы, названия аминокислот и пептидов.
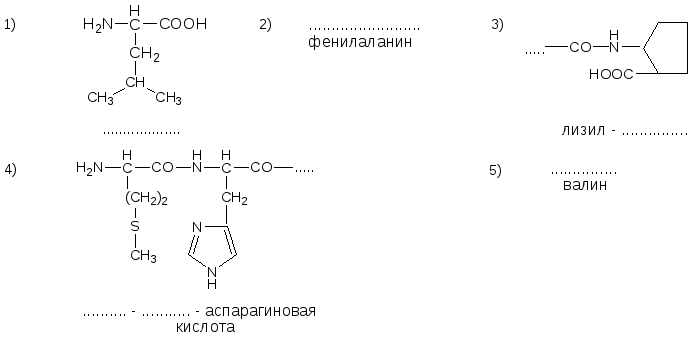
№5. Напишите недостающие формулы, названия аминокислот и пептидов.
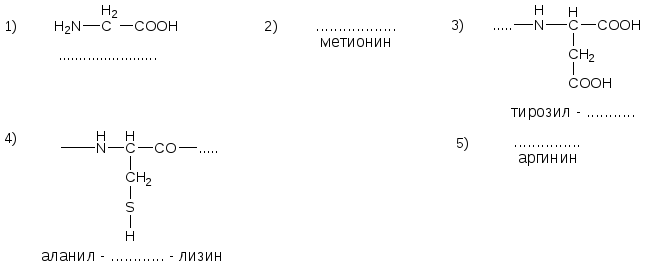
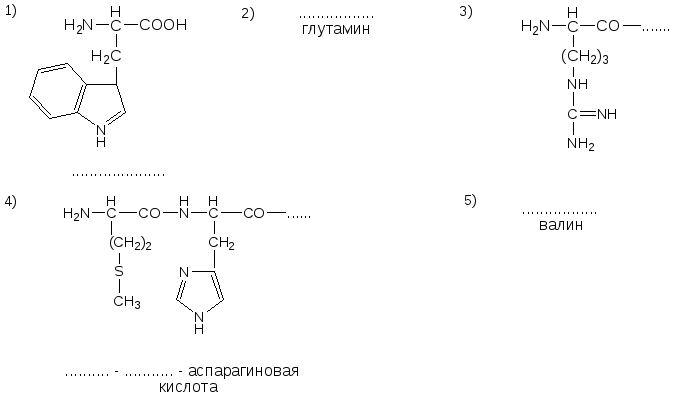
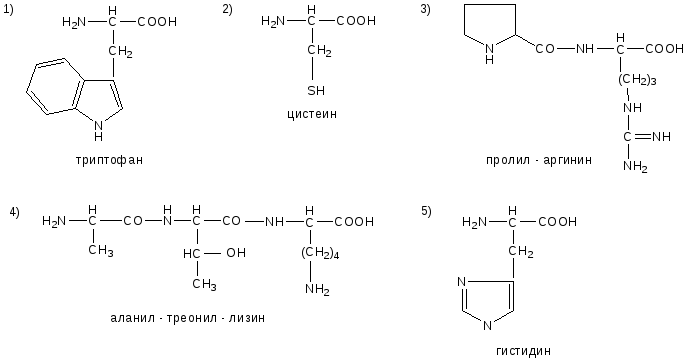
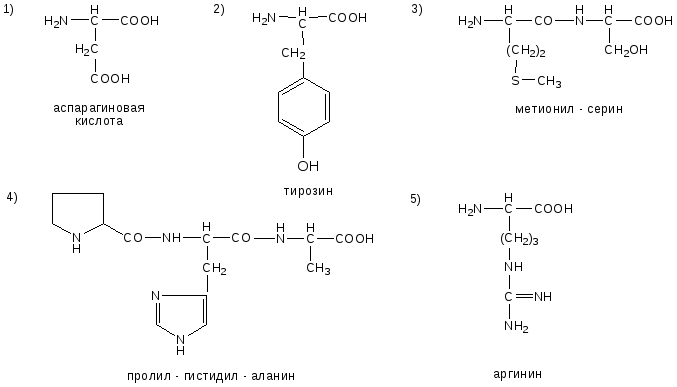
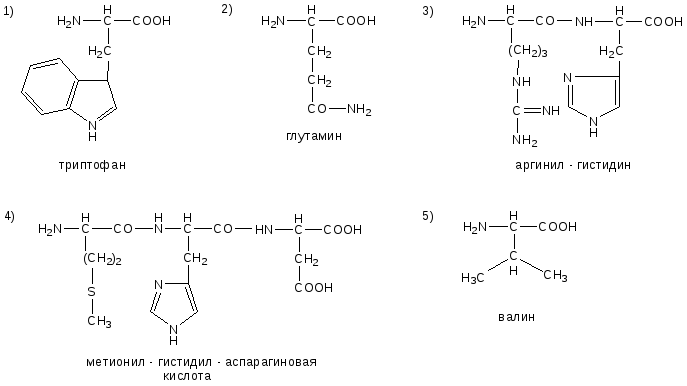
№6. Напишите недостающие формулы, названия аминокислот и пептидов.
№7. Напишите недостающие формулы, названия аминокислот и пептидов.
№8. Напишите недостающие формулы, названия аминокислот и пептидов.
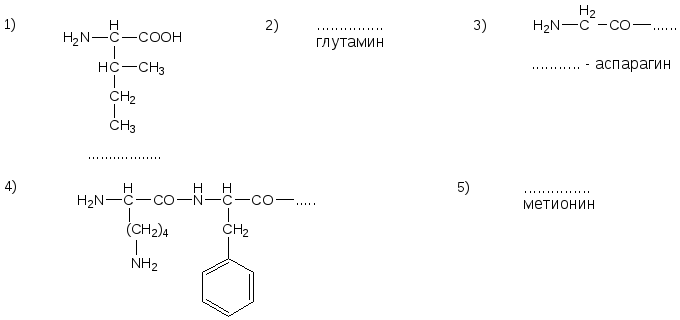
№9. Напишите недостающие формулы, названия аминокислот и пептидов.
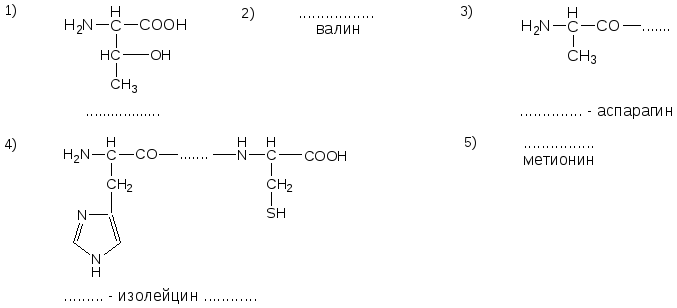
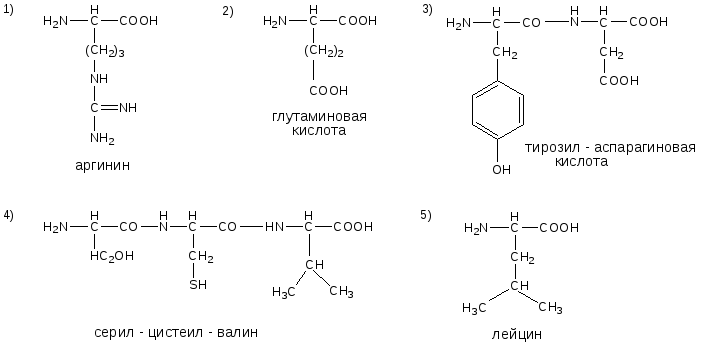
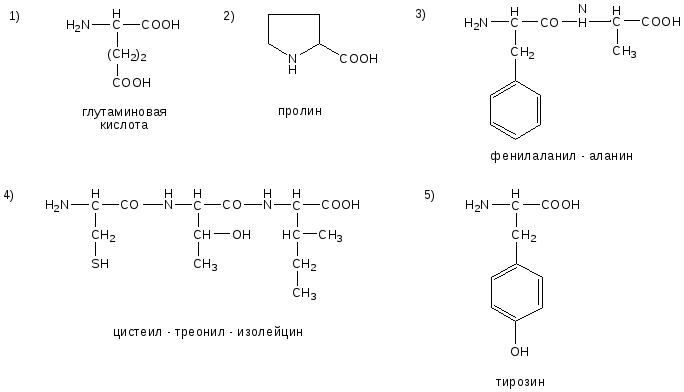
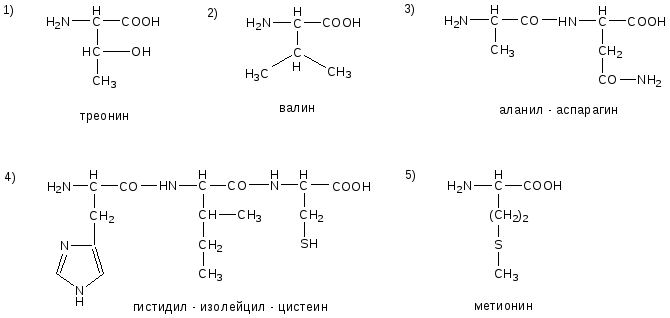
№10. Напишите недостающие формулы, названия аминокислот и пептидов.
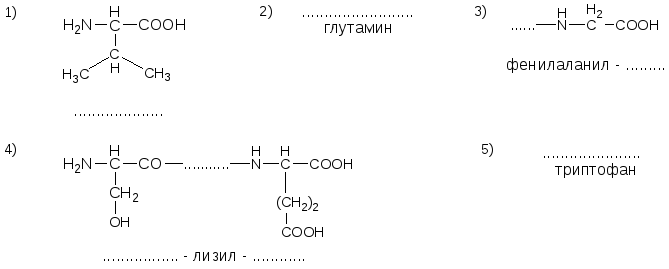
№11. Напишите недостающие формулы, названия аминокислот и пептидов.

№12. Напишите недостающие формулы, названия аминокислот и пептидов.
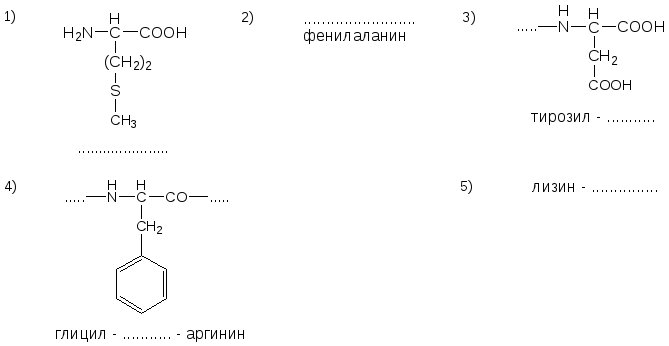
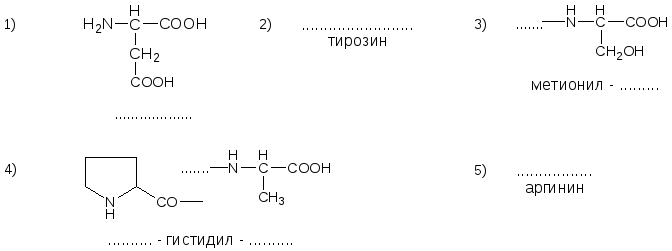
13. Напишите недостающие формулы, названия аминокислот и пептидов.

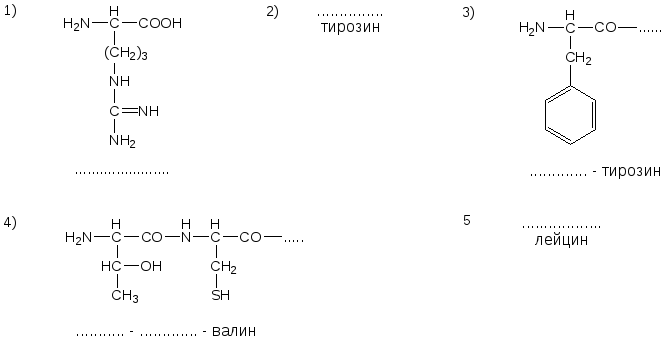
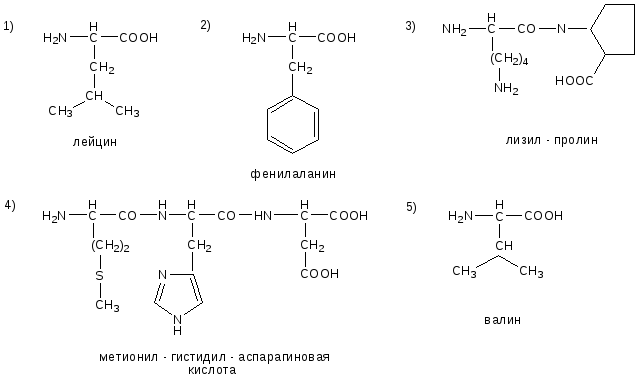
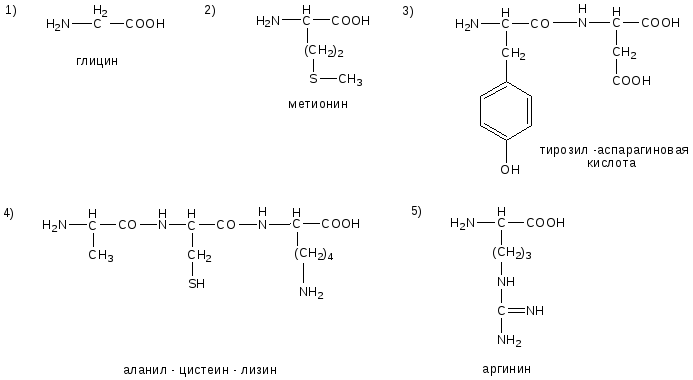
№14. Напишите недостающие формулы, названия аминокислот и пептидов.
№15. Напишите недостающие формулы, названия аминокислот и пептидов.
№16. Напишите недостающие формулы, названия аминокислот и пептидов.
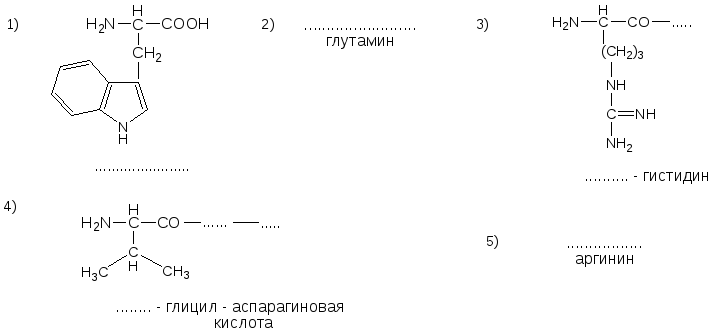
№17. Напишите недостающие формулы, названия аминокислот и пептидов.
Ответы на контрольные вопросы
ОТВЕТЫ НА БИЛЕТ № 1
ОТВЕТЫ НА БИЛЕТ № 2
ОТВЕТЫ НА БИЛЕТ № 3
ОТВЕТЫ НА БИЛЕТ № 4
ОТВЕТЫ НА БИЛЕТ № 5
 ОТВЕТЫ
НА БИЛЕТ № 6
ОТВЕТЫ
НА БИЛЕТ № 6
ОТВЕТЫ НА БИЛЕТ №7
 ОТВЕТЫ
НА БИЛЕТ № 8
ОТВЕТЫ
НА БИЛЕТ № 8
ОТВЕТЫ НА БИЛЕТ № 9
ОТВЕТЫ НА БИЛЕТ № 10
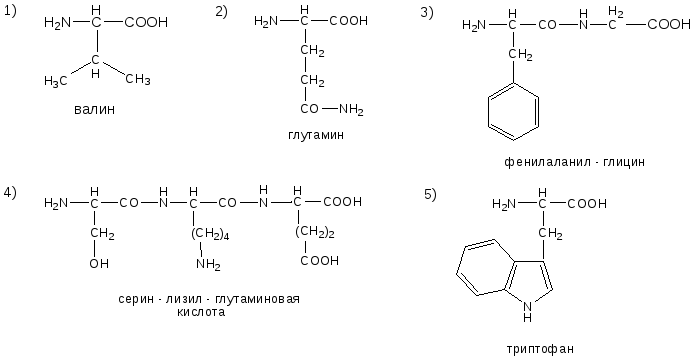
ОТВЕТЫ НА БИЛЕТ № 11
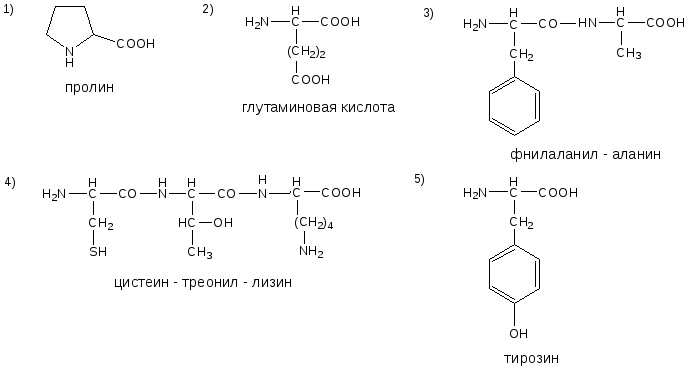
ОТВЕТЫ НА БИЛЕТ № 12
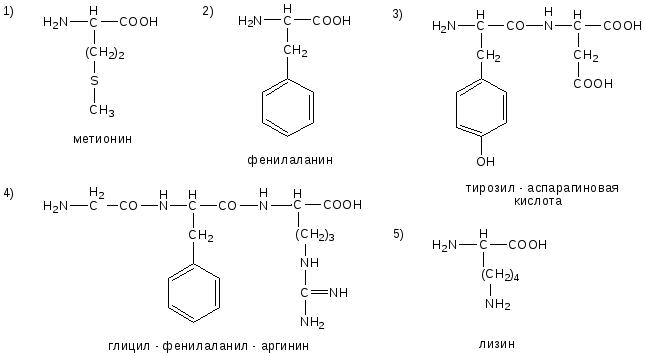
ОТВЕТЫ НА БИЛЕТ № 13
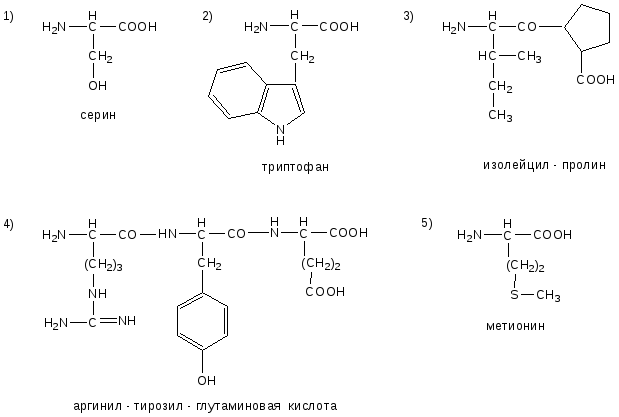
ОТВЕТЫ НА БИЛЕТ № 14
ОТВЕТЫ НА БИЛЕТ № 15
ОТВЕТЫ НА БИЛЕТ № 16
ОТВЕТЫ НА БИЛЕТ № 17

Занятие № 3
Тема: Физико-химические свойства и структура белков. Диализ белков. Исследования денатурации белков. Хроматография аминокислот.
Вопросы для самоконтроля усвоения основных понятий темы
Билет №1
-
Что такое белки?
-
Что называется альфа - аминокислотами?
-
Какого рода химические связи имеются в нативных белках?
-
Что представляет собой вторичная структура белка?
-
Что такое диализ? Для чего он применяется?
Билет №2
-
Перечислите основные физиологические функции белков в организме.
-
Почему аминокислоты являются амфотерными электролитами (полиэлектролитами)?
-
Перечислите аминокислоты с полярными незаряженными радикалами и напишите структурные формулы глицина, цистеина и серина.
-
Какие связи стабилизируют вторичную структуру белка?
-
Что такое обратимое осаждение белков?
Билет № 3
-
Назовите белки и пептиды, применяемые в медицине в качестве лекарственных препаратов.
-
В виде каких ионов аминокислоты присутствуют в сильнокислых растворах?
-
Перечислите аминокислоты с неполярными радикалами и напишите структурные формулы валина и лейцина.
-
Какие Вы знаете типы белковых молекул, различных по конформации?
-
На какие группы классифицируются простые белки?
Билет № 4
-
Каков элементарный химический состав белков? Напишите процентное соотношение макроэлементов.
-
В виде каких ионов аминокислоты присутствуют в сильнощелочных растворах?
-
Что такое пептидная связь в белках? Дайте ее характеристику.
-
Как образуются водородные связи, стабилизирующие вторичную структуру белка?
-
Перечислите наиболее характерные признаки протаминов и гистонов.
Билет № 5
-
Чему равна молекулярная масса белков? Перечислите методы определения молекулярной массы.
-
Сколько аминокислот из числа протеиногенных обладают оптической активностью?
-
Изобразите пептидную связь в виде пограничных мезомерных структур.
-
Что такое первичная структура белка?
-
Перечислите наиболее характерные признаки альбуминов и глобулинов.
Билет № 6
-
Чем объясняется коллоидный характер водных растворов белка?
-
Сколько лево – и сколько правовращающих аминокислот из 18 оптически активных?
-
Какие стереоизомеры (D – или L - ) находятся в природных белках ?
-
Какие типы вторичной структуры белка вы знаете?
-
В каком биологическом материале содержится больше всего протаминов и гистонов?
Билет № 7
-
Какое физическое явление подтверждает коллоидный характер водных растворов белков?
-
Какие оптические изомеры аминокислот чаще всего встречаются в природе?
-
Что такое «мезомерная форма» пептидной связи и какие следствия вытекают из ее существования ?
-
Что собой представляет третичная структура белка?
-
Какова физиологическая функция альбуминов?
Билет № 8
-
Что такое белки?
-
Напишите схему изменения заряда кислого белка в зависимости от изменения рН раствора.
-
Что такое дисульфидная связь в белковой молекуле и как она построена?
-
Какие связи участвуют в поддержании третичной структуры белка?
-
Какова физиологическая функция глобулинов?
Билет № 9
-
Каков характер водных растворов белка? Укажите фактор стабильности водных растворов.
-
Каков принцип современной рациональной классификации природных аминокислот ?
-
Какие вы знаете нековалентные связи в белковой молекуле ?
-
Что собой представляет четвертичная структура белка?
-
Дайте характеристику глютелинам.
Билет № 10
-
Что такое первичная структура белка?
-
Перечислите четыре класса в классификации аминокислот, основанной на полярности радикалов (с примерами)?
-
Как возникает водородная связь во вторичной структуре ?
-
Все ли белки обладают четвертичной структурой?
-
Назовите представителей растительных белков глютелинов и проламинов.
Билет № 11
-
Изобразите молекулу белка в диссоциированном виде.
-
Перечислите аминокислоты с неполярными радикалами и напишите структурные формулы изолейцина, фенилаланина и метионина.
-
Могут ли возникнуть водородные связи между радикалами аминокислот ?
-
Какие Вы знаете белки, обладающие четвертичной структурой?
-
Дайте характеристику растительным белкам проламинов.
Билет № 12
-
Какого типа ионы получаются при диссоциации белков в растворе?
-
Перечислите аминокислоты с полярными незаряженными радикалами. Напишите структурные формулы треонина и цистеина.
-
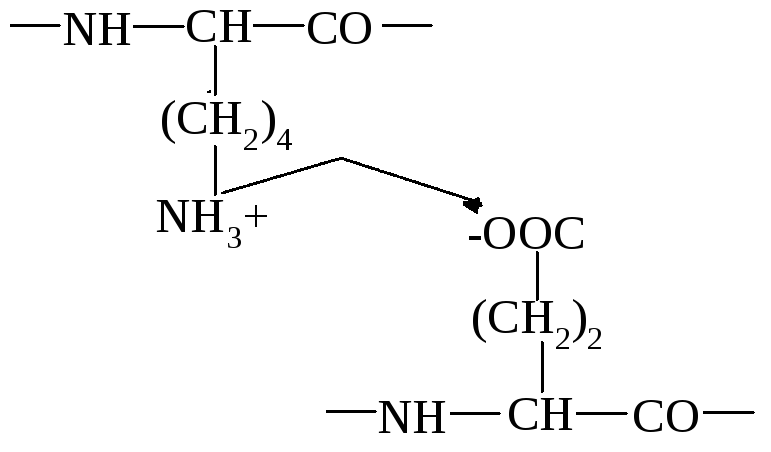
Приведите пример образования ионной связи в белковой молекуле
-
Что такое денатурация белка?
-
Что такое «протеиноиды» ?
Билет № 13
-
Что такое изоэлектрическая точка раствора белка?
-
Перечислите и напишите структурные формулы аминокислоты с отрицательно заряженными радикалами.
-
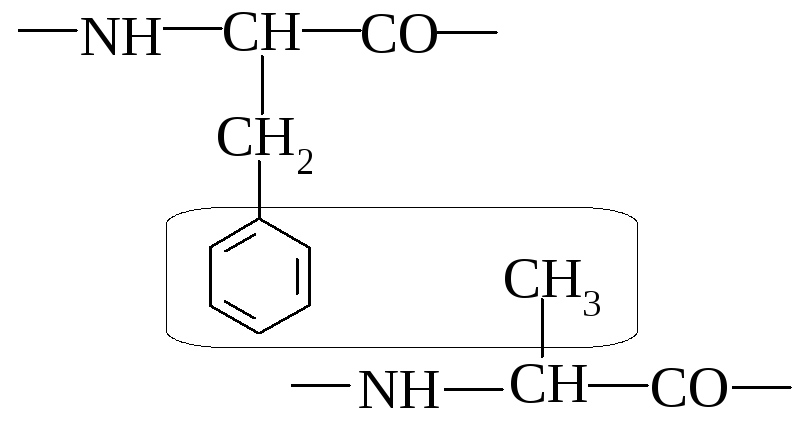
Приведите пример образования неполярной связи в молекуле белка.
-
Какие изменения структуры белка происходят при денатурации?
-
Какова отличительная физико – химическая особенность протеиноидов?
Билет № 14
-
Что такое изоэлектрическая точка раствора белка?
-
Перечислите и напишите структурные формулы аминокислот с положительно заряженными радикалами.
-
Что определяет конформацию полипептидных цепей в молекуле белка?
-
Перечислите основные денатурирующие агенты.
-
Назовите представителей белков - протеиноидов.
Билет № 15
-
Перечислите факторы, приводящие к нарушению гидратации молекул белка в растворе
-
Назовите аминокислоты, редко встречающиеся в белках
-
Что определяет конформацию полипептидных цепей в молекуле белка?
-
Перечислите основные денатурирующие агенты.
-
Назовите представителей белков - протеиноидов.
Билет № 16
-
Перечислите основные физиологические функции белков в организме.
-
Какими веществами можно обратимо осаждать белки?
-
Какова физиологическая функция альбуминов?
-
Укажите факторы стабилизации водных растворов белков.
-
Назовите и напишите формулы аминокислот с отрицательно заряженными радикалами.
Ответы на контрольные вопросы
ОТВЕТЫ НА БИЛЕТ № 1
-
Белки - это высокомолекулярные природные соединения, построенные из альфа-аминокислот, соединенных пептидными связями.
-
Альфа-аминокислоты - это карбоновые кислоты, имеющие в альфа-положении аминогруппу.
-
Ковалентные (пептидные и дисульфидные) и нековалентные (водородные, ионные, неполярные).
-
(Вторичная структура белка - это регулярная пространственная конфигурация полипептидной цепи в виде альфа-спирали или бета - структуры.
-
Диализ - метод разделения веществ с помощью мембран, неспособных пропускать сквозь свои поры высокомолекулярные коллоидные частицы. Применяется для освобождения белков от низкомолекулярных соединений.
ОТВЕТЫ НА БИЛЕТ № 2
-
Структурная, каталитическая, защитная, опорная, сократительная, репродуктивная, транспортная, регуляторная, поддержания кислотно -щелочного равновесии и осмотического давления.
-
Аминокислоты одновременно содержат две группы, способные к ионизации: карбоксильную, обладающую кислотными свойствами и аминогруппу, обладающую основными свойствами
-
Глицин, серии, треонин, цистеин, тирозин, аспарагин, глютамини.
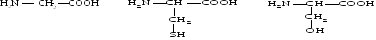
глицин цистеин серин
-
Водородные связи. Каждый кислород карбонильной группы аминокислотного остатка связан с азотом иминогруппы четвертого аминокислотного остатка, считая вдоль полипептидной цепи назад.
-
Осаждение, при котором возможно полностью вернуть осажденный белок к исходному нативному состоянию.
ОТВЕТЫ НА БИЛЕТ № 3.
-
Инсулин, соматотропный гормон, АКТГ (адренокортикотропный гормон), окситоцин, вазопрессин, гастрин, пепсин, трипсин и др.
-
В виде положительно заряженных ионов
-
Аланин, валин, лейцин, изолейцин, фенилаланин, триптофан, метионин, пролин:

валин лейцин
-
Глобулярные и фибриллярные.
-
|
5.Глютелины |
|
6.Проламины |
|
3.Альбумины |
7.Протеиноиды |
|
4.Глобулины |
|
ОТВЕТЫ НА БИЛЕТ № 4
-
Углерод - 50%, Водород - 7%, Кислород - 23%, Азот - 16%,Сера-3%.
-
В виде отрицательно заряженных ионов.
-
Пептидная (амидная) связь является основной, сильной ковалентной связью, соединяющей альфа-карбоксильную и альфа-аминогруппы соседних аминокислот.
-
Каждый атом кислорода карбонильной группы аминокислотного остатка связывается с атомом азота иминогруппы четвертого аминокислотного остатка, считая вдоль полипептидной цепи назад.
-
Выраженные щелочные свойства за счет большого содержания основных аминокислот (лизин, гистидин, аргинин). Сравнительно небольшая молекулярная масса (10-20 тыс.).
ОТВЕТЫ НА БИЛЕТ №5
-
Молекулярная масса белков колеблется от 6000 до нескольких миллионов углеродных единиц. Методы определения молекулярного веса: аналитический, электронномикроскопический, измерение осмотического давления, диффузный метод, измерение скорости седиментации, метод гель-фильтрации, электрофоретический.
-
Восемнадцать.
-

-
Специфическая последовательность расположения аминокислотных остатков и определенное их количество в полипептидной цепи белковой молекулы.
-
Составляют основную массу белков крови, избирательно осаждаются раствором сернокислого аммония, разделяются при электрофорезе на фракции: альбумины, α1-, α2-, β-, γ -глобулины.
ОТВЕТЫ НА БИЛЕТ № 6
-
Коллоидный характер белковых растворов объясняется огромными размерами белковых молекул.
-
10 - правовращающих аминокислот, 8 – левовращающих аминокислот.
-
L-ряда
-
Альфа-спираль и бета-структура
-
Протамины - сперма и молоки рыб (сальмин, скумбрии, клупеин), гистоны - в ядерном веществе, зобной железе, в белках эритроцитов (глобин).
ОТВЕТЫ НА БИЛЕТ № 7
-
Явление Тиндаля.
-
L -аминокислоты.
-
Связь между С- и N-атомами в пептидной связи занимает промежуточное положение между одинарной и двойной типами связи за счет сопряжения электронов и отличается повышенной cстабильностью. Вследствие этого:
-
иминогруппа (- NН -) пептидной связи не может отщеплять (или присоединять протон в диапазоне рН от 0 до 14.
-
отсутствует свободное вращение атомов вокруг -С-N- связи, поэтому атомы пептидной связи лежат в одной плоскости, образуя цис- или транс-формы.
-
Это пространственная упаковка чередующихся спиральных и линейных участков полипептидной цепи в компактное тело.
-
Принимают участие в осмотическом давлении крови и транспортировке различных веществ.
ОТВЕТЫ НА БИЛЕТ № 8.
-
Белки - высокомолекулярные природные соединения, построенные из альфа-аминокислот, соединенных пептидными связями.
-
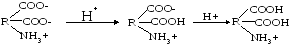
кислый нейтральный щелочной
белок белок белок
-
Дисульфидная связь - это прочная ковалентная связь, которая образуется в результате отщепления водорода от SН - группы двух цистеиновых остатков в молекуле белка.
-
Водородные связи между пептидными группами, водородные связи между боковыми цепями аминокислотных остатков, ионные связи, дисульфидные связи, неполярные (гидрофобные) связи.
-
Глобулины участвуют в образовании иммунных веществ: антител и антитоксинов, и выполняют транспортную функцию.
ОТВЕТЫ НА БИЛЕТ № 9
-
Коллоидные растворы. Одноименный заряд частиц белка в растворе.
-
Принцип классификации основан на различиях полярности радикалов при физиологическом значении рН (рН=7).
-
Водородные, ионные, полярные.
-
Взаимное пространственное расположение субъединиц белка-олигомера связанных нековалентными связями в белковой молекуле и представляющих единое образование в функциональном и структурном отношении.
-
Это белки растительного происхождения. Нерастворимы в воде и нейтральных солевых растворах, растворимы в разбавленных щелочах. Входят в состав клейковины зерна.
ОТВЕТЫ НА БИЛЕТ № 10.
-
Специфическая последовательность расположения аминокислотных остатков в полипептидной цепи белковых молекул.
-
1. аминокислоты с неполярными радикалами;
2.аминокислоты с полярными незаряженными радикалами;
3. с отрицательно заряженными полярными радикалами;
4.с положительно заряженными полярными радикалами
3.Водородная связь в структуре белка создается за счет повышенной электроотрицательности СО-групп пептидной связи и усиленной электроположительности МН-группы. Водородный атом NН-группы одной пептидной связи притягивается атомом кислорода четвертой по счету пептидной связи, образуя водородную связь.
4.Нет.
5.Оризеин (из риса), глютенин (из пшеницы), глиадин (из пшеничных ядер), гордеин (из ячменя), зеин (из кукурузы).
ОТВЕТЫ НА БИЛЕТ № 11.
-
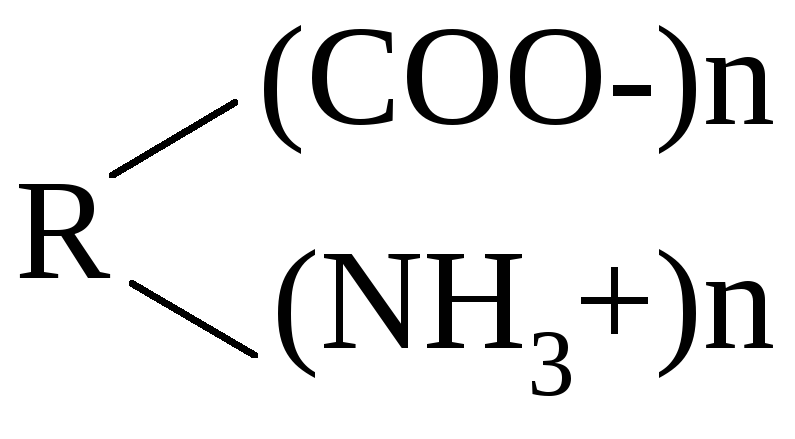
-
Алании, валин, лейцин, изолейцин, фенилаланин, триптофан, метионин, пролин:

изолейцин фенилаланин метионин
-
Да. Например, между тирозином и карбоксильной группой глутаминовой кислоты.
-
Гемоглобин, лактатдегидрогеназа.
-
Нерастворимы в воде и солевых растворах, растворяются в 70% спирте. Содержат большое количество аминокислоты пролина.
ОТВЕТЫ НА БИЛЕТ № 12.
-
Амфионы.
-
Глицин, серии, треонин, цистеин, тирозин, аспарагин, глютамин:

треонин цистеин
-
Ионная связь образована между аминогруппой в радикале лизина и карбоксильной группой в радикале аспарагиновой кислоты.
-
Превращение биологически активного нативного белка в форму, теряющую естественные свойства (растворимость, электрофоретическую подвижность, ферментативную активность).
-
Это белковоподобные вещества, включающие белки опорных тканей (костей, хрящей, сухожилий).
ОТВЕТЫ НА БИЛЕТ № 13.
-
Изоэлектрической точкой называется то значение рН, при котором суммарный заряд белка равен нулю.
-
Аспарагиновая кислота, глутаминовая кислота.

-
Неполярная связь образуется между неполярными радикалами аминокислот, например фенилаланина и аланина.
-
Нарушение третичной структуры и частично вторичной при отсутствии изменения первичной структуры.
-
Их полная нерастворимость в воде, солевых растворах, разведенных кислотах и щелочах, неперевариваемость пищеварительными ферментами.
ОТВЕТЫ НА БИЛЕТ № 14.
-
То значение рН, при котором суммарный заряд белка в растворе равен нулю.
-
Гистидин, лизин, аргинин.

Гистидин лизин аргинин
-
Наличие различных ковалентных и нековалентных связей и факторы внешней среды.
-
Физические: нагревание (свыше 50-60°С), повышенное давление, замораживание, ионизирующее излучение, ультразвук.
Химические: ионы Н+ и ОН- (при рН выше 10 и ниже 4),органические растворители (ацетон, спирт), мочевина, соли тяжёлых металлов.
-
Коллаген, кератины, фибрин.
ОТВЕТЫ НА БИЛЕТ № 15
1. Кипячение, органические растворители, нейтрализация заряда белка.
2. Гидроксилизин, гидроксипролин. тироксин.
3. Пептидные и частично дисульфидные.
4. Аминокислота аминокислота

L -ряда D -ряда
-
Нет.
ОТВЕТЫ НА БИЛЕТ № 16.
1. Структурная,каталитическая, защитная, опорная, сократительная, репродуктивная, транспортная, регуляторная, поддержания кислотно-щелочного равновесия и осмотического давления.
2. Растворами нейтральных солей (сульфат натрия и аммония), органическими водоотнимающими средствами (этанол, ацетон).
3. Принимают участие в осмотическом давлений крови и транспортировке различных веществ.
4. Наличие гидратной оболочки и одноименного заряда частиц белка.
5. Глютаминовая кислота, аспарагиновая кислота

глютаминовая аспарагиновая
кислота кислота
Занятие № 4
Тема: : Сложные белки и их кофакторы. Фосфопротеины. Углеводсодержащие белки. Хромопротеины. Выделение казеиногена из молока и определение фосфата в казеиногене. Определение углеводного компонента гликопротеинов. Иммуноглобулины. Химическая природа гемпротеинов.
Занятие № 5
Тема: : Нуклеопротеины и нуклеиновые кислоты. Липопротеины. Получение липосом. Гидролиз нуклео-протеинов.
Вопросы для самоконтроля усвоения основных понятий темы
БИЛЕТ № 1
1. Что такое сложные белки (протеиды)?
2. Назвать небелковые компоненты гликопротеинов.
3. Что такое фосфопротеины?
4. Какова биологическая роль свободных нуклеозид-трифосфатов?
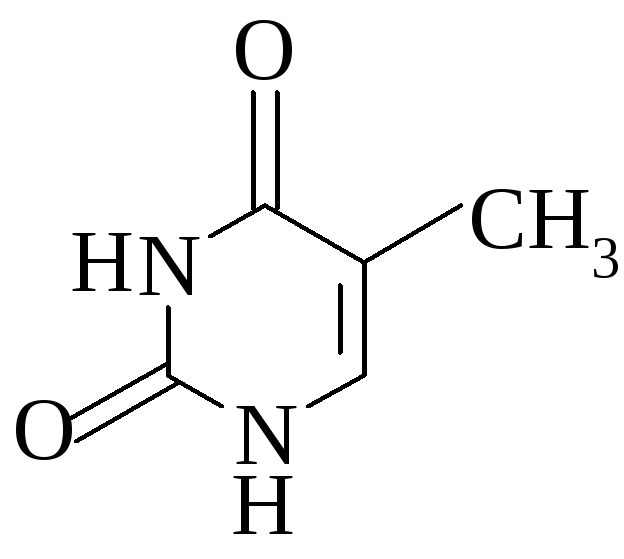
5. Напишите формулу изоаллоксазина.
БИЛЕТ № 2
I. Перечислите классы сложных белков.
2. Что такое гликопротеины?
3. Какое азотистое основание содержится только в РНК?
4. Напишите формулу бета-каротина.
5. Охарактеризуйте функции биомембран.
БИЛЕТ № 3
I. Назовите азотистое основание, комплементарное к аденину в составе ДНК, напишите его формулу.
2. Назовите основные функции гликопротеинов.
3. Как связаны белковая часть и небелковый компонент в молекуле фосфопротеинов?
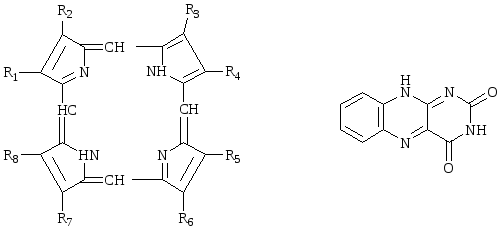
4. Напишите формулу порфирина.
5. Какова проницаемость липидного слоя мембран для различных веществ?
БИЛЕТ № 4
I. Назовите органические соединения, лежащие в основе структуры простетических групп хромопротеинов.
2. Что такое липосомы?
3. Какова биологическая роль фосфопротеинов?
4. Укажите основные классы мембранных липидов.
5. Напишите название и формулу дезоксирибонуклеотида, содержащего азотистое основание цитозин.
БИЛЕТ № 5
1. Напишите формулу и название дезоксирибонуклеотида, содержащего азотистое основание тимин.
2. Назовите гормоны, которые являются гликопротеидами.
3. Назовите представителей фосфопротеинов.
4. Какие сложные белки образуют структуру биологических мембран?
5. Что такое хромопротеиды?
БИЛЕТ № 6
1. Какова биологическая особенность гемоглобина?
2. Что такое липопротеиды?
3. Назовите небелковые компоненты металлопротеинов.
4. Что представляют собой биологические мембраны?
5. Напишите формулы и названия пуриновых азотистых оснований, входящих в состав нуклеиновых кислот.
БИЛЕТ № 7
1. В чём отличие аномального гемоглобина, вызывающего серповидно-клеточную анемию, от нормального?
2. Напишите названия и формулы пиримидиновых азотистых оснований, входящих в состав РНК.
3. Что такое металлопротеиды?
4. Какие сывороточные сложные белки выполняют функции транспорта липидов?
5. Что такое фосфопротеиды?
БИЛЕТ № 8
1. Какие функции выполняют хромопротеиды: цитохромы, каталаза, пероксидаза?
2. Перечислите виды РНК.
3. Каково биологическое значение металлопротеинов?
4. Что такое текучесть биомембран?
5. Назовите представителей фосфопротеинов.
БИЛЕТ № 9
1. Какие функции выполняют хромопротеиды - флавопротеиды?
2. Назовите небелковые компоненты липопротеинов.
3. Охарактеризуйте жидко-кристаллическую структуру биомембран.
4. Назовите представителей металлопротеинов.
5. Что такое минорные азотистые основания? Приведите их примеры (формулы и названия).
БИЛЕТ № 10
1. Какой уровень структурной организации имеет гемоглобин?
2. Назовите металлопротеид, выполняющий функцию депо железа в организме.
3. Какова роль холестерина в формировании жидкокристаллической структуры липидного слоя мембран?
4. Напишите формулу и название рибонуклеотида, содержащего урацил.
5. Назовите представителей гликопротеинов.
БИЛЕТ № 11
1. Укажите состав белков биомембран.
2. Какие ткани наиболее богаты липопротеидами?
3. Что такое нуклеопротеиды? Какие виды их известны?
4. Назовите металлопротеид, выполняющий функцию транспортирования железа в организме.
5. Что такое фосфопротеиды?
БИЛЕТ № 12
1. Что такое хромопротеиды?
2. Перечислите классы сложных белков.
3. Назовите металлопротеид, выполняющий функцию депо железа в организме.
4. Напишите формулу и полное название АТФ.
5. Как классифицируются сывороточные липопротеиды? Каково соотношение в них белкового и небелкового компонентов?
БИЛЕТ № 13
1. Охарактеризуйте жидкостно-мозаичную модель биомембран Сингера-Николсона.
2. Напишите формулу и название дезоксирибонуклеотида, содержащего аденин.
3. Укажите основные классы мембранных липидов.
4. Как называется белковая часть гемоглобина? Из скольких протомеров и субъединиц она построена?
5. Какова биологическая роль фосфопротеинов?
БИЛЕТ № 14
1. Что такое гликопротеиды? Назовите их представителей.
2. Назовите представителей фосфопротеидов.
3. Каковы способы переноса веществ через биомембрану? Охарактеризуйте простую диффузию.
4. Напишите формулу и название азотистого основания, комплементарного к тимину.
5. Напишите формулу изоаллоксазина. В какие сложные белки входят производные изоаллоксазина в качестве простетических групп?
БИЛЕТ № 15
1. Какие сложные белки образуют структуру клеточных и субклеточных мембран?
2. Что такое облегчённая диффузия?
3. В чем заключается молекулярная гибридизация нуклеиновых кислот?
4. Назовите представителей хромопротеинов.
5. Что такое гликозаминогликаны (мукополисахариды)? Какие функции они выполняют?
БИЛЕТ № 16
1. На какие группы разделяют хромопротеиды?
2. Что такое металлопротеиды?
3. Какова функция рецепторных белков плазматических мембран?
4. Какие азотистые основания нуклеиновых кислот называются комплементарными?
5. Как используются липосомы в фармации?
Ответы на контрольные вопросы
ОТВЕТЫ НА БИЛЕТ № 1
1. Сложные белки - это соединения, состоящие из белка и небелкового компонента (простетической группы).
2. Небелковая часть гликопротеинов представлена высокомолекулярными полисахаридами (кислыми и нейтральными мукололисахаридами). В состав углеводного компонента могут входить гексозы, гексозамины, глюкуроновая и сиаловая кислоты, уксусная и серная кислоты.
3. Фосфопротеиды - сложные белки, небелковым компонентом которых является фосфорная кислота.
4. Свободные нуклеозид-трифосфаты играют особую роль в процессах обмена веществ и энергии, в частности, АТФ - донор энергии, ГТФ - в биосинтезе белков, ЦТФ - в обмене липидов, а также циклические формы мононуклеотидов (ц-АМФ, ц-ГМФ), выполняющие роль вторичных мессенджеров.
5 .
Изоаллоксазин:
.
Изоаллоксазин:
ОТВЕТЫ НА БИЛЕТ № 2.
I. Хромопротеиды, гликопротеиды, липопротеиды, фосфопротеиды. металлопротеиды, нуклеопротеиды.
2. Гликопротеиды - это сложные белки, небелковым компонентом которых является гликозаминогликаны (мукополисахариды) и др. сложные углеводы, среди продуктов гидролиза которых обнаружены гексозы, гексозамины, глюкуроновая, сиаловая, уксусная и серная кислоты.
3. Только в РНК содержится урацил.
4.
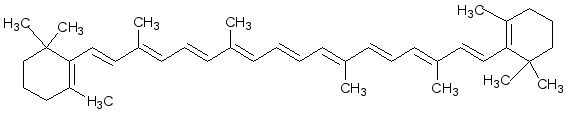
Бета-каротин.
5. Метаболическая (превращение природных и чужеродных веществ), регуляторная (участие в образовании ц-АМФ), энерготрансформирующая (образование АТФ), транспортная (перенос веществ различными механизмами), электрическая (поддержание разности электрических потенциалов на мембране).
ОТВЕТЫ НА БИЛЕТ № 3.
1. Тимин
2. Основные функции гликопротеинов:
-опорная (гликопротеиды входят в состав костной и хрящевой ткани)
-защитная (препятствуют проникновению инфекции в организм)
-структурная (входят в состав клеточных мембран)
-регуляторная и поддержания осмотического давления (гликопротеидами являются многие сывороточные белки и некоторые гормоны).
3. Остатки фосфорной кислоты связаны фосфорноэфирными связями с молекулой белка по месту гидроксильных групп аминокислот серина и треонина.
4. Порфирин:
5. Липидные бислои характеризуются низкой проницаемостью для заряженных ионов типаNa+, Cl-, H+ и для большинства полярных соединений (например, сахара), но легко проницаемы для воды (благодаря наличию пронизывающих мембрану пор) и гидрофобных низкомолекулярных соединений.
ОТВЕТЫ НА БИЛЕТ № 4.
1. Порфирин, изоаллоксазин, бета-каротин.
2. Это мембраноподобные структуры, созданные искусственным путём, т.к. на поверхности раздела двух фаз (вода - жир) полярные липиды легко и самопроизвольно формируют очень тонкие бислои. Липосомы можно получить путем сильного встряхивания водных суспензий фосфолипидов.
3. Фосфопротеиды являются питательным материалом для растущего организма; фосфорная кислота необходима для развития скелета.
4. Фосфолипиды, гликолипиды, холестерол.
5.
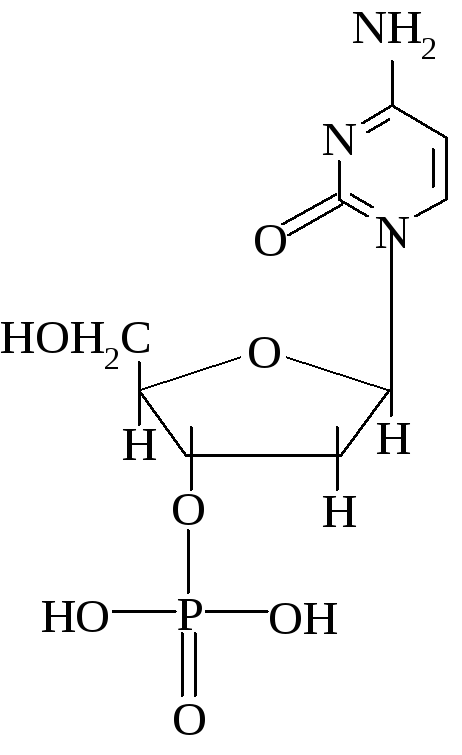
ОТВЕТЫ НА БИЛЕТ № 5.
1.

2. Тиреотропный гормон, гонадотропные гормоны.
3. Казеин - белок молока, овальбумин - белок яичного белка, виттелин, вителленин и фосвитин - белки яичного желтка.
4. Липопротеиды, гликопротеиды.
5. Хромопротеиды - это сложные белки, небелковыми компонентами которых являются окрашенные вещества, производные порфирина, изоаллоксазина, бета-каротина.
ОТВЕТЫ НА БИЛЕТ № 6.
1. Способность соединяться с газами: кислородом, окисью углерода.
2. Липопротеиды - это сложные белки, небелковыми компонентами которых являются липиды.
3. Металлопротеиды содержат в своем составе металлы: железо, медь, магний и др.
4. Это плоские структуры толщиной 6-9 нм, которые состоят из молекул белков и липидов, удерживаемых вместе нековалентными связями.
5.
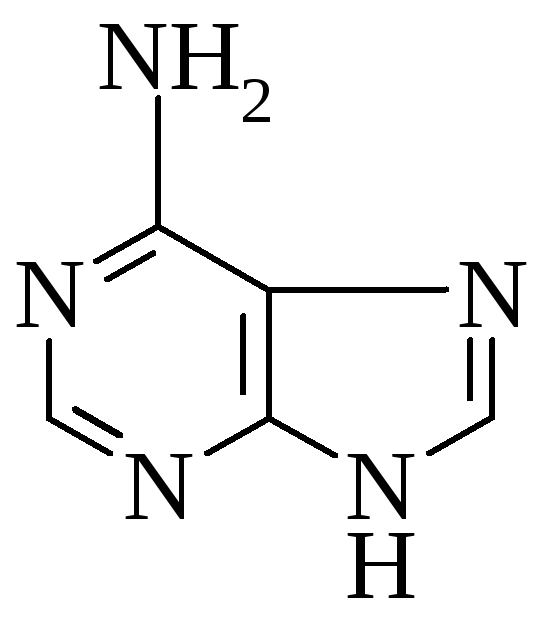
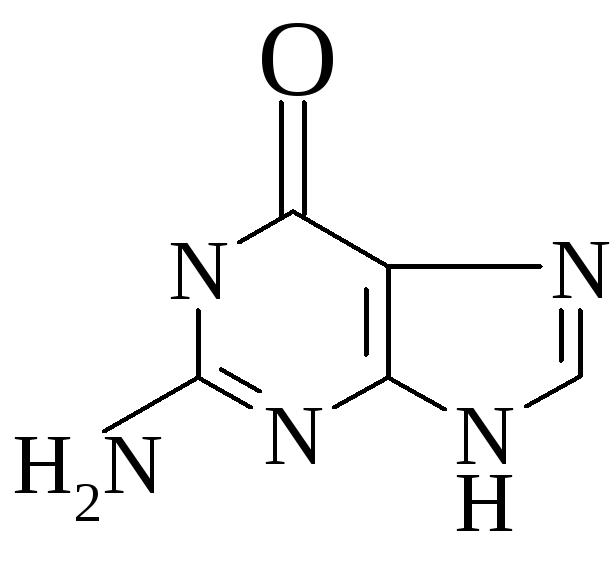
Аденин Гуанин
ОТВЕТЫ НА БИЛЕТ № 7
1. В первичной структуре глобина в β-цепи на шестом месте вместо глутаминовой кислоты находится валин.
2.
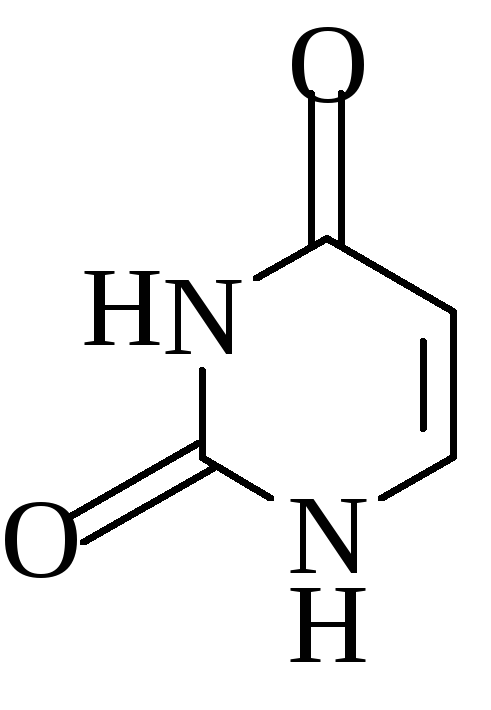
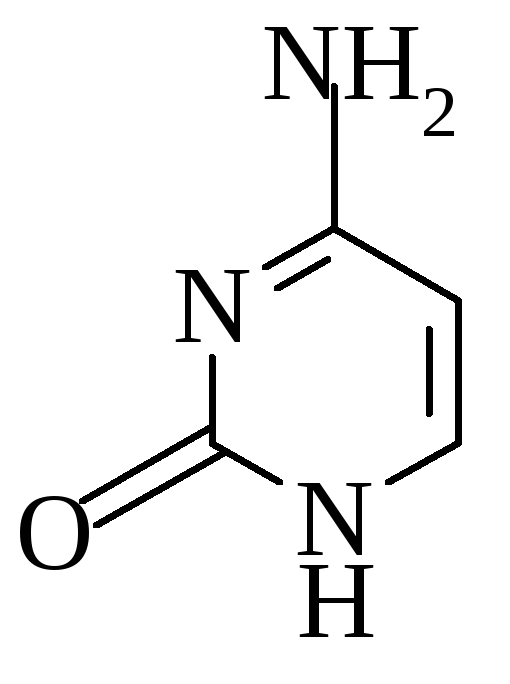
Урацил Цитозин
3. Металлопротеиды - это сложные белки, небелковым компонентом которых являются ионы железа, меди, магния и др. металлов.
4. Липопротеиды.
5. Фосфопротеиды - это сложные белки, небелковым компонентом которых является фосфорная кислота.
ОТВЕТЫ НА БИЛЕТ № 8
1. Выполняют каталитическую функцию: ускоряют окислительно-восстановительные реакции.
2. Информационная РНК (и-РНК), транспортная РНК (т-РНК) и рибосомальная РНК (р-РНК).
3. Осуществляют транспорт железа в организме (трансферин) или его депонирование (ферритин), являются ферментами (карбоангидраза, карбоксипептидаза).
4. Благодаря жидкокристаллической структуре липидного бислоя, молекулы липидов, несмотря на упорядоченность положения, сохраняют способность к диффузии в направлении, параллельном поверхности мембран без выхода за пределы слоя. Эту способность мембран называют "текучестью".
5. Казеин - белок молока, овальбумин - белок яичного белка, виттелин, фосвитин - белки яичного желтка.
ОТВЕТЫ НА БИЛЕТ № 9.
I. Выполняют ферментативную функцию, ускоряют окислительно-восстановительные реакции в организме.
2. Триглицериды, фосфолипиды, холестериды, высшие жирные кислоты.
3. Состояние, в котором находятся липиды мембран, называется жидкокристаллическим, поскольку в целом липидная прослойка жидкая, но в ней есть плотные участки, похожие на кристаллические структуры.
4. Ферритин, трансферрин, ферменты: карбоангидраза, карбоксипептидаза.
5. Это метилированные и гидроксипроизводные азотистых оснований, например:
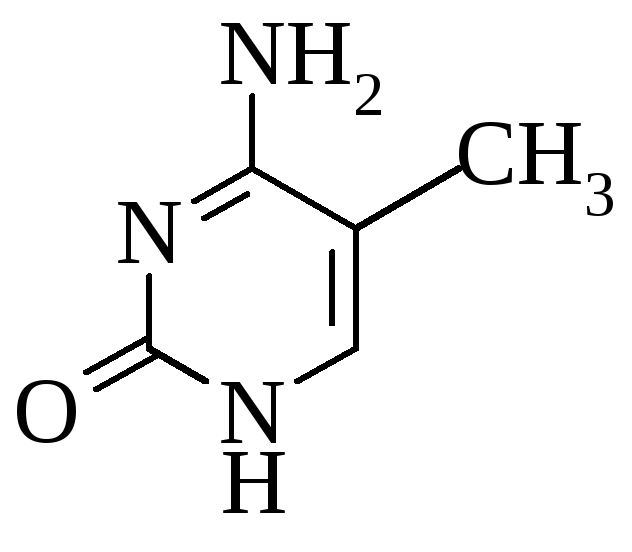
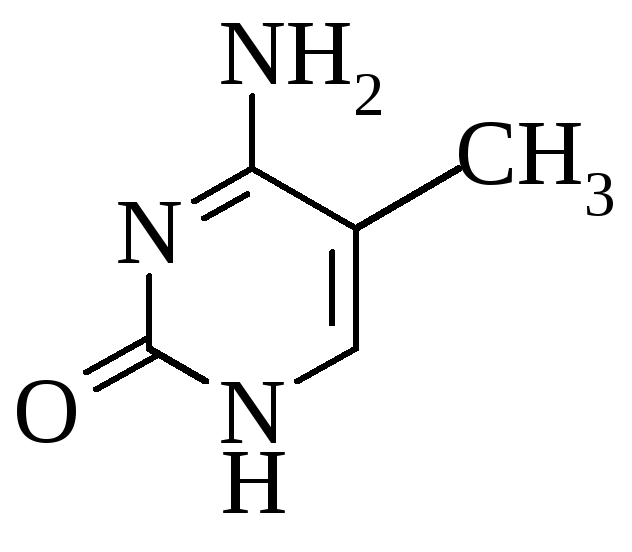
5-метилцитозин 2 метиладенин
ОТВЕТЫ НА БИЛЕТ № 10.
1. Гемоглобин имеет четвертичную структуру.
2. Ферритин.
3. Холестерин регулирует образование кристаллических структур мембраны: разъединяя полярные цепи фосфолипидов, мешает излишнему "затвердеванию" жидкого слоя и в тоже время в участках с большим количеством "жидких" ненасыщенных цепей жирных кислот фосфолипидов способствует их уплотнению.
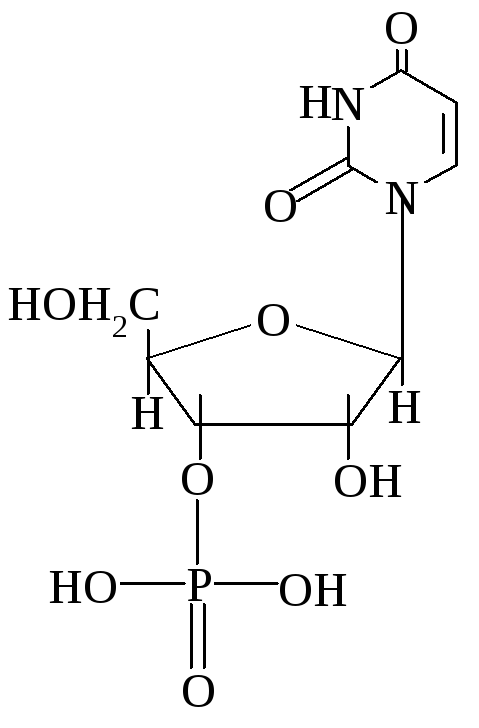
4. Уридинмонофосфат (УМФ)
5. Гликопротеиды костной и хрящевой ткани - остеомукоиды и хондромукоиды; гликопротеиды яичного белка - овомукоиды; гликопротеиды слюны - муцин.
ОТВЕТЫ НА БИЛЕТ № 11
1.В зависимости от прочности связи с мембранными структурами различают периферические и интегральные (внутренние) мембранные белки. Качественный состав белков разных мембран неодинаков и определяет их функции. В плазматических мембранах выделяют такие группы белков:
-
антигенные,
-
структурные,
-
рецепторные,
-
ферментные,
-
транспортные.
2. Нервная ткань, сыворотка крови.
3. Сложные белки, небелковым компонентом которых являются нуклеиновые кислоты (ДНК, РНК).
4. Трансферрин.
5. Сложные белки, небелковым компонентом которых является фосфорная кислота.
ОТВЕТЫ НА БИЛЕТ № 12
1. Хромопротеиды - это сложные белки, небелковым компонентом которых являются окрашенные вещества, производные порфирина, изоаллоксаэина, β -каротина.
2. Хромопротеиды, гликонротеиды, липопротеиды, фосфопротеиды, металлопротеиды, нуклеопротеиды.
3. Ферритин.
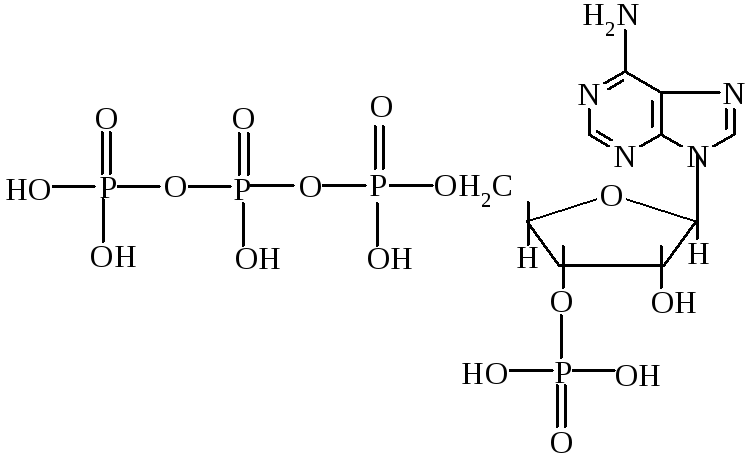
4.
Аденозин-5'-трифосфат (АТФ).
5. Липопротеиды по плотности классифицируются на 4 группы:
- хиломикроны, содержащие 2% белка и 98% липидов;
- пре-β-липопроеиды (ЛПОНП), содержащие 10% белка, 90% липидов;
- β -липопротеиды (ЛПНП), содержащие 22% белков и 78% липидов;
- α-липопротеиды (ЛПНП), содержащие 50% белка и 50% липидов.
ОТВЕТЫ НА БИЛЕТ № 13.
1. Согласно модели Сингера-Николсона основной непрерывной частью мембран служит полярный липидный бислой, находящийся в жидком состоянии. Интегральные белки, имеющие гидрофобные радикалы аминокислот как бы растворяются в гидрофобной части бислоя и, подобно айсбергам, почти полностью погружены в углеводородный серединный слой, а периферические белки, имеющие, в основном, гидрофильные радикалы, буквально плавают на поверхности билипидного "моря". Согласно этой модели мембранные белки могут свободно перемещаться в латеральной плоскости. Поперечная диффузия невозможна.
2. Дезоксиаденозинмонофосфат.
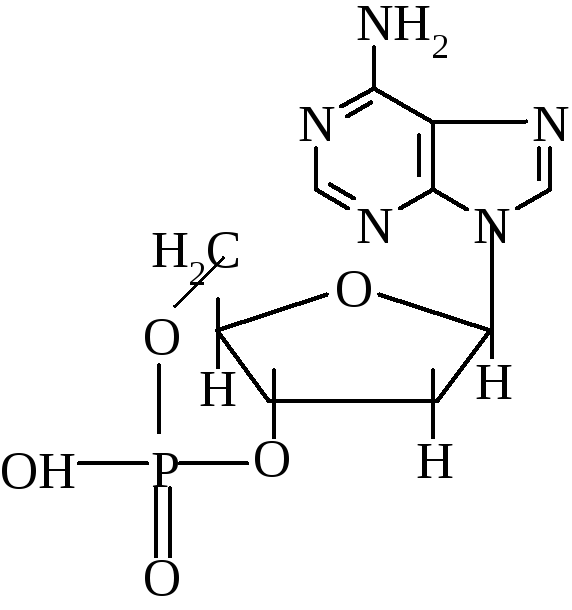
3. Фосфолипиды, гликолипиды, холестерол.
4. Глобин, который включает две α, β-субъедениц или иначе - состоит из четырех протомеров (две α-цепи, две β -цепи).
5. Фосфопротеиды являются питательным материалом для растущих организмов. Фосфорная кислота необходима для развития скелета.
ОТВЕТЫ НА БИЛЕТ № 14.
1. Гликопротеиды – протеогликаны - это сложные белки (углевод-белковые комплексы), небелковым компонентом которых являются углеводы. Их главные представители - мукоиды и муцины.
2. Казеин - белок молока, овальбумин - белок яичного белка, вителлин, вителлениин, фосфовитин - белки яичного желтка.
3. Эндоцитоз, простая диффузия, облегченная диффузия и активный транспорт. Простая диффузия происходит без затраты энергии по градиенту концентрации и определяется растворимостью в веществе мембран (особенно его липидного слоя). За счет диффузии могут через мембрану перемещаться небольшие нейтральные молекулы (СО2, О2), а также гидрофобные низкомолекулярные органические вещества, в т.ч. лекарственные вещества.
4. Аденин
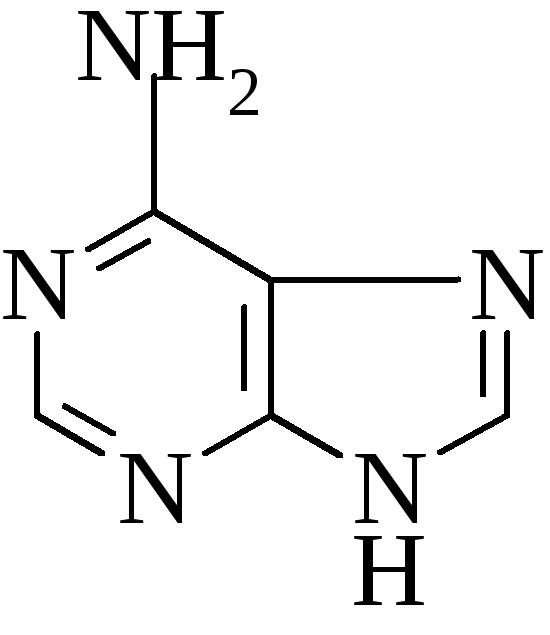
5. Производные изоаллоксазина входят в состав хромопротеинов.
Изоаллоксазин:
ОТВЕТЫ НА БИЛЕТ № 15
1. Липопротеиды, гликопротеиды.
2. Это способ переноса веществ через мембрану по градиенту концентрации, но при участии специальных мембранных белков-переносчиков (транслоказ, пермеаз). Для облегчённой диффузии характерна высокая избирательность к переносимому веществу.
3. Нуклеиновые кислоты способны ренатурировать после денатурации. Исследования показали, что при совместной денатурации различных ДНК бактерий и последующей ренатурации могут возникать "гибридные" молекулы ДНК, составленные из фрагментов первоначальных молекул ДНК. Это явление получило название молекулярной гибридизации и послужило основой для постановки работ в области генной инженерии.
4. Гемоглобин, миоглобин; ферменты: каталаза, пероксидаза, цитохромы.
5. Гликозаминогликаны - это углеводные компоненты протеогликанов:гиалуроновая кислота, хондроитинсерная кислота, гепарин. Гиалуроновая кислота связывает воду в соединительной ткани, регулирует проницаемость тканей. Гепарин - антикоагулянт. Гликозаминогликаны присутствуют в слизистых секретах, предохраняя слизистые оболочки от механических повреждений.
ОТВЕТЫ НА БИЛЕТ № 16
-
Хромопротеиды в зависимости от строения небелкового компонента делят на три группы:
-
производные порфирина,
-
производные изоаллоксазина
-
производные β-каротина.
2. Металлопротеиды - это сложные белки, небелковым компонентом которых являются ионы металлов.
3. Рецепторные белки, расположенные снаружи мембраны, определяют биохимический ответ клетки на внешние регуляторы (гормоны, медиаторы и др.).
4. Пара аденин - тимин и гуанин - цитозин характеризуются избирательностью взаимодействия, т.е. являются комплементарными (дополняющими друг друга).
5. Липосомы - это специфическая лекарственная форма для направленной доставки лекарственных средств к органам и тканям, что значительно уменьшает токсичность и увеличивает эффективность препаратов.
Занятие № 8
Тема: Витамины и их коферментные формы. Количественное определение витамина С.
Вопросы для самоконтроля усвоения основных понятий темы
Билет 1
1. Какова химическая природа витаминов? Какова их роль в организме?
2. Напишите формулу антипеллагрического витамина и его коферментную форму.
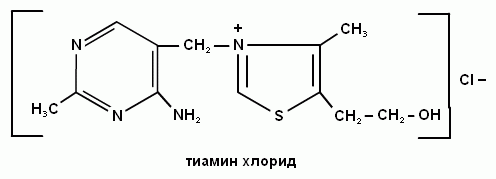
3. Какова биологическая роль витамина В1?
4. Какие нарушения возникают при недостатке витамина В12?
5. Какой витамин образует кофермент А?
Билет 2
1. Что такое антивитамины? Назовите антивитамины, используемые с лечебной целью.
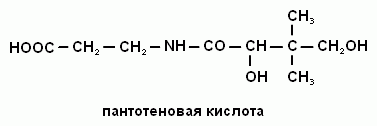
2. Напишите формулу пантотеновой кислоты и ее коферментную форму.
3. Какова биологическая роль рибофлавина?
4. Какие нарушения возникают в организме при недостатке витамина Н?
5. Какую коферментную форму образует витамин ВС?
Билет 3
1. Укажите причины гипо- и авитаминозов и гипервитаминозов.
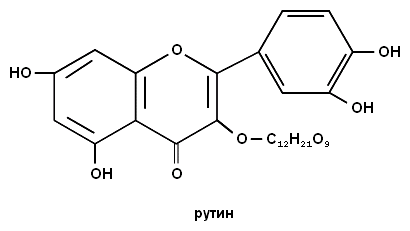
2. Напишите формулу витамина Р (рутина).
3. Какова биологическая роль витамина В12?
4. Какие нарушения возникают при недостатке витамина Е?
5. Какое соединение является активной формой витамина Д?
Билет 4
1. Дайте определение гипервитаминозу. Какие водорастворимые витамины наиболее токсичны при гипервитаминозе?
2. Напишите формулу тиамина и его коферментную формулу.
3. Какова биологическая роль витамина В5?
4. Какие нарушения возникают в организме при недостатке витамина В12?
5. Какой витамин образует коферменты ФАД и ФМН?
Билет 5
1. Какие соединения называются антивитаминами? На какие группы они делятся по строению?
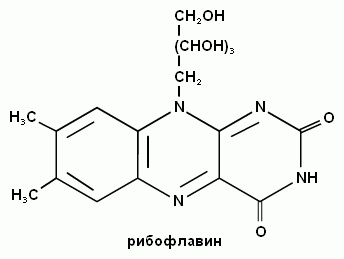
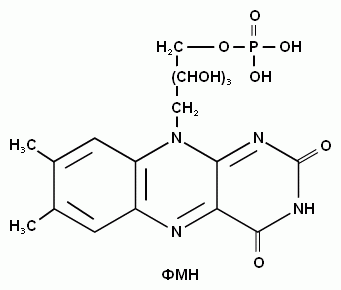
2. Напишите формулу рибофлавина и его коферментную формулу (ФМН).
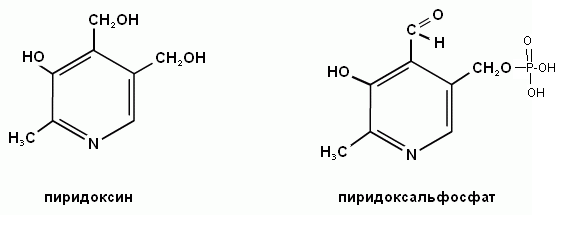
3. Какова биологическая роль витамина В6?
4. Какие нарушения возникают в организме при недостатке витамина А?
5. Какой витамин образует коферменты НАД и НАДФ?
Билет 6
1. Как проявляется дисбаланс витаминов в организме?
2. Напишите формулу витамина В6 и его коферментную формулу.
3. Какова биологическая роль витамина Д?
4. Какие нарушения возникают в организме при недостатке витамина роста?
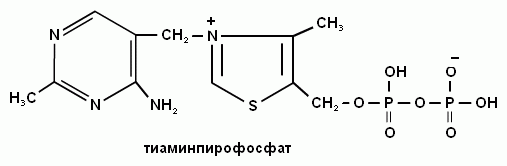
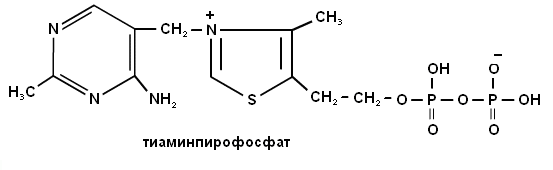
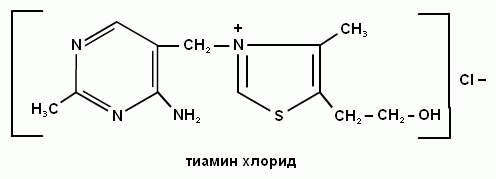
5. Какой витамин входит в состав кофермента тиаминдифосфата?
Билет 7
1. Какие витамины синтезируются в организме микрофлорой кишечника?
2. Напишите формулу витамина Н и его коферментную формулу.
3. Какова биологическая роль антискорбутного витамина?
4. Какие нарушения возникают в организме при недостатке витамина В1?
5. Какой витамин входит в состав кофермента ТГФК?
Билет 8
1. Какие витамины наиболее токсичны при гипервитаминозе?
2. Напишите формулу витамина В5 и его коферментную формулу.
3. Какова биологическая роль витамина В3?
4. Может ли возникнуть гиповитаминоз при лекарственной терапии? Приведите пример.
5. Какой витамин входит в состав кофермента А?
Билет 9
1. Дайте все названия витамина В3.
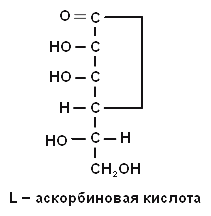
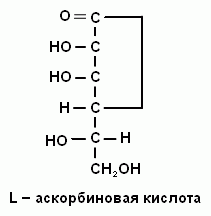
2. Напишите формулу витамина С.
3. Какова биологическая роль витамина Р?
4. Какие нарушения возникают в организме при недостатке витамина А?
5. В состав какого кофермента входит витамин Н?
Билет 10
1. Дайте химическое название витамина Н.
2. Напишите формулу витамина В6 и его коферментную формулу.
3. Какова биологическая роль витамина В12?
4. Какие нарушения возникают в организме при недостатке витамина В1?
5. Какую коферментную форму образует витамин В3?
Билет 11
1. Дайте все названия витамина РР.
2. Напишите формулу витамина В1 и его коферментную формулу.
3. Какова биологическая роль витамина Д?
4. Какие нарушения возникают в организме при недостатке витамина Н?
5. Какую коферментную форму образует витамин ВС?
Билет 12
1. Дайте название витамина В2.
2. Напишите формулу биотина и его коферментную формулу.
3. Какова биологическая роль ниацина?
4. Какие нарушения возникают в организме при недостатке витамина В6?
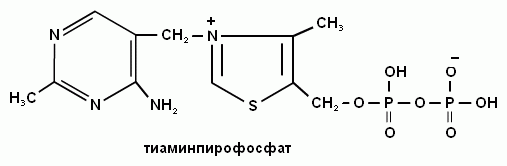
5. Какую коферментную форму образует витамин В1?
Билет 13
1. Дайте все названия витамина В5.
2. Напишите формулу витамина роста и его коферментную формулу.
3. Какова биологическая роль пантотеновой кислоты?
4. Какие нарушения возникают в организме при недостатке витамина В12?
5. В каких биохимических процессах участвует витамин К?
Билет 14
1.Дайте все названия витамина В12..
2. Напишите формулу антисеборрейного витамина и его коферментную формулу.
3. Какова биологическая роль пиридоксина?
4. Какие нарушения возникают в организме при недостатке витамина В1?
5. В каких биохимических процессах участвует витамин С?
Билет 15
1. Назовите витамины, которые согласно их лечебно-профилактическому действию, используются как препараты, повышающие общую реактивность организма.
2. Напишите формулу антиневритного витамина и его коферментную формулу.
3. Какова биологическая роль витамина Р?
4. Какие нарушения возникают при недостатке витамина РР?
5. Какие коферментные формы образует витамин В5?
Билет 16
1. Назовите витамины, которые согласно их лечебно-профилактическому действию, используются как антианемические препараты?
2. Напишите формулу аскорбиновой кислоты.
3. Какова биологическая роль витамина А?
4. Какие нарушения возникают при недостаточном поступлении в организм витамина В1?
5. Какие существуют антивитамины по структуре? Приведите примеры.
Ответы на контрольные вопросы
Ответы на билет № 1
-
Витамины представляют собой сборную в химическом отношении группу низкомолекулярных органических соединений. Витамины не включаются в структуру тканей и не используются в организме в качестве источника энергии. Они обеспечивают нормальное протекание биохимических и физиологических процессов путем участия в регуляции обмена веществ.
-
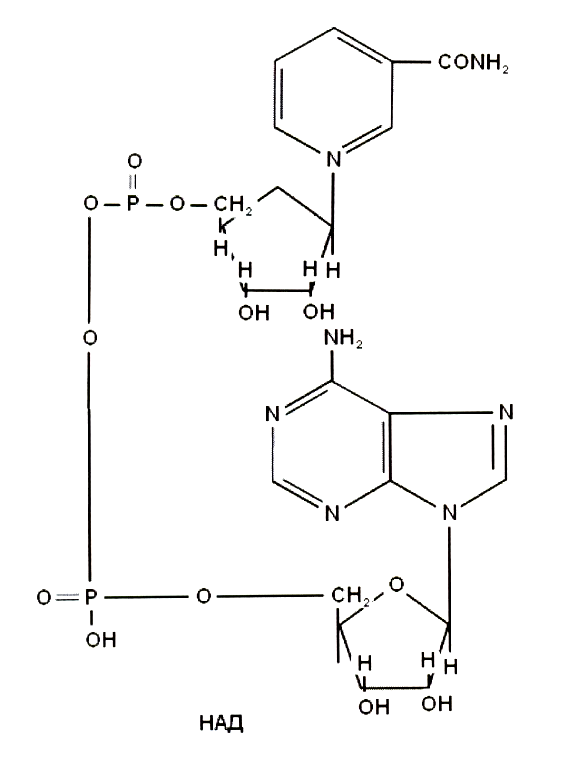
-
Витамин В1 в форме тиаминпирафосфата в качестве ферментов дегирогеназ участвует в окислительном декарбоксилировании пирувата кетоглутарата, глиоксилата. Тиаминпирофосфат участвует в ключевых реакциях лимоннокислого цикла, трансаминировании альфакетоглутарата, в реакциях синтеза азотистых оснований.
-
При недостатке витамина В12 наблюдается анемия гиперхромного типа, а также возникает гастрогенный В12 – авитаминоз, сопровождающийся злокачественной анемией.
-
Кофермент А образует Витами В3
Ответы на билет № 2
-
Антивитамины – это соединения структуроподобные или структуроразличные витаминам, которые частично или полностью выключают витамины из обменных реакций организма путем их разрушения, инактивирования или препятствуя их ассимиляции. Ряд антивитаминов используют с лечебной целью, пример антивитамина витамина К – дикумарин, варфарин, тромексан, пример антивитамина витамина РР – изониазид, пример антивитамина витамина Вс – аминоптерин, антивитамины парааминобензойной кислоты – сульфаниламиды.
-

3.Рибофлавин в виде двух коферментных форм ФМН и ФАД входят в состав флавопротеидов, участвующих в окислительно-восстановительных реакциях. Ряд флавопротеидов участвуют в лимоннокислом цикле, в процессе окислительного фосфорилирования, β-окисления жирных кислот и т.д.
4.При недостатке витамина Н у человека наблюдается воспаление кожных покровов, выпадение волос, себорея, усиленное выделение жира сальными железами.
5.Коферментной формой витамина Вс является тетрагидрофолиевая кислота (Витамин Вс).
Ответы на билет № 3
-
Причиной гиповитаминозов является недостаточное поступление витаминов с пищей, нарушение процессов всасывания в желудочно-кишечном тракте, нарушение усвоения витаминов клетками организма при заболеваниях обмена веществ, эндокринных заболеваниях, инфекционных заболеваниях, генетических нарушениях. Причиной гипервитаминозов является чрезмерное бесконтрольное использование лекарственных препаратов витаминов.
-
-
Витами В12 участвует в двух группах биохимических реакций, к первой группе относятся реакции трансметилирования, образование метилкобаламина - переносчика метильной группы. Вторая группа реакций сводится к переносу водорода и образования новой углерод-водородной связи.
-
При недостатке витамина Е нарушается сперматогенез и эмбриогенез, наблюдаются дегенеративные изменения репродуктивных органов, разрушение клеточных оболочек мембран.
-
Активной формой витамина D является 1,25 – диоксикальциферол.
Ответы на билет № 4
-
Гипервитаминоз – это состояние, наблюдаемое при избыточном поступлении витаминов. Из водорастворимых витаминов при гипервитаминозе наиболее токсичен витамин В1.
-
-
Никотиновая кислота в виде амида входит в состав коферментов НАД и HAДФ, которые вместе с соответствующими апоферментами катализируют окислительно-восстановительные реакции в организме. Никотинамидные коферменты входят в состав таких ферментов, которые участвуют в реакциях лимоннокислого цикла, β-окисления жирных кислот, синтеза жирных кислот, синтеза холестерина и др.
-
При недостатке витамина В12 наблюдается анемия гиперхромного типа, а также возникает гастрогенный В12 – авитаминоз, сопровождающиеся злокачественной анемией.
-
Коферменты ФМН и ФАД образует витамин B2 (рибофлавин).
Ответы на билет № 5
-
Антивитамины – это вещества, которые частично или полностью выключают витамины из обменных реакций организма. Они бывают структуроподобные и структуроразличные. Антивитамины, в основном, очень близкие к соответствующим витаминам, включаются в цепь реакции обмена, прерывая её нормальное течение. В основе действия лежит конкурентное вытеснение антивитамином соответствующего витамина из его комплекса с ферментом и они являются конкурентными ингибиторами витаминов. Структуроразличные витамины путем изменения структуры витаминов лишают витамина его действия. Эти витамины являются неконкурентными ингибиторами витаминов.
-
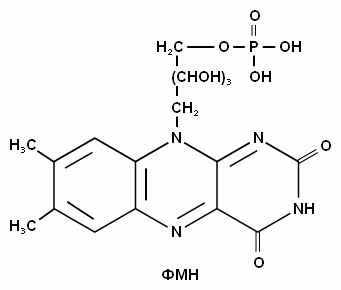
-
Витамин В6 в виде пиридоксальфосфата участвует в биохимических реакциях превращения аминокислот (реакциях декарбоксилирования и переаминирования).
-
При недостатке витамина А наблюдается ослабление зрения, поражение эпителиальных тканей, ксерофтальмия, нарушиния формирования скелета, уменьшение устойчивости к инфекциям.
-
Коферменты НАД и НАДФ образует витамин В5 (ниацин).
Ответы на билет № 6
-
Дисбаланс витаминов в организме проявляется в виде гиповитаминоза, авитаминоза и гипервитаминоза.
-
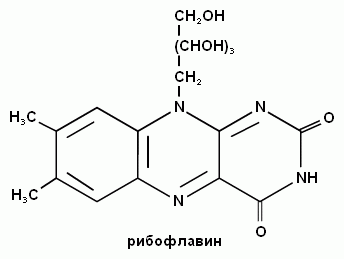

-
Витамин Д регулирует транспорт ионов кальция и фосфата через клеточные мембраны. Метаболит 1,25-диоксикальциферол участвует в регуляции образования белковых компонентов кальциевого насоса мембран.
-
При недостатке витамина Д2 наблюдается задержка роста, дерматиты, выпадение волос, кератины, нарушения регенерации и др.
-
В состав кофермента тиаминдифосфата входит витамин В1 (тиаминхлорид).
Ответы на билет № 7
-
Микрофлорой кишечника синтезируются Витамин К, В3, В12, Н, В6.
-
-
Витамин С участвует в окислительно-восстановительных реакциях, синтезе соединительной ткани (коллагеновых волокон), в обмене тирозина, в гидроксилировании кортикостероидов, обмене холестерина.
-
При недостатке витамина В1 возникает полиневрит: дегенерация нервных окончаний, нарушение сердечной деятельности, моторной и секреторной функции желудочно-кишечного тракта, водного обмена, паралич.
-
В состав кофермента ТГФК входит витамин Вс (фолиевая кислота).
Ответы на билет № 8
-
При гипервитаминозе наиболее токсичными являются жирорастворимые витамины, особенно витамин Д, из водорастворимых наиболее токсичен витамин В1.
-
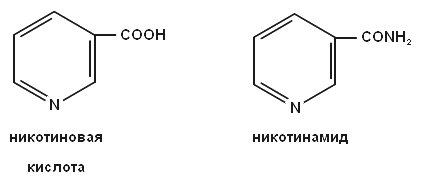
-
Витамин В3 входит в состав КоА, участвует в лимоннокислом цикле, окислении жирных кислот, окислительном декарбоксилировании кетокислот, синтезе стеринов, стероидов, триацилглицеринов и др.
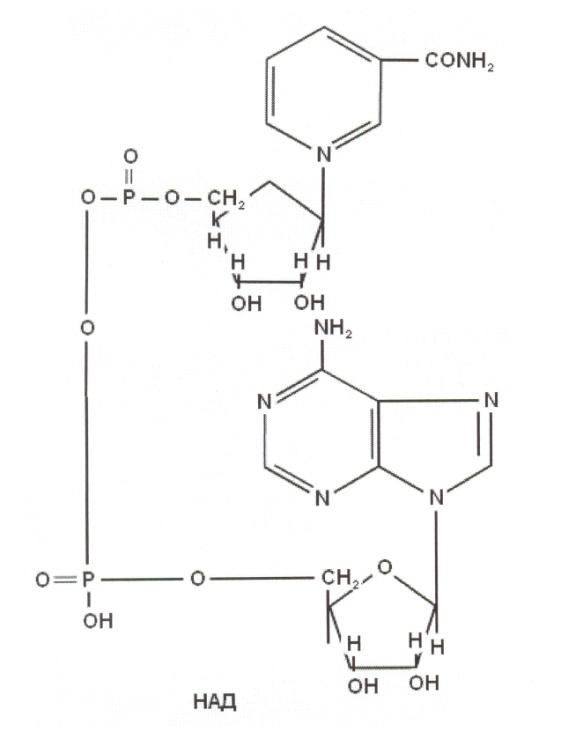
-
При лекарственной терапии может возникнуть гипервитаминоз. Бесконтрольное и чрезмерное употребление витамина Д и В1 может привести к серьезным осложнениям из-за высокой токсичности.
-
В состав коферента А входит витамин В3 (пантотеновая кислота).
Ответы на билет № 9
-
Витамин В3 –пантотеновая кислота, антидерматитный витамин.
-
Витамин Р участвует в тканевом дыхании, воздействует на ферменты пролиноксидазу. Влияет на функционирование эндокринных желез. Оказывает антиоксидантное действие.
-
При недостатке витамина А наблюдается ослабление зрения, ороговение и слущивание эпителия, сухость и воспаление роговицы, нарушение формирования скелета, падение веса, снижение устойчивости к инфекциям.
-
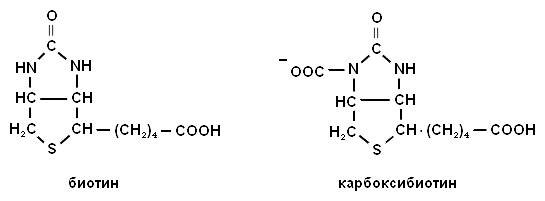
Витамин Н входит в состав кофермента карбоксибиотина.
Ответы на билет № 10
-
Витамин Н по химической природе является монокарбоновой кислотой гетероциклического строения. Гетероциклическая часть молекулы состоит из имидазольного и тиофенового циклов, а боковая часть представлена остатком валериановой кислоты.
-
-
Витамин В12 участвует в реакциях трансметилирования, перенос водорода и образовании углерод-водородных связей, перенос одноуглеродных фрагментов для синтеза пуриновых и пиримидиновых оснований.
-
При недостатке витамина В1 наступает полиневрит: дегенерация нервных окончаний, потери кожной чувствительности, нарушение сердечной деятельности, моторной и секреторной функции желудочно-кишечного тракта, паралич.
-
Витамин В3 образует коферментную форму КоА.
Ответ на билет № 11
-
Витамин РР – ниацин, никотиновая кислота и никотинамид, антипеллагрический, витамин В5.
-
-
Витамин D регулирует транспорт ионов кальция и фосфата через клеточные мембраны. Метаболит 1,25-диоксихолекальциферол участвует в регуляции образования белковых компонентов кальциевого насоса мембран.
-
При недостатке витамина Н возникает себорея: воспаление кожных покровов, выпадение волос, усиление выделения жира сальными железами.
-
Витамин Вс образует коферментную форму тетрагидрофолиевую кислоту.
Ответ на билет № 12.
-
Витамин В2 – рибофлавин, витамин роста.
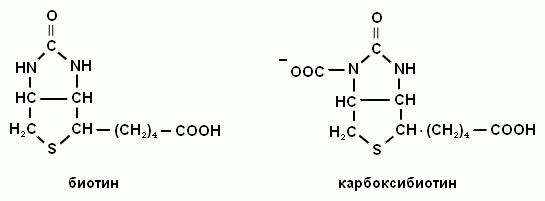
-
Ниацин – витамин В5 входит в состав НАД и НАДФ, участвует в окислительно–восстановительных реакциях. Никотинамидные кофермен-ты входят в состав ферментов, участвующих в реакциях лимоннокислого цикла, ß-окислении жирных кислот синтеза жирных кислот, синтеза холестерина и др.
-
При недостатке витамина В6 возникает повышенная возбудимость ЦНС, полиневриты, поражения кожи, стоматит, глоссит, конъюнктивит, анемия.
-
Витамин В1 образует коферментную форму тиаминпирофосфат.
Ответ на билет №13
-
Витамин В5, ниацин, никотиновая кислота и никотинамид, витамин РР, антипеллагрический.
-
-
Пантотеновая кислота входит в состав КоА, участвующего в лимоннокислом цикле, окислении жирных кислот, окислительном декарбоксилировании кетокислот синтезе стеридов, триглицеридов.
-
При недостатке витамина В12 наблюдается анемия гиперхромного типа, а также возникает гастрогенный В12 – авитаминоз, сопровождающийся злокачественной анемией.
-
Витамин К участвует в механизме свертывания крови, участвует в тканевом дыхании, фотосинтетическом фосфорилировании. Активирует кору надпочечников, гипофиз, щитовидную железу.
Ответ на билет № 14
-
Витамин В12 цианкобаламин, антианемический.
-
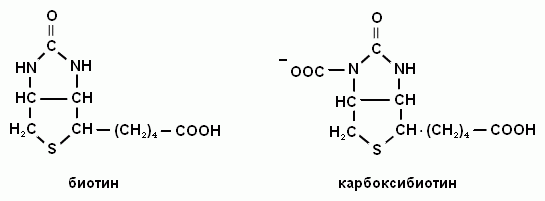
-
Пиридоксин входит в состав кофермента пиридоксальфосфата, который участвует в биохимических реакциях превращения аминокислот (реакции декарбоксилирования и переаминирования).
-
При недостатке витамина В1 возникает полиневрит: дегенерация нервных окончаний, потеря кожной чувствительности, нарушение сердечной деятельности, моторной и секреторной функции желудочно-кишечного тракта, паралич.
-
Витамин С участвует в окислительно-восстановительных реакциях, синтезе соединительной ткани, в обмене тирозина, гидроксилировании кортикостероидов, в обмене холестерина.
Ответ на билет № 15.
-
К витаминам повышающим общую реактивность организма относят В1, В2, В3, В5, А и С.
-
-
Витамин Р участвует в тканевом дыхании, воздействует на ферменты пролиноксидазу и др. Влияет на функционирование эндокринных желез. Оказывает антиоксидантное действие.
-
При недостатке витамина РР наблюдается пеллагра (поливитаминоз В5-В6 и триптофана); воспаление слизистых рта, языка, желудочно-кишечного тракта, дерматит, анемия, нарушение ЦНС.
-
Витамин В5 образует две кофермнтные формы НАД и НАДФ.
Ответ на билет № 16.
-
К витаминам, которые согласно их лечебно – профилактическому действию, используют как антианемические препараты относят В12, Вс, С.
-
Витамин А участвует в окислительно-восстановительных реакциях, влияет на проницаемость мембран, синтез кортикостероидов, мукополисахаридов, участвует в фоторецепции.
-
При недостаточном поступлении витамина В1 в организм наблюдаются полиневрит, дегенерация нервных окончаний, потеря кожной чувствительности, нарушение сердечной деятельности, моторной и секреторной функции желудочно-кишечного тракта, паралич.
-
По характеру действия различают конкурентные и неконкурентные антивитамины. Конкурентные антивитамины витамина В1 – окситиамин, антивитамин, разрушающий структуру витамина В1 – фермент тиаминаза (неконкурентный антивитамин).
Занятие № 9
Тема: Ферменты, строение и свойства. Изучение кинетических свойств, специфичности действия ферментов и модификаторов их активности.
Вопросы для самоконтроля усвоения основных понятий темы
БИЛЕТ № 1.
-
Разъясните понятие: аллостерический (регуляторный) фермент.
-
Укажите зависимость активности ферментов от pH среды.
-
Какие связи участвуют в образовании фермент-субстратного комплекса?
-
Что понимается под специфичностью действия ферментов? Перечислите виды специфичности действия ферментов.
-
Какова роль апофермента в ферменте-протеиде?
БИЛЕТ № 2.
-
Какие части фермента-протеида называются коферментом и апоферментом. Каковы их функции?
-
Какова зависимость скорости ферментативной реакции от температуры?
-
Приведите уравнение в общем виде, выражающее ферментативную реакцию.
-
Охарактеризуйте стереохимическую специфичность действия ферментов.
-
К какой группе ингибиторов относятся соли тяжелых металлов?
БИЛЕТ № 3.
-
Разъясните содержание понятия: мультиэнзимная система.
-
Опишите обратимое и необратимое ингибирование.
-
Охарактеризуйте процессы, происходящие в фермент-субстратном комплексе, способствующие преодолению энергетического барьера.
-
Как влияет на скорость ферментативной реакции концентрация фермента?
-
Какие общие свойства имеют фермент и неорганические катализаторы?
БИЛЕТ № 4.
-
Какие ферменты называются ферментами-протеинами?
-
Опишите аллостерическое активирование ферментов.
-
Назовите известную вам теорию, объясняющую механизм действия ферментов.
-
Назовите аминокислоты, участвующие в формировании активного центра ферментов.
-
Перечислите свойства ферментов, отличающие их от неорганических катализаторов.
БИЛЕТ № 5.
-
Какие соединения называются ферментами и какова их роль в организме?
-
Какова химическая природа ингибиторов ферментов? Приведите примеры.
-
Объясните, за счет чего с энергетической точки зрения происходит ускорение ферментативной реакции по теории Михаэлиса-Ментена.
-
Укажите оптимум pH действия ферментов.
-
Приведите примеры использования ингибиторов ферментов в качестве лечебных препаратов.
БИЛЕТ 6.
-
Какова химическая природа ферментов? На какие группы они делятся по своему химическому составу?
-
Какова химическая природа активаторов ферментов? Приведите примеры.
-
Укажите, в чем заключается механизм действия ферментов?
-
Перечислите виды специфичности действия ферментов.
-
Какие функции выполняет активный центр фермента? Какое он имеют строение?
БИЛЕТ № 7.
-
Какие ферменты называются ферментами-протеидами?
-
В чем заключается действие неконкурентных ингибиторов ферментов?
-
Должен ли фермент пространственно соответствовать субстрату для проявления своего действия?
-
Почему при высокой температуре прекращается каталитическое действие фермента?
-
Что понимается под специфичностью действия ферментов?
БИЛЕТ № 8.
-
Разъясните содержание понятий: кофермент, апофермент, простетическая группа.
-
В чем заключается действие конкурентных ингибиторов ферментов?
-
Что называется энергией активации? Как влияет на нее ферменты?
-
Перечислите факторы, влияющие на активность ферментов.
-
Дайте определение иммобилизованным ферментам. Как они применяются?
БИЛЕТ № 9.
-
Назовите известные вам номенклатуры ферментов-протеидов и их частей.
-
Какие вещества называются ингибиторами ферментов? На какие группы они делятся?
-
Что называется обратимостью действия ферментов.
-
Как влияет температура на скорость ферментативного катализа?
-
Как применяются иммобилизованные ферменты?
БИЛЕТ № 10.
-
Что называется субстратным центром фермента, чем он представлен?
-
Какие вещества называются активаторами ферментов? Приведите примеры.
-
Каков механизм действия ферментов согласно теории промежуточных соединений?
-
Активны ли порознь кофермент и апофермент? Какая часть является непосредственным исполнителем каталитической функции?
-
Назовите фермент, обладающий абсолютной специфичностью действия.
БИЛЕТ № 11.
-
Какие соединения могут выполнять роль коферментов в ферменте-протеиде?
-
Назовите свойства ферментов, отличающие их от небиологических катализаторов?
-
В чем сущность гипотезы Э. Фишера "Ключа и замка"?
-
Какова химическая природа активаторов ферментов?
-
Что называется аллостерическим центром фермента?
БИЛЕТ № 12.
-
Приведите доказательства белковой природы ферментов.
-
Какие свойства ферментов аналогичны свойствам неорганических катализаторов?
-
В чем сущность гипотезы «вынужденного соответствия» Кошланда?
-
Какова функция кофермента? Приведите примеры коферментов.
-
К какой группе ингибиторов относятся соли тяжелых металлов?
БИЛЕТ № 13.
-
Разъясните содержание термина: активный центр фермента. Какова его функция?
-
Укажите оптимум pH для большинства ферментов.
-
Охарактеризуйте относительную субстратную специфичность ферментов.
-
Какие методы используются для определения активности ферментов?
-
Зависит ли скорость ферментативной реакции от концентрации фермента и субстрата? В чем она проявляется?
БИЛЕТ № 14.
-
Разъясните понятие: изофермент.
-
Укажите зависимость скорости ферментативной реакции от концентрации субстрата.
-
Какие соединения называются ингибиторами и активаторами ферментов?
-
Что называется абсолютной групповой специфичностью фермента?
-
Что понимается под энергией активации?
БИЛЕТ № 15.
-
Как изменяется активность ферментов? Назовите единицу активности ферментов.
-
В чем заключается аллостерическое ингибирование ферментов?
-
Чем объясняется снижение энергии активации в ферментативной реакции?
-
Что называется коферментом и простетической группой в ферменте-протеиде?
-
Как применяются антиметаболиты?
БИЛЕТ № 16.
-
Что понимается под аллостерическим центром фермента?
-
К какой группе ингибиторов относятся соли тяжелых металлов?
-
Укажите виды специфичности ферментов. Охарактеризуйте абсолютную специфичность действия ферментов.
-
Приведите примеры соединений, которые могут выполнять роль кофакторов.
-
Дайте определение катала - единицы каталитической активности.
Ответы на контрольные вопросы
ОТВЕТЫ НА БИЛЕТ № 1.
-
Первый фермент мультиферментной системы, активность которого зависит от действия на него отрицательного модулятора (конечный продукт реакции) или положительного модулятора (субстрат данного фермента).
-
Наибольшая активность для большинства ферментов наблюдается в нейтральной зоне pH 7,0, а максимальная - обычно в их изоэлектрической точке.
-
Прикрепление субстрата к субстратному центру фермента идет за счет взаимодействия со второй аминогруппой остатка лизина или со второй карбоксильной группой глутаминовой кислоты, или с сульфгидрильной группой остатка цистеина.
-
Ферменты специфичны в отношении как типа катализируемой реакции, так и структуры субстратов, на которые они действуют. Различают абсолютную специфичность, абсолютную групповую, относительную групповую, стереохимическую.
-
Определяет специфичность действия ферментов.
ОТВЕТЫ НА БИЛЕТ № 2.
-
Кофермент - добавочная группа в ферменте-протеиде; апофермент - белковая часть такого фермента. Непосредственным исполнителем каталитической функции является кофермент. Апофермент резко повышает каталитическую активность коферментов и определяет специфичность на этапе фиксации субстрата.
-
Свойство ферментов изменять активность при изменении температуры получило название термолабильность ферментов. Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом. Для ферментов животного происхождения он лежит между 370 -400 C.
-
E + S ES ES' EP E + P;
К1 К2 К3
E + S ES E + P
-
Свойство ферментов катализировать реакции, идущие с отдельными стереоизомерами.
-
К неконкурентным ингибиторам, инактивирующим ферменты путем связывания функциональных групп ферментного белка.
ОТВЕТЫ НА БИЛЕТ № 3.
-
В клетке организма ферменты функционируют обычно в составе мультимерных систем или комплексов, катализирующих определенные последовательности биохимических реакций, образуя так называемые мультиэнзимные системы.
-
Конкурентные ингибиторы обратимо связываются с ферментом, поэтому действие их может быть устранено увеличением концентрации субстрата. Если при действии ингибитора образуется продукт, который не может отделиться от фермента, то такое состояние называют как необратимое ингибирование, или инактивирование.
-
1). Изменение электронной плотности комплекса, вызывающее поляризацию связей,
2). Геометрическая деформация, (напряжение отдельных связей), как в молекуле субстрата, так и в активном центре фермента.
-
Скорость реакции при низких концентрациях субстрата зависит от концентрации его и пропорциональна ей. С повывшением концентрации субстрата пропорциональность нарушается и при высокой концентрации исчезает, и зависит только от концентрации фермента.
-
Не расходуется в процессе катализа, действует в малых количествах, одинаково ускоряет обратимые реакции в обоих направлениях.
ОТВЕТЫ НА БИЛЕТ № 4.
-
Ферменты-протеины - это простые белки, т.е. не содержат добавочных небелковых компонентов.
-
Аллостерические активаторы присоединяются по аллостерическому центру фермента и изменяют третичную структуру белковой молекулы. В результате этого активный центр фермента приобретает наиболее выгодную для осуществления своих функций конфигурацию.
-
Теория промежуточных соединений Михаэлиса-Ментен (фермент-субстратных комплексов).
-
Серин, тирозин, триптофан, аспарагиновая и глутаминовая кислоты, лизин, гистидин, аргинин, цистеин.
-
Зависимость активности от pH среды, от температуры, от действия активаторов и ингибиторов, специфичность действия, высокая скорость катализирующего действия (эффективность), кооперативность и запрограммированность этапов действия.
ОТВЕТЫ НА БИЛЕТ № 5.
-
Специфические белки, входящие в состав клеток и тканей живых организмов, играющих роль биологических катализаторов.
-
Органические ингибиторы - аналоги пуриновых и пиримидиновых оснований, вещества белковой природы, неорганические - соли тяжелых металлов, цианиды, окись углерода.
-
С энергетической точки зрения, ускорение ферментативного процесса происходит за счет обхода энергетического барьера прямой реакции с помощью образования нестойкого фермент-субстратного комплекса, в процессе образования и распада которого промежуточные реакции имеют более низкий энергетический барьер, чем прямая реакция.
-
Оптимальная pH действия ферментов соответствует изоточке фермента.
-
Прозерин, физостигмин - конкурентные ингибиторы холинэстеразы; антиметаболиты - (5-фторурацил) - как противоопухолевые; антидепрессанты - ингибиторы моноаминоксидазы и др.
ОТВЕТЫ НА БИЛЕТ № 6 .
-
Белковую. Существуют ферменты-протеины (простые белки) и ферменты, содержащие кроме белковой части дополнительную небелковую группу (ферменты-протеиды).
-
Химическая природа разнообразна (ионы, соединения с SH-группами, желчные кислоты и др.). Наиболее часто - ионы двухвалентных и одновалентных металлов (магния, марганца, калия, кобальта, цинка, натрия).
-
Механизм действия ферментов заключается в снижении энергетического барьера реакции путем образования фермент-субстратного комплекса.
-
Абсолютная, абсолютная групповая, относительная субстратная (групповая), стереохимическая.
-
Часть молекулы ферментного белка с определенным сочетанием остатков аминокислот (серина, тирозина, триптофана, аспарагиновой и глутаминовой кислоты, лизина, гистидина, аргинина, цистеина), которая обеспечивает превращение субстрата. Формируется, когда белок находится в третичной структуре.
ОТВЕТЫ НА БИЛЕТ № 7.
-
Ферменты-протеиды - это сложные белки.
-
В связывании отдельных функциональных групп ферментов, имеющих значение для катализа. Это связывание прочное. Неконкурентное ингибирование не снимается добавлением субстрата.
-
Да.
-
При повышении температуры увеличивается подвижность реагирующих молекул. Однако, при температуре выше 60-70 С скорость реакции снижается из-за денатурации ферментативного белка, приводящего к потере каталитических свойств.
-
Ферменты специфичны в отношении как типа катализируемой реакции, так и структуры субстратов, на которые они действуют. Специфичность ферментов определяется их строением, наличием определенных групп, которые могут участвовать в образовании фермент-субстратных комплексов.
ОТВЕТЫ НА БИЛЕТ № 8.
-
Под коферментом подразумевают добавочную группу, легко отделяющуюся от апофермента (белковой части молекулы), обслуживающую два или несколько ферментов и способную к самостоятельному существованию. Простетическая группа - добавочная группа, прочно связанная с апоферментом.
-
В присоединении к ферменту ингибитора, близкого по структуре к субстрату, с образованием комплекса фермент-ингибитор, что приводит к снижению ферментативной активности.
-
Энергия, необходимая для запуска химической реакции, без которой реакция не начинается, несмотря на термодинамическую вероятность. Фермент способен ее снижать, что приводит к ускорению химической реакции.
-
Уровень биосинтеза в клетке, наличие факторов, изменяющих скорость ферментативной реакции (активаторы, ингибиторы и др.), локализация в клетке и проницаемость мембран для субстрата и продуктов реакции.
-
Иммобилизованные, т.е. связанные на различных носителях (стекло, целлюлоза, полиакриламид и др.). В результате создаются нерастворимые катализаторы, которые превышают стойкостью и длительностью действия обычные ферменты. Применяются в химической промышленности, медицине и др. областях. Пример - стрептодеказа, для лечения инфаркта миокарда, афинная хроматография - в химии.
ОТВЕТЫ НА БИЛЕТ № 9 .
-
Фермент-протеид или симплекс, или холофермент; белковый компонент или феррон, или апофермент; простетическая группа или агон, или кофермент.
-
Вещества, понижающие активность ферментов. На конкурентные и неконкурентные.
-
Способность одинаково ускорять как прямую, так и обратную реакцию называется обратимостью действия ферментов.
-
Скорость ферментативных реакции возрастает по мере повышения температуры (от 00 до 400 С). Однако, при температуре выше 600-700 С скорость реакции снижается из-за денатурации ферментативного белка, приводящего к потере каталитических свойств.
-
В медицине для лечения тромбозов (ферменты, иммобилизованные на антителах к коллагену, на гепарине); инфаркт миокарда - стрептодеказы. В химико-фармацевтической промышленности (синтез и анализ препаратов).
ОТВЕТЫ НА БИЛЕТ № 10.
-
Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение субстрата, он представлен аминокислотами лизином, цистеином, глутаминовой кислотой.
-
Вещества, увеличивающие активность ферментов: ионы многих металлов (магния, марганца, цинка, калия, натрия, кальция) - неорганические активаторы ферментов и органические активаторы - желчные кислоты, SH-соединения, белковые модуляторы.
-
Реакция между субстратом S и ферментом E идет в несколько стадий: E+SSE (фермент-субстратный комплекс) P + E (продукт реакции + фермент). Этим достигается прохождение реакции в мягких условиях в обход энергетического барьера.
-
Нет. Кофермент.
-
Уреаза - расщепляет мочевину и не действует на метилмочевину.
ОТВЕТЫ НА БИЛЕТ № 11.
-
Витамины или соединения, построенные с их участием, некоторые пептиды, нуклеотиды и их производные, фосфорные эфиры моносахаридов, липоевая кислота, ионы металлов.
-
Высокая скорость катализирующего действия (эффективность), специфичность действия, термолабильность, зависимость активности от pH среды, кооперативность и жесткая запрограммированность этапов действия, зависимость активности от активаторов и ингибиторов.
-
Согласно гипотезе Э.Фишера, фермент является жесткой структурой, активный центр которого представляет собой слепок субстрата. Если субстрат подходит к активному центру как ключ к замку, то реакция произойдет, если не подходит, то реакция не пойдет.
-
Активаторами ферментов могут быть ионы магния, марганца, цинка, натрия, кальция, кобальта, анионы - хлор, а также органические соединения - желчные кислоты, SH-соединения, белковые модуляторы.
-
Участок молекулы фермента, пространственно отделенный от активного центра, присоединение к которому определенного низкомолекулярного вещества (лиганда) ведет к изменению третичной структуры белковой молекулы.
ОТВЕТЫ НА БИЛЕТ № 12.
-
Способность к денатурации.
-
1) не расходуется в процессе реакции, 2) ускоряют эти реакции в малых количествах, 3) одинаково ускоряют обратимые реакции в обоих направлениях.
-
Согласно гипотезе Кошланда субстрат при взаимодействии с ферментом меняет конформацию его активного центра таким образом, чтобы обеспечить наилучшую адаптацию активного центра к субстрату.
-
Коферменты - непосредственные исполнители каталитической функции. Например, участвуют в переносе ряда групп, таких как ацильная, формильная, метильная; атомов водорода, например: НАД, ФАД, HS-KoA, ТПФ, ТГФК, и др.
-
К неконкурентным ингибиторам.
ОТВЕТЫ НА БИЛЕТ № 13.
-
В ферментах-протеинах активный (каталитический) центр представляет собой уникальное сочетание радикалов определенных аминокислотных остатков, входящих в состав полипептидной цепи фермента. В ферментах-протеидах роль активного центра выполняет добавочная группа (кофермент, простетическая группа). Активный центр осуществляет непосредственный контакт с субстратом.
-
Максимальная активность ферментов проявляется при рН, близкой к их изоточке.
-
Ферменты, действующие на определенный вид связи в субстратах, (эфирные, гликозидные и др.) обладают относительной субстратной (групповой) специфичностью.
-
Спектрофотометрические, флюориметрические, полярографические, колориметрические, монометрические и др.
-
Да. Скорость реакции при низкой концентрации субстрата зависит от его концентрации и пропорциональна ей. С повышением концентрации субстрата пропорциональность нарушается и при высокой концентрации исчезает, и зависит только от концентрации фермента.
ОТВЕТЫ НА БИЛЕТ № 14.
-
Изоферменты - это изомеры ферментов-мультимеров, составленных как правило, из субъединиц двух типов. В зависимости от соотношения этих субъединиц в мультимере, последний может существовать в виде нескольких изомеров.
-
Скорость реакции при низкой концентрации субстрата зависит от концентрации его и пропорциональна ей. При высоких концентрациях субстрата скорость реакции зависит только от концентрации фермента.
-
Вещества, понижающие активность ферментов, называются ингибиторами; вещества, повышающие активность - активаторами.
-
Свойство ферментов катализировать один тип реакции (например, дегидрогеназы).
-
Энергия, необходимая для запуска химической реакции, без которой реакция не начинается, несмотря на термодинамическую вероятность.
ОТВЕТЫ НА БИЛЕТ № 15.
1. Наличие фермента обычно распознается по проявлениям катализируемой им химической реакции; количество фермента можно определить путем измерения скорости этой реакции, т.е. о количестве фермента судят по его активности. За единицу активности фермента принят, катал (кат.) - количество фермента, которое катализирует превращение одного моля субстрата в секунду при 250 С в оптимальных условиях.
2. Аллостерические ингибиторы присоединяются по аллостерическому центру фермента и изменяют третичную структуру белковой молекулы. В результате этого субстратный, каталитический центры приобретают наименее выгодную для осуществления своих функций конфигурацию.
3. Путем образования фермент-субстратного комплекса, что приводит к ослаблению определенных связей в субстрате, и одновременно к активированию субстрата и повышению его реакционной способности.
4. Под коферментом подразумевают добавочную группу, легко отделяющуюся от апофермента (белковой части молекулы), обслуживающую два или несколько ферментов и способную к самостоятельному существованию. Простетическая группа - добавочная группа, прочно связанная с апоферментом.
5. Антиметаболиты широко используются в терапии ряда заболеваний. Так, аналоги пуриновых и пиримидиновых оснований (2-аминоаденин, 5-фторурацил) или аминокислот (фторфенилаланин) будучи введены в организм, могут приводить к синтезу таких нуклеиновых кислот и белков, метаболизм которых блокируется из-за нарушения структуры или отсутствия ферментов в организме, способных катализировать их обмен. Эти антиметаболиты применяют при злокачественных новообразованиях.
ОТВЕТЫ НА БИЛЕТ № 16.
-
Аллостерический центр представляет собой участок молекулы фермента, пространственно отделенный от активного центра, присоединение к которому определенного низкомолекулярного вещества ведет к изменению третичной структуры молекулы.
-
Неконкурентных ингибиторов.
-
Абсолютная, абсолютная групповая, относительная групповая, стереохимическая специфичность. Абсолютная - когда фермент катализирует только одну реакцию превращения определенного вещества. Например, уреаза.
-
Никотинамидадениндинуклеотид (НАД), флавинадениндинуклеотид (ФАД), тиаминпирофосфат (ТПФ), тетрагидрофолиевая кислота (ТГФК), карбоксибиотин и др.
-
Катал есть каталитическая активность, способная осуществлять реакцию со скоростью равной 1 молю в секунду.
Занятие №10
Тема: Механизм действия ферментов. Номенклатура и классификация ферментов. Количественное определение активности альфа-амилазы в сыворотке крови унифицированным методом.
Вопросы для самоконтроля усвоения основных понятий темы
БИЛЕТ № 1.
-
Приведите классификацию ферментов. На чем она основана?
-
Какие ферменты катализируют реакции разрыва связей в субстрате без присоединения воды или окисления?
-
Приведите пример реакции, катализируемой гидролазой.
-
Приведите примеры использования ингибиторов ферментов в медицине.
-
Напишите формулу кофермента, образованного витамином В3. Какие реакции катализируются с участием данного кофермента?
БИЛЕТ № 2.
-
Каковы особенности ферментов – оксидоредуктаз?
-
Перечислите подклассы ферментов – трансфераз.
-
Приведите пример реакции, катализируемой изомеразой.
-
Приведите примеры использования ферментов для лечения заболеваний суставов.
-
Напишите формулу кофермента, образованного витамином В6. Какие реакции катализируются с участием данного кофермента?
БИЛЕТ № 3.
-
Какие реакции катализируют аэробные и анаэробрные дегидрогеназы?
-
Как зависит скорость ферментативной реакции от концентрации фермента и субстрата?
-
Приведите пример реакции, катализируемой ферментом класса трансфераз.
-
На чем основано применение ферментов для лечения вирусных заболеванией?
-
Напишите формулу кофермента А. Какой витамин входит в состав этого кофермента?
БИЛЕТ № 4.
-
Какие реакции катализируют ферменты класса трансфераз?
-
Как образуется название фермента?
-
Приведите пример реакции, катализируемой ферментом класса лигаз?
-
Что представляет собой иммобилизованные ферменты? Как они применяются?
-
Напишите формулу коферментов витамина В5. В состав ферментов какого класса входят эти коферменты?
БИЛЕТ № 5.
-
На чем основана современная классификация ферментов?
-
Какие реакции катализируют ферменты - лиазы?
-
Приведите пример реакции, катализируемой ферментом класса гидролаз.
-
Приведите примеры использования иммобилизованных ферментов.
-
Напишите формулу кофермента, образованного витамином В2.
БИЛЕТ № 6.
-
Охарактеризуйте класс оксидоредуктаз.
-
Перечислите факторы, влияющие на скорость ферментативной реакции.
-
Приведите пример реакции, катализируемой ферментом класса изомераз.
-
Охарактеризуйте понятие энзимодиагностика.
-
Напишите формулу кофермента, образованного витамином В1. В состав ферментов какого класса входит данный кофермент?
БИЛЕТ № 7.
-
Охарактеризуйте класс трансфераз.
-
Перечислите классы ферментов. Какой тип реакции определяет каждый класс ферментов?
-
Приведите пример реакции, катализируемой ферментом класса оксидоредуктаз.
-
Приведите примеры использования ферментов для лечения заболеваний желудочно-кишечного тракта.
-
Напишите формулу кофермента биотина. Какие реакции катализируют данный кофермент в составе фермента?
БИЛЕТ № 8.
-
Охарактеризуйте класс гидролаз.
-
Как образуется систематическое название фермента?
-
Приведите пример реакции, катализируемой ферментом класса трансфераз.
-
Приведите примеры использования ингибиторов ферментов в качестве лекарственных препаратов.
-
Напишите формулу НАД. В состав какого фермента входит этот кофермент?
БИЛЕТ № 9.
-
Охарактеризуйте класс изомераз.
-
Из чего складывается рабочее название ферментов?
-
Приведите пример реакции, катализируемой ферментом класс лиаз.
-
Приведите примеры использования ферментов как лекарственных препаратов.
-
Напишите формулу УДФ-глюкозы. В состав какого класса входит этот кофермент?
БИЛЕТ № 10.
-
Охарактеризуйте класс лигаз.
-
Какие ферменты катализируют окислительно-восстановительные реакции? Назовите представителей этого класса ферментов.
-
Приведите примеры использования коферментов в качестве лекарственных препаратов.
-
Приведите пример реакции, катализируемой ферментом класса гидролаз.
-
Напишите формулу ТГФК. В состав какого класса входит этот кофермент?
БИЛЕТ № 11.
-
На чем основана современная классификация ферментов? Перечислите классы ферментов.
-
Назовите особенности ферментов-оксиредуктаз.
-
Приведите пример реакции, катализируемой ферментом класса трансфераз
-
Перечислите коферменты лигаз.
-
Напишите формулу ФАД.
БИЛЕТ № 12.
-
Какие ферменты катализируют реакции изомеризации?
-
Перечислите подклассы ферментов класса трансфераз.
-
Приведите пример реакции, катализируемой ферментом класса лиаз.
-
Перечислите коферменты оксиредуктаз.
-
Напишите формулу глутатиона.
БИЛЕТ № 13.
-
Какие реакции катализируют ферменты-лигазы?
-
На какие группы делятся пептидгидролазы?
-
Приведите пример реакции, катализируемой изомеразой.
-
Перечислите коферменты трансфераз.
-
Напишите формулу ФАФС.
БИЛЕТ № 14.
-
Какие реакции катализируют ферменты-гидролазы?
-
Как образуется рабочее название фермента?
-
Приведите примеры реакции, катализируемой гидролазой амидиназой.
-
Приведите примеры использования коферментов в качестве лекарственных препаратов.
-
Напишите формулу ЦДФХ. Коферментом каких ферментов он является?
БИЛЕТ № 15.
-
Охарактеризуйте класс лиаз.
-
Назовите представителей оксиредуктаз.
-
Приведите пример реакции, катализируемой гликозидазой.
-
Назовите ферменты, используемые для лечения заболеваний желудочно-кишечного тракта.
-
Напишите формулу карбоксибиотина. В состав ферментов какого класса входит данный кофермент?
БИЛЕТ № 16.
-
Какие принципы положены в основу современной классификации ферментов?
-
Перечислите основные подклассы ферментов гидролаз.
-
Приведите пример реакции, катализируемой аминотрансферазой.
-
Приведите примеры использования ферментов как лекарственных препаратов.
-
Напишите формулу кофермента, образованного витамином В6.
Ответы на контрольные вопросы
ОТВЕТЫ НА БИЛЕТ № 1.
-
Систематическая классификация ферментов основана на типе катализируемой реакции и согласно этому ферменты подразделяются на 6 классов:
-
Оксидоредуктазы
-
Трансферазы
-
Гидролазы
-
Лиазы
-
Изомеразы
-
Лигазы.
-
Ферменты класса лиаз.
-
Пример реакции, катализируемой гидролазой – карбоксиэстеразой.
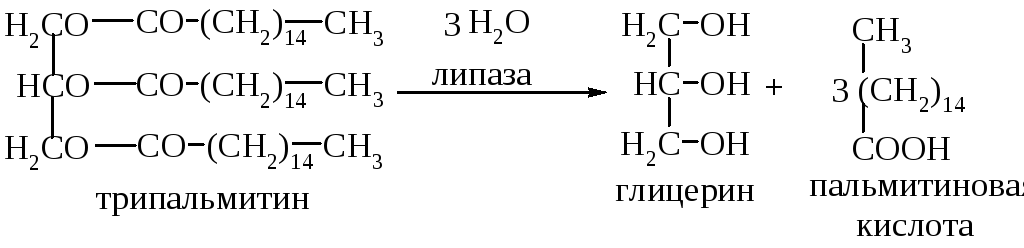
-
Теофиллин, дибазол, папаверин являются конкурентными ингибиторами фосфодиэстеразы цикло-АМФ; антидепресанты – ингибиторы моноаминооксидазы и др.
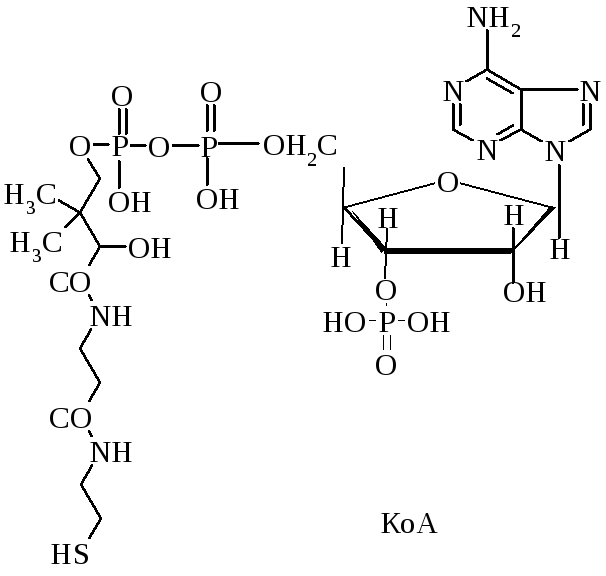
-
HS-КоА является коферментом ацилтрансфераз, переносит ацильные группы; в его состав входит витамин В3.
ОТВЕТЫ НА БИЛЕТ № 2
-
а). Ферменты оксидоректазы образуют ферментативные системы.
б). Многочисленность этих ферментов при ограниченном числе коферментов объясняется возможностью сочетания коферментов с различными апоферментами.
в).оксидоредуктазы ускоряют реакции окисления, которые сопровождаются образованием АТФ.
-
Фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы, метилтрансферазы и др.
-
Гиалуронидаза (в виде препаратов лидазы или ринидазы).
-

-
Пиридиксальфосфат является коферментом аминотрансфераз и декарбоксилаз аминокислот, участвующих в реакциях переаминирования и декарбоксилирования аминокислот.
-
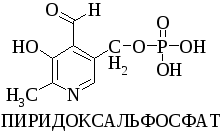
ОТВЕТЫ НА БИЛЕТ № 3.
-
Аэробные дегидрогеназы ускоряют перенос водорода или электронов на кислород. Анаэробные дегидрогеназы переносят водород или электроны от одного промежуточного продукта на другой, но не на кислород.
-
При низкой концентрации субстрата скорость реакции зависит от концентрации субстрата и пропорциональна ей. При высоких концентрациях субстрата скорость реакции зависит только от концентрации фермента.
-
-
Ферменты, ускоряющие распад нуклеиновых кислот, например, дезоксирибонуклеаза, применяются в лечении вирусных заболеваний.
-
Коэнзим А является коферментом ацилтрансфераз. Переносит ацильные группы; в его состав входит витамин В3
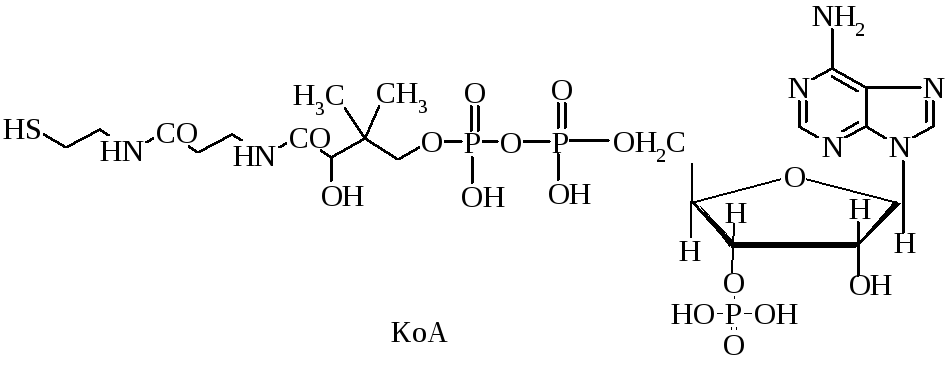
ОТВЕТЫ НА БИЛЕТ № 4
-
Ферменты, ускоряющие перенос различных атомных групп или остатков молекул от одного субстрата к другому.
-
Для индивидуального фермента в названии субстрата указывается тип химический реакции и прибавляется окончание «аза»; например, лактатдегидрогеназа. Если это система ферментов, то название основывается на катализируемой ею суммарной реакции и включается слово «система»; например, пирувадегидрогидрогеназная система.
-
Иммобилизованные, т.е. связанные на различных носителях (стекло, целлюлоза, полиакриламид и др.). В результате создаются нерастворимые катализаторы, которые превышают стойкостью и длительностью действия обычные ферменты. Применяются в химической промышленности, медицине и др. областях. Пример – стрептодеказа, для лечения инфаркта миокарда, афинная хроматография - в химии.
-
НАД является коферментом оксиредуктаз.
ОТВЕТЫ НА БИЛЕТ № 5.
-
Оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Классификация ферментов основана на типе реакции, катализируемых ферментами.
-
Ферменты – лиазы ускоряют реакции расщепления органических веществ без участия воды.
-
В медицине: для лечения тромбозов (ферменты, иммобилизированные на антителах к коллагену, на гепарине); инфаркт миокарда (стрептодеказа). В химико-фармацевтической промышленности: синтез и анализ ЛП.
4.
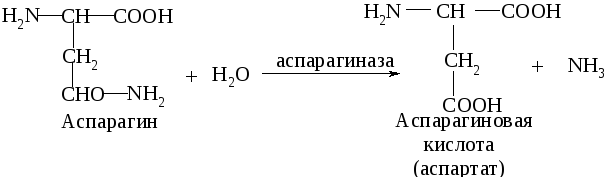
5.ФМН является коферментом дегидрогеназ. Переносит атомы водорода.
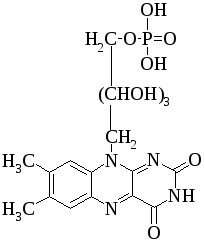
ОТВЕТЫ НА БИЛЕТ № 6.
-
Оксидоредуктазы ускоряют окислительно-восстановительные реакции, то есть переносят атомы водорода или электроны от окисляемого субстрата на восстанавливаемый.
-
Температура, рН среды, наличие активаторов или ингибиторов.
-

-
Это применение ферментов в диагностике болезней. Основывается либо на применении ферментных препаратов для определения содержания различных веществ в биологическом материале (крови, моче), либо на прямом определении самого фермента в биоматериале.
-
Т
 иаминпирофосфат
входит в состав декарбоксилаз кетокислот.
иаминпирофосфат
входит в состав декарбоксилаз кетокислот.
ОТВЕТЫ НА БИЛЕТ № 7.
-
Ферменты, ускоряющие перенос атомных групп или остатков молекул от одного субстрата на другой.
-
Оксидоредуктазы (окислительно-восстановительные реакции), трансферазы (перенос атомных групп), гидролазы (реакции гидролиза), лиазы (негидрилитический распад молекул), изомеразы (внутримолекулярные превращения), лигазы (синтез соединений).
-
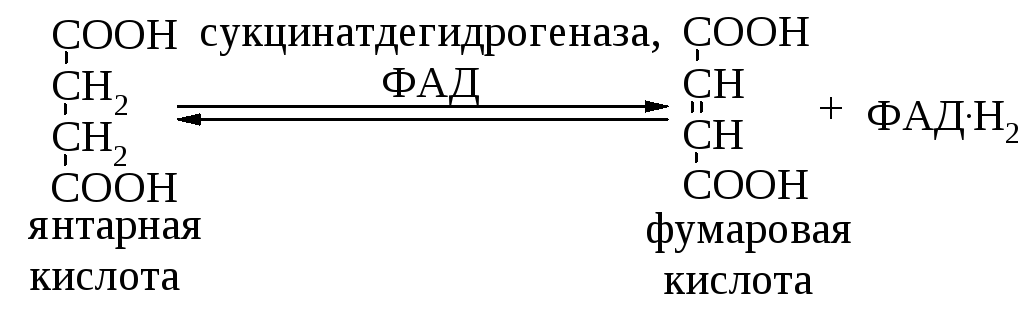
-
Пепсин, трипсин, панкреатин, химопсин.
-
Карбоксибиотин входит в состав ферментов, ускоряющих реакции карбоксилирования и перекарбоксилирования.

ОТВЕТЫ НА БИЛЕТ № 8.
-
Ферменты, ускоряющие реакции расщепления (а иногда и синтеза) различных связей органических соединений при участии воды.
-
Название субстрата, тип катализируемой реакции, кофермент. Например, L – лактат – НАД – оксидоредуктаза.
-
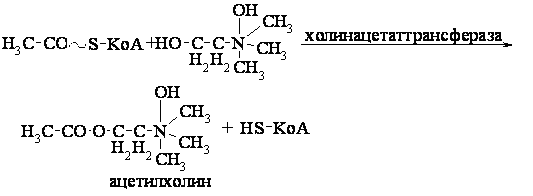
-
2-аминоаденин, 5-фторурацил, меркаптопурин. Эти антиметаболиты используются в лечении злокачественных новообразований.
-
НАД является коферментом дегидрогеназ. Переносит атомы водорода.

ОТВЕТЫ НА БИЛЕТ № 9.
-
Ферменты, ускоряющие реакции внутримолекулярных превращений.
-
Из названия субстрата и типа катализируемой реакции.

-
Например, как противовоспалительные средства – трипсин, коллагеназа, рибонуклеаза; как тромболитические – фибринолизин, тромболитин и др.
-
Уридиндифосфоглюкоза переносит остатки глюкозы при синтезе полисахаридов и олигосахаридов в составе ферментов – трансфераз.
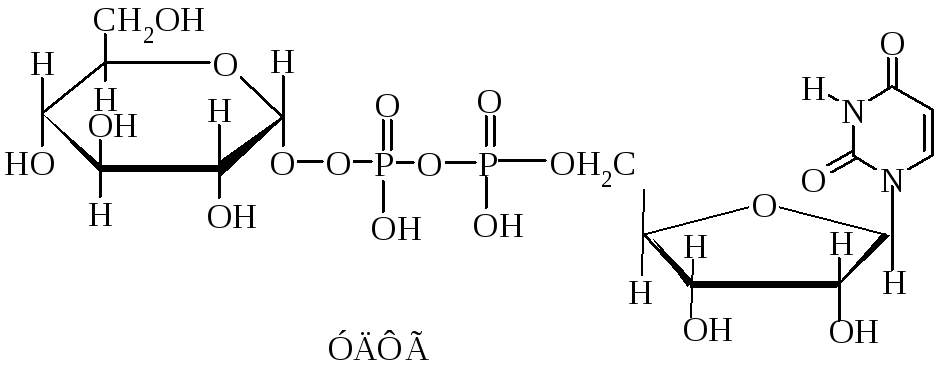
ОТВЕТЫ НА БИЛЕТ № 10.
-
Ферменты, которые ускоряют реакции синтеза органических соединений, требующие затрат энергии.
-
Ферменты – оксидоредуктазы (дегидрогеназы, оксидазы). Ксантиноксидаза, сукцинатдегидрогеназа, каталаза, цитохромы и др.
-
Тиаминпирофосфат, липоевая кислота, АТФ. Улучшая углеводный обмен, эти препараты показаны при поражениях печени, ацидозах, недостаточности кровообращения и т. д.
-
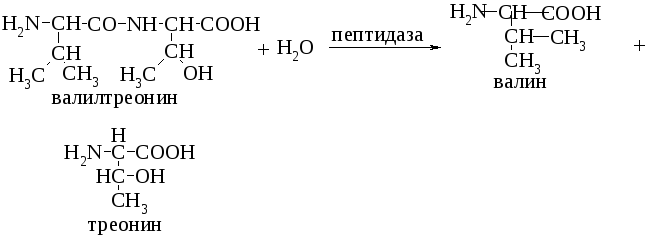
-
Т
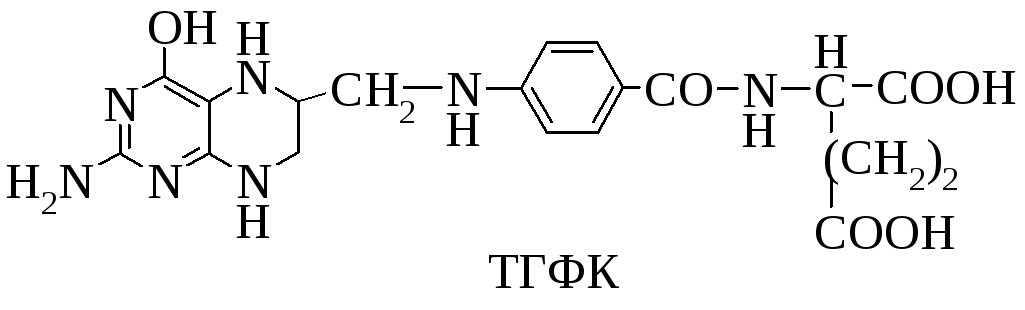 етрагидрофолиевая
кислота переносит одноуглеродные
радикалы, входит в состав трансфараз,
лиаз.
етрагидрофолиевая
кислота переносит одноуглеродные
радикалы, входит в состав трансфараз,
лиаз.
ОТВЕТЫ НА БИЛЕТ № 11.
-
Современная классификация основана на типе катализируемых реакций. Оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы).
-
А). Ферменты – оксидоредуктазы образуют ферментные системы;
Б). Многочисленность этих ферментов при ограниченном числе коферментов объясняется возможностью сочетания одних и тех же коферментов с различными апоферментами;
В). Оксидоредуктазы катализируют реакции окисления, которые сопровождаются образованием АТФ.
-
Пример гликозилтрансферазной реакции:
-
Уридиндифосфоглюкоза (УДФГ), цитидиндифосфохолин (ЦДФХ), карбоксибиотин, тетрагидрофолиевая кислота (ТГФК).
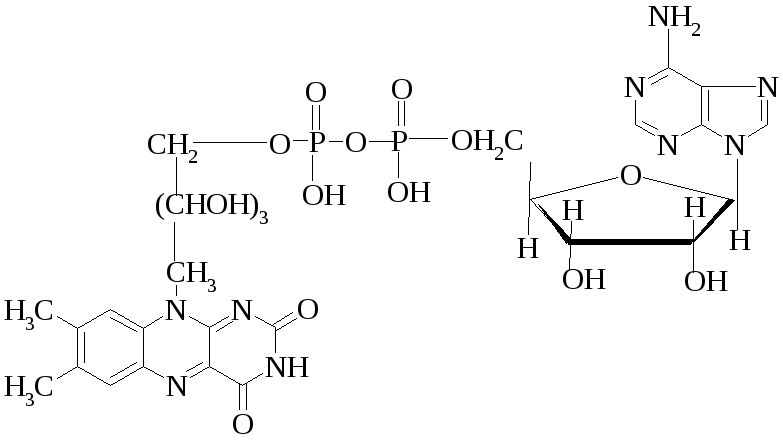
-
ФАД является коферментом дегидрогеназ, переносит атомы водорода.
ОТВЕТЫ НА БИЛЕТ № 12.
-
Ферменты, ускоряющие внутримолекулярные превращения субстратов.
-
Фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы, метилтрансферазы и др.
-
П
 ример
реакции, катализируемой С–О – лиазой
ример
реакции, катализируемой С–О – лиазой
-
НАД, НАДФ, ФАД, ФМН, гемы a, b, c, d, убихинон, глутатион, липоевая кислота.
-
H
 S-глутатион
переносит водородные атомы.
S-глутатион
переносит водородные атомы.
ОТВЕТЫ НА БИЛЕТ № 13.
-
Ферменты – лигазы ускоряют реакции синтеза органических соединений, требующие затрат энергии АТФ.
-
На пептидазы и протеиназы. Различают сериновые протеиназы. HS-протеиназы, кислые протеиназы, металлопротеиназы.
-

-
Пиридоксальфосфат, HS-KoA, УДФГ, ЦДФХ, ТГФК, метилкобаламин.
-
Кофермент переносит остаток серной кислоты.
ОТВЕТЫ НА БИЛЕТ № 14.
-
Гидролазы ускоряют реакции гидролиза органических соединений.
-
От названия субстрата и типа катализируемой реакции, например, лактатдегидрогеназа.
-
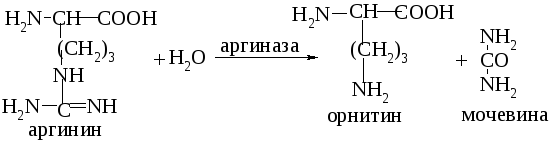
-
Тиаминпирофосфат (кокарбоксилаза), липоевая кислота, АТФ.
-
Цитидиндифосфохолин переносит остатки фосфохолина при синтезе фосфолипидов, является коферментом трансфераз.
-
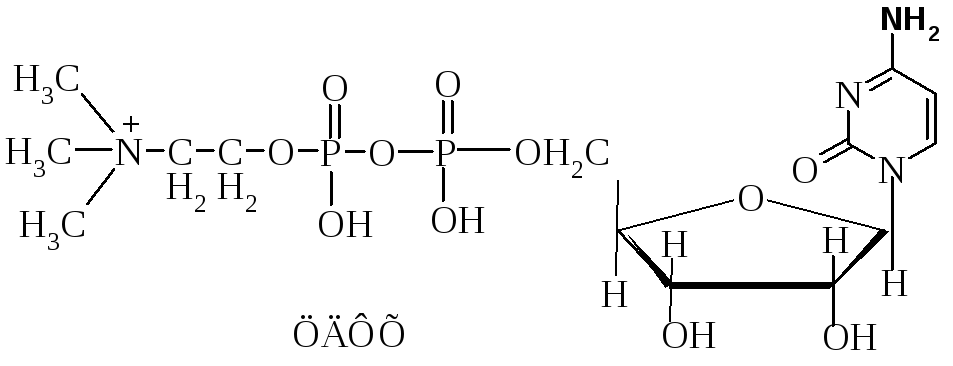
ОТВЕТЫ НА БИЛЕТ № 15.
-
Ферменты, которые катализируют реакции расщепления органических веществ без участия воды.
-
Всего 17 подклассов. Цитохромы, каталаза, пероксидаза, сукцинатдегидрогеназа и др.
3 .
.
-
Пепсин, трипсин, химотрипсин, панкреатин и др.
-
К
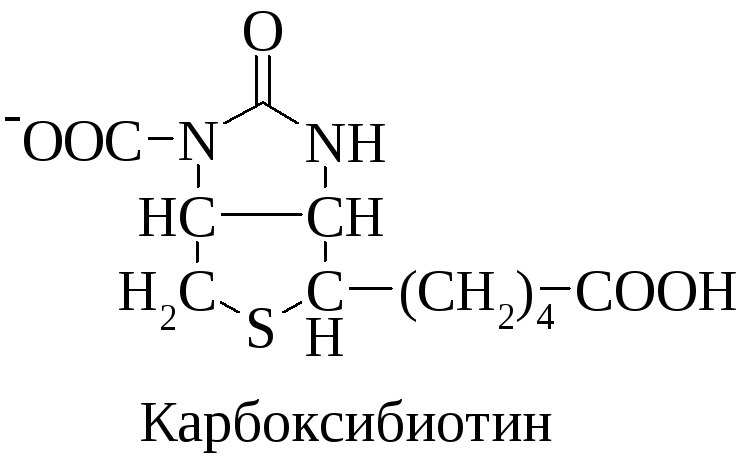 арбоксибиотин
входит в состав ферментов класса лигаз,
участвует в переносе карбоксильных
групп.
арбоксибиотин
входит в состав ферментов класса лигаз,
участвует в переносе карбоксильных
групп.
ОТВЕТЫ НА БИЛЕТ № 16
-
А). Название фермента, оканчивающегося на –аза должно употребляться только для индивидуального белка – катализатора, название мультиэнзима должно включать слово «система»;
Б). Классификация и номенклатура ферментов основывается на типе реакции, которую они катализируют;
В). Ферменты подразделяются на группы в соответствии с типом катализируемой реакции. Тип реакции в сочетании с названием субстрата служит основой для построения названия фермента.
-
Эстеразы, гликозидазы, пептидгидролазы, амидгидролазы (амидазы, амидиназы) и др. всего 11 подклассов.
-

-
Например, для лечения ожогов и гноящихся ран применяются трипсин, коллагеназа, рибонуклеаза. Это ферменты разрушают омертвевшие ткани.
-
Пиродоксальфосфат входит в состав аминотрансфераз.

