Белки —высокомолек.орган.соед,сост-е из остатков α-аминокислот.
В состав белков входят С, H, N, O, S. Часть б образует комплексы с другими молекулами, содержащими P, Fe, Zn и Cu.
Б обладают большой молек-ой массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000.
Ф-ии б в кл жив организ-ов более разнообразны, чем ф-и других биополимеров полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохим=их реакций и играют важную роль в обм в-в. Некоторые б выполняют структур или механ функцию, поддерживающий форму клеток.
Белки играют важную роль в живой природе. Белки — это биополимеры сложного строения, макромолекулы (протеины) которых, состоят из остатков ак, соединенных между собой (пептидной) связью.
Хим структуру пептидных цепей принято называть первичной структурой белка Для построения пространственной структуры белка пептидные цепи должны принять определенную, свойственную данному б конфигурацию, которая закрепляется водород связями, возникающими между пептидными группировками отдельных участков молекулярной цепи. По мере образования водородных связей пептидные цепи закручиваются в спирали, стремясь к образованию максимального числа водородных связей и соответственно к энергетически наиболее выгодной конфигурации.
Аминокисло́ты (аминокарбо́новыекисло́ты) — орг-е соед, в молекуле которых одновременно содержатся карбоксильные и аминные групп
Природные ак отвечают общей формуле RCH(NH2)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. \
Аминокислоты, содержащие неполярный радикал R. Такие группы располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
ак, содерж-е полярный неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
ак, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отриц-о заряженных групп. Такие ак содержат в боковом радикале дополнит-й основный или кислотный центр, который в водном растворе может соответ-о присоединять или отдавать протон.
Физ св-ва. По физ св-ам ак отличаются от соответствующих кислот и оснований. Все они кристал-ие ве-ва, лучше раствор-ся в воде, чем в орг раствори-ях, имеют достаточно высокие температуры плавления; многие из них имеют слад вкус. Эти св-ва отчётливо указывают насолеобразный характер этих соединений. Особенности физ и хим св-в ак обусловлены их строением — присутствием одновременно двух противоположных по свойствам функц-ых групп: кислотной и основной. α-аминокислоты являются амфотерными электролитами.
Хим. Наличие двух против-ых по св-ам функц-ых групп (карбоксильная группа и аминогруппа) в молекулах аминокислот придаёт им амфотерные свойства (свойства и кислоты, и основания). Так, ак вступают в хим реакцию с основаниями и спиртами, при этом образуются химсоединения, аналогичные продуктам реакции карбоновых кислот со щелочами и спиртами - соли и сложные эфиры. Как основания, ак легко взаимодействуют с кислотами при этом образуются соли. ак могут взаимодействовать и друг с другом. В результате реакции могут образовываться соед-ия с большим числом ак остатков - полипептиды. Группа атомов - CO - NH называется пептидной группой, а связь между атомами азота и углерода - пептидная связь или амидная связь. ак применяются в медицине: их прописывают больным и сильно и сильно ослабленным после тяжёлых операций и лечения, при заболеваниях желудочного тракта, а также нервных заболеваний. Аминокислоты используют в сельском хозяйстве в качестве добавки к корму животных.
3. Незаменимые аминокислоты
Лизин входит в состав практически любых белков. Лизин также понижает уровень триглицеридов в сыворотке крови. Эта ак оказывает противовирусное действие, особенно в отношении вирусов, вызывающих герпес .
Метионин оказывает выраженное антиоксидантное действие, так как является хорошим источником серы.. Помогает переработке жиров, предотвращая их отложение в печени и стенках артерий..
Треонин играет важную роль в образовании коллагена и эластина. Он повышает иммунитет, участвует в производстве антител.
Фенилаланин принимает активное участие в синтезе белков, повышает умственную активность, память.
Триптофан необходим для производства витамина B3. Триптофан снижает содержание жиров, образующих холестерин в крови, также обладает гипотензивным свойством, расширяя кровеносные сосуды.
Серотонин нормализует сон, стабилизирует настроение, снижает аппетит.
Валин необходим для восстановления поврежденных тканей и метаболических процессов в мышцах при тяжелых нагрузках и для поддержания нормального обмена азота в организме, оказывает стимулирующее действие. Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста.
Изолейцин необходим для образования гемоглобина, стабилизирует уровень сахара в крови, восстанавливает мышечные ткани, ускоряет процесс выработки энергии.
Аланин нормализует метаболизм углеводов. Аргинин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма.Стимулирует выработку гормона роста
Аспарагиновая кислота в организме присутствует в составе белков и в свободном виде. Играет важную роль в обмене азотистых веществ. Иммуномодулятор
Гистидин усиливает секрецию соляной кислоты и пепсина в желудке.
Глицин (аминоуксусная кислота) оказывает седативное действие, ослабляет влечение к алкоголю, оказывает положительное влияние при мышечных дистрофиях, уменьшает повышенную раздражительность, нормализует сон.
Пролин участвует в синтезе коллагена, восстанавливает структуру соединительной ткани
Тирозин является предшественником нейромедиаторов норадреналина и дофамина..
Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза.
Цистеин - серосодержащая ак играет важную роль в процессах формирования тканей кожи
.Цистеин помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации.
4. 1.Молекул масса б колеблется от 6000 до 1000000 и выше в зависимости от кол-ва отдельных полипептидных цепей в составе единой молекул структуры б. 1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз - под дей-ем раст-ов минер-ых к-от или ферм-ов происходит разрушение первичной структуры б и образ-ие смеси ак.
3. Денатурация - частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- высокой температуры
- растворов кислот, щелочей и концентрированных растворов солей
- растворов солей тяжёлых металлов
- некоторых органических веществ (формальдегида, фенола)
- радиоактивного излучения
4.Высаливание белков
Высаливанием называется процесс выделения белков из водных р-ов нейтральными растворами конц-ных солей щелочных . При добавлении больших концентраций солей к раствору б происходит дегидратация белковых частиц и снятие заряда, при этом б выпадают в осадок. Степень выпадения б в осадок зависит от ионной силы р-ра осадителя, размера частиц белковой молекулы, величины ее заряда, гидрофильности. Разные белки осаждаются при различных концентрациях солей. Поэтому в осадках, полученных путем постепенного повышения конц-ии солей, отдельные белки находятся в различных фракциях. Высаливание белков является обратимым процессом, и после удаления соли белок вновь приобретает природные свойства.
5)Методы выдел и очистки белков
позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных частицами набухшего геля из полимерных материалов . Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь б вносят в колонку с гелем и вымывают буферным р-ом. Бел-ые молекулы, не способные проникать в гранулы геля будут перемещаться с выс скоростью. Средние и небольшие б будут в той или иной степени удерживаться гранулами геля. Для отделения низкомолек-ых примесей или замены состава среды используют диализ. М-д основан на том, что молекулы белка из-за своих размеров не могут проходить через полупрониц-ые мембраны, в то время как низкомолек-ые в-ва равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего р-ра состав среды в диализном мешочке (концентрациясолей, величина pH и др.) будет тот же, что и в окружающем растворе.центрифугирование-
Частицы в растворе осаждаются когда их плотность выше плотности раствора, или всплывают), когда их плотность ниже плотности р-ра. Чем больше разница в плотности, тем быстрее идет распределение частиц. Когда плотности частиц и раствора одинаковые (изопикнические условия), частицы остаются неподвижными. При малой разнице в плотности частицы можно разделить только в центрифуге, которая создает центробежную силу, во много раз превышающую силу земного притяжения. Электрофоре́з белко́в — способ разделения смеси б на фракции или индивид-ые б, основанный на движении заряженных белковых макромолекул различного молекулярного веса в стационарном электрическом поле. Электрофорез белков применяют как для анализа компонентов смеси белков, так и для получения гомогенного белка.
6)Методы,позвол.Изучитьаминокисл.Состав белка
Чаще используются хроматографические методы.
Бумажная хроматография.Бумажная хроматография используется для идентификации компонентов смеси аминокислот с ди- и три-пептидами, получаемой при частичном гидролизе белков и полипептидов.
Гидролиз может быть осуществлен кислотным, щелочным или ферментативным методом. Кислотный метод используется чаще (6 н. HCl, 8 н. H2SO4). Гидролиз проводят при нагревании, иногда при повышенном давлении. Показателями окончания гидролиза могут служить: прекращение нарастания карбоксильных или аминных групп в гидролизате, либо отрицательная биуретовая реакция. По окончании хроматографии бумагу высушивают и обрабатывают проявителем (0,5% раствор нингидрина в смеси ацетон-ледяная уксусная кислота-вода) и нагревают в течение нескольких минут. ак проявляются в виде окрашенных пятен.Для ак с неразветвленной цепью величина подвижности несколько больше, чем для соответствующих изомеров. Введение в молекулу полярных групп снижает подвижность соединения. ак с объемными неполярными боковыми цепями (лейцин, изолейцин, фенилаланин, триптофан и др.) перемещаются быстрее, чем акс более короткими неполярными боковыми цепями (пролин, аланин, глицин) или с полярными боковыми цепями (треонин, аргини, цистеин, гистидин, лизин). Это обусловлено большей растворимостью полярных молекул в гидрофильной стационарной фазе и неполярных – в органических растворителях.
Для разделения и определения аминокислот может быть также использована тонкослойная хроматография.распределительная и адсорбционная
Ионообменная хроматография основана на обратимом стехиометрическом обмене ионов, находящихся в растворе, на ионы, входящие в состав ионообменника и на различной способности разделяемых ионов к ионному обмену с фиксир-ми ионами сорбента, образующимися в результате диссоциации ионогенных групп.
11. Шапероны и прионы, биол. значение.
Шапероны-мол. белки, кот.образуются в орг-ме чел при повышенной температуре и называются белки повышенного шока
В орг чел. эти б содержаться во всех структурных образоаниях клетки (ядро, цитоплазма и т.д.)
Классы: 1) шапероны-70: состоят из 1 полипептидной цепи, участвуют в защите полипептидной цепи и ее биосинтезе. 2) шапероны-60: состоят из 2 колец, в каждой по 7 субъединиц и по 3 домена. Участвуют в транспорте белковых молекул через биол-ие мембраны, участвуют в сворачивание белка
Прионы-особый класс белков, обладающих инфекционными свойствами и вызывающие определенные заболевания.
Могут содержаться в продуктах питания и синтезироваться в организме человека. Они образуются по схеме:
ДНК
(ген) мРНКбелок
прионовый белок
12. Группы сложных белков, принцип классификации.
Сложные белки – двухкомпонентные белки, состоящие из какого-либо простого белка и небелкового компонента (простетической группы). Классиф-ия сложных белков основана на хим. природе небелкового компонента. Различают фосфопротеины (содержат фосфорную кислоту), хромопротеины (содержат пигменты), нуклеопротеины (содержат нуклеинове кислоты), гликопротеины (содержат углеводы), липопротеины (содержат липиды) и металлопротеины (содержат металлы).
9.Структуры организации белка
Первичная структура
ак остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке. Линейную последовательность ак остатков в полипептидной цепи называют «первичная структура белка».
Перв структура каждого индивидуального белка закодирована в участке ДНК В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка
Является основополагающей структурой всех белков.
Вторичная структура белков — пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: а-спираль и Р-структура.
α-Спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток а-спирали приходится 3,6 аминокислотных остатка.
Примеры: глобулярные белки
β-Структура
β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями. β-Структура образует фигуру, подобную листу, сложенному «гармошкой», — β-складчатый слой.
Примеры :белки волос, мышц, шелка и других фибриллярных белков
Третичная структура белков — трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи, участвующие в формировании третичной структуры белков:
Гидрофобные взаимодействия
Ионные и водородные связи
Ковалентные связи
Примеры: гемоглобин,иммуноглобулин,лизоцим
Четвертичная структура белков
Количество и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков». Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
Примеры: гемоглобин,фосфорилаза.
10. 12 главных классов белков: 1) каталитически активные белки (ферменты); 2) белки-гормоны (хотя есть и стероидные гормоны); 3) белки-регуляторы активности генома; 4) защитные белки (антитела, белки свертывающей и антисвертывающей систем крови); 5) токсические белки; 6) транспортные белки; 7) мембранные белки; 8) сократительные белки; 9) рецепторные белки; 10) белки-ингибиторы ферментов; 11) белки вирусной оболочки; 12) белки с иными функциями.
Простые белки
Протамины и гистоны. Данная группа белков отличается рядом характерных физико-химических свойств, своеобразием аминокислотного состава и представлена в основном белками с небольшой молекулярной массой. Протамины обладают выраженными основными свойствами, обусловленными наличием в их составе от 60 до 85% аргинина. Так, сальмин, выделенный из молок семги, состоит на 85% из аргинина.
Гистоны также являются белками основного характера. В их состав входят лизин и аргинин, содержание которых, однако, не превышает 20—30%. Молекулярная масса гистонов намного больше нижнего предела молекулярной массы белков. Эти белки сосредоточены в основном в ядрах клеток в составе дезоксирибонуклеопротеинов и играют важную роль в регуляции экспрессии генов.
Альбумины и глобулины. Эти белки относятся к белкам, широко распространенным в органах и тканях животных. Наиболее богаты ими белки сыворотки крови, молока, яичный белок, мышцы и др. В плазме крови человека в норме содержится около 7% белков, представленных преимущественно альбуминами и глобулинами. Альбумины и глобулины—это глобулярные белки, различающиеся по растворимости
15) Нукл к-ты (ДНК и РНК) отн-ся к слож. высокомол. соед., сост. из небол. числа индивид.хим. компонентов более прост. строения. Так, при полном гидролизе нукл. к-т (нагрев. в присут. хлорной кислоты) в гидролизате обнаруживают пуриновые и пиримидиновые основания, углеводы (рибоза и дезоксирибоза) и фосфорную кислоту :ДНК-Фосф. к-та, дезоксириб,А, Г, Ц, Т.РНК-Фосф. к-та,рибоза,А,Г, Ц,У. В мол. ДНК углевод представлен дезоксирибозой, а в мол.РНК – рибозой, отсюда их названия: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК) кислоты. Кроме того, они сод. фосф. к-ту, по два пурин. и по два пиримид. основан.; различия только в пиримидиновых основаниях: в ДНК сод.тимин, а в РНК – урацил. В составе ДНК и РНК открыты так называемые минорные (экзотические) азотистые основания Углеводы (рибоза и дезоксирибоза) в молекулах ДНК и РНК находятся в β-D-рибофуранозной форме:
Основу
структуры пуриновых и пиримидиновых
оснований сост. 2 аромат. гетероцикл.
соед. – пиримидин и пурин :Структурные
формулы пиримидина и пурина![]() Мол. пурина состоит из двух конденсированных
колец: пиримидина и имидазола.В составе
нуклеиновых кислот встреч. 3 главных
пиримидиновых основания: цитозин,
урацил и тимин.
Мол. пурина состоит из двух конденсированных
колец: пиримидина и имидазола.В составе
нуклеиновых кислот встреч. 3 главных
пиримидиновых основания: цитозин,
урацил и тимин.![]()
![]()
Два пуриновых основания, постоянно встречающихся в гидролизатахнукл. к-т, имеют след.строение: Структурные формулы аденина и гуанина
![]()
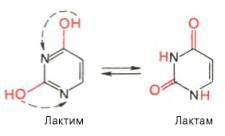
Одним из важных свойств свободных азотистых оснований (содержащих оксигруппы) является возможность их существования в двух таутомерных формах, в частности лактим- и лактамной формах, в зависимости от значения рН среды: при рН 7,0 они представлены в лактамной форме, при снижении величины рН – в лактимной форме. Таутомерные превращения можно представить на примере урацила. Оказалось, что в составе природных нуклеиновых кислот все оксипроиз-водные пуринов и пиримидинов находятся в лактамной форме.