
Intern (1) / 63
.docБилет 63.
Ответ 1.
Псевдоаллергические реакции в литературе еще называют «неспецифическими аллергическими реакциями», «неиммунологическими аллергическими реакциями», «ложной аллергией». В отличие от истинных аллергических реакций псевдоаллергические развиваются только в две стадии: патохимическую (биохимическую) и патофизиологическую. Первая стадия обусловлена неспецифическим освобождением медиаторов, прежде всего гистамина. В отличие от аллергических реакций псевдоаллергические реакции не имеют иммунологического механизма развития, а связаны с прямым действием лекарственных средств, рентгеноконтрастных веществ, плазмы крови, крово- и плазмозаменителей, местных анестетиков, ненаркотических анальгетиков на тучные клетки и освобождением гистамина и других медиаторов в кровь независимо от IgE, IgG и их рецепторов (путем энергетического обеспечения и ионов Са2+). Активация клетки происходит при фиксации липофильного участка молекулы либератора в мембране и взаимодействия либератора и клеточной мембраны, противоположно заряженных и отдаленных друг от друга. Цитостатическое (неселективное) высвобождение гистамина происходит вследствие повреждения клетки и сопровождается потерей внутриклеточного К+, лактатдегидрогеназы и снижением, а затем отсутствием мембранного потенциала. Один из важных механизмов развития псевдоаллергических реакций - активация системы комплемента, которая представляет собой систему сывороточных факторов, участвующих в реализации не только иммунных реакций, но и в ряде физиологических и патологических процессов. Неспецифическая активация комплемента, например, йодсодержащими веществами, может приводить к образованию промежуточных продуктов: С3а, С2а, С2b и др., которые вызывают высвобождение медиаторов из тучных клеток, базофилов, нейтрофилов и тромбоцитов (Лусс Л.В., 1994). Причиной развития псевдоаллергических реакций на введение производных пиразолона является нарушение метаболизма арахидоновой кислоты, связанное с угнетением активности циклооксигеназы и преимущественным образованием лейкотриенов. Лейкотриены C4, D4, E4 вызывают спазм гладкой мускулатуры, в том числе и бронхов, гиперсекрецию слизи, повышение проницаемости сосудистой стенки. Л.В. Лусс (1994) при клинико-иммунологическом и аллергологическом обследовании 775 больных с лекарственной аллергией выделил следующие факторы, способствующие развитию псевдоаллергических реакций на лекарственные средства: (1) полипрагмазия, особенно введение несовместимых препаратов, (2) наличие сопутствующих заболеваний желудочно-кишечного тракта, нейроэндокринной системы, обменные нарушения, (3) неадекватная терапия, (4)изменение рН среды и температуры растворов, вводимых парентерально. Врач, особенно общей практики, часто не имеет четких критериев дифференциальной диагностики аллергических и псевдоаллергических реакций. Современные методы диагностики (радио-, иммуноферментные и иммуносорбентные) дороги и технически сложны даже для аллергологических отделений. Поэтому врачам при проведении дифференциации аллергических и псевдоаллергических реакций приходится ориентироваться на простые и доступные критерии. ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ ПРИЗНАКИ АЛЛЕРГИЧЕСКИХ И ПСЕВДОАЛЛЕРГИЧЕСКИХ РЕАКЦИЙ НА ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА Аллергические реакции: • возраст – чаще до 30 лет; • пол – любой; • число препаратов – 1-2 (сходные по химической структуре); • зависимость от дозы – нет; • зависимость от способа введения – нет; • реакция на первое введение – нет; • реакция на повторное введение - всегда; • реакция на плацебо – нет; • сопутствующие заболевания – атопические; • эозинофилия – есть; • артериальное давление – снижение; • прямой базофильный тест Shelley с лекарствами – положительный при IgE-опосредованных реакциях; • специфические антитела – есть; • возможность пассивного переноса гиперчувствительности – есть. Псеводоаллергические реакции: • возраст – чаще после 30 лет; • пол – чаще женщины; • число препаратов – много, разные химические группы; • зависимость от дозы – есть (чем выше доза препарата, тем больше высвобождается из депо медиаторов и выше их концентрация в крови и тканях, тем тяжелее клиника псевдоаллергических реакций); • зависимость от способа введения – есть; • реакция на первое введение – есть; • реакция на повторное введение - не всегда; • реакция на плацебо – есть; • сопутствующие заболевания – заболевания желудочно-кишечного тракта, печени, нейроэндокринной системы; • эозинофилия – нет; • артериальное давление – не изменяется или повышается; • прямой базофильный тест Shelley с лекарствами – отрицательный; • специфические антитела – нет; • возможность пассивного переноса гиперчувствительности – нет.
К лекарственным средствам, способным провоцировать псевдоаллергические реакции (либераторам гистамина), относятся опиаты (опий, морфий, кодеин и др.), тубокурарин, полимиксин В, триметофан, десфера, ганглиоблокаторы. Они часто встречаются у пациентов с лекарственной и пищевой непереносимостью. В патогенезе псевдоаллргических реакций первостепенное значение придается состоянию желудочно-кишечного тракта, в частности дисбактериозу. Одной из главных причин дисбаланса кишечной флоры стало применение отдельных и повторных курсов антибиотикотерапии, лечение сульфаниламидными препаратами, цитостатиками, глюкокортикоидами, лучевой терапией. И.И. Михайлова и соавт. (1994) обследовав 115 пациентов аллергологического отделения возрасте 16 – 60 лет, выявили у 83% пациентов с аллергическими заболеваниями и у 90% пациентов с псевдоаллергией значительное снижение общнго количества кишечной палочки до 3 х 10*4 (при норме 3 х 10*8). Кроме того, отмечено значительное увеличесние роста гемолизирующей кишечной палочки до 63% по отношению к общему ее количеству, бактерий рода Клебсиелла до 35% (при полном отсутствии их в норме). !!! Такие изменения в составе кишечной микрофлоры и сдвиг в сторону роста бактерий с декарбоксилирующей активностью ведут к повышенному образованию биогенных аминов в организме в процессе расщепления соответствующих аминокислот: гитсамина из гистидина, тирамина из тирозина и фенилаланина и фенилэтиламина. Таким образом, отмечается корреляция меду аллергической и псевдоаллергической реакциями, с одной стороны и нарушением микроэкологии кишечника – с другой. Очевидно, дисбактериоз кишечника носит вторичный характер у пациентов с аллергическими заболеваниями, являясь следствием измененного иммунного ответа организма, протекает чаще бессимптомно и утяжеляет течение основного заболевания. Но нарушения кишечной микрофлоры, по-видимому, - первичный фактор, способствующий развитию псевдоаллергической реакции.
При оказании медицинской помощи больным с аллергическими реакциями необходимо придерживаться следующих подходов к их лечению: 1. При I типе аллергических реакций патогенетическое лечение достигается путем назначения антигистаминных, антисеротониновых препаратов и мембраностабилизаторов; при II и III типах используются антиферментные препараты и ингибиторы системы комплемента (эпсилон-аминокапроновая кислота, гепарин, глютаминовая кислота). 2. Для предотвращения патологического действия медиаторов аллергических реакций на клетки, ткани и органы назначаются бронхолитики, холинолитики, адреномиметики, спазмолитики. 3. Используются лекарственные препараты, подавляющие синтез антител и их взаимодействие с аллергеном (глюкокортикостероиды). 4. С помощью методов экстракорпоральной детоксикации организма, дезинтоксикационной терапии, энтеросорбции можно произвести элиминацию этиологически значимых аллергенов. 5. Осуществление симптоматических мероприятий.
Ответ 2.
Болезнь Ослера-Рандю-Вебера (син.: семейная наследственная телеангиэктазия; наследственная геморрагическая телеангиэктазия, геморрагический ангиоматоз) – наследственное заболевание, характеризующееся локальным расширением мелких сосудов (венул и капилляров) вследствие их структурной неполноценности и проявляющееся геморрагиями. Коагуляционный и тромбоцитарный гемостаз не нарушен. Первое описание болезни принадлежит Саттону (H.G. Sutton, 1864), которое было дополнено А. Рандю (H.J. Rendu, 1896), У. Ослером (W. Osler, 1901) и Вебером (F.P. Weber, 1907). Первоначально считалось, что данное заболевание встречается редко, но это предположение основывалось на степени частоты случаев с выраженными симптомами. С внедрением скрининговых программ признана более высокая частота заболевания без выраженных симптомов. Считается, что это заболевание встречается у 1 человека из 5-8 тыс. населения.
Этиология и патогенез недостаточно изучены. Геморрагическая телеангиэктазия – наиболее частая наследственная геморрагическая вазопатия, характеризующаяся очаговым истончением стенок и расширением просвета микрососудов, неполноценным локальным гемостазом из-за недоразвития субэндотелия и крайне малого содержания в нем коллагена. Поражаются капилляры и посткапиллярные венулы. Наличие телеангиэктазов определяется отсутствием в отдельных участках сосудов эластической мембраны и мышечных волокон, стенка состоит лишь из эндотелия. Нарушенное строение не позволяет сосудам сокращаться при повреждении, что и определяет кровоточивость. Наследуется по аутосомно-доминантному типу с разной степенью пенетрантности патологического гена в отдельных семьях. У большинства больных наблюдается гетерозиготная форма заболевания, гомозиготная форма встречается крайне редко. Для генерализованной формы болезни характерно расположение телеангиэктазий на слизистых и серозных оболочках, коже, во внутренних органах (легких, печени, селезенке, почках), в костях (чаще в позвонках). При гистологическом исследовании обнаруживают неправильной формы синусообразные расширения сосудов, истонченные стенки которых образованы эндотелиальными клетками и рыхлой соединительной тканью.
Клиническая картина. Телеангиэктазы кожи и слизистых встречаются более чем у 75% пациентов, обычно появляются позже, чем носовые кровотечения. Телеангиэктазы в раннем детском возрасте не видны и начинают формироваться лишь к 6-10 годам. В последующие десятилетия число и распространенность ангиэктазий возрастает, кровоточивость из них отмечается все с большей и большей частотой. В классическом описании W. Osler выделяется три типа телеангиэктазий: 1) ранний, в виде небольших неправильной формы пятнышек; 2) промежуточный, в виде сосудистых паучков; 3) поздний или узловатый тип, в виде ярко-красных или пурпурно-фиолетовых округлых узелков диаметром 5-7 мм, выступающих над поверхностью кожи или слизистой оболочки на 1-3 мм. У больных старше 25 лет часто обнаруживаются ангиэктазии двух или всех трех перечисленных типов. Все они отличаются от других образований тем, что бледнеют при надавливании и наполняются кровью после прекращения давления. Телеангиэктазии наиболее отчетливо проявляются в возрасте 40-50 лет. Они могут локализоваться на слизистой оболочке носа, губ, десен, языка, щек, на коже волосистой части головы, лица (особенно патогномоничны телеангиэктазии на крыльях носа и ушных мочках), конечностей, туловища, а также на конъюнктиве и под ногтями. Телеангиэктазии могут формироваться на слизистых оболочках в зеве, гортани, бронхах, на всем протяжении желудочно-кишечного тракта, в почечных лоханках и в мочевыводящих путях, во влагалище.
Характерен ангиоматозный тип кровоточивости из телеангиэктазов – весьма упорные кровотечения 1-2 локализаций (носовые, реже – гематурия, легочные и желудочно-кишечные). Частые, профузные, не связанные с внешними причинами носовые кровотечения, наблюдаются у 80% больных. Реже отмечаются кровотечения из желудочно-кишечного тракта, легких, почек, мочевыводящих путей, кровоизлияния в мозг, оболочки мозга, сетчатку. В детском, молодом возрасте заболевание чаще дебютирует носовыми кровотечениями. Кровотечения из желудочно-кишечного тракта чаще начинаются в возрасте 50-60 лет, при этом телеангиэктазы встречаются во всем ЖКТ, но чаще в желудке и двенадцатиперстной кишке.
В отдельных случаях врожденная неполноценность сосудов внутренних органов проявляется артериовенозными аневризмами (мальформациями), которые чаще всего локализуются в легких, реже – в печени, почках, селезенке, головном и спинном мозге. До 20% больных с болезнью Ослера-Рандю-Вебера имеют артериовенозные шунты в легких (по данным зарубежных авторов у 30% больных поражено легочное кровообращение, у 30% - печеночное, у 10-20% – церебральное, у 1-2% - спинальное). По опубликованным данным, у 2/3 больных с легочными артериовенозными аневризмами отсутствуют клинические проявления, указывающие на массивный сброс крови «слева направо». Эти артериовенозные аневризмы с трудом распознаются и часто трактуются как другие заболевания. Поражения печении в 3/4 случаев протекают бессимптомно. Церебральные артериовенозные аневризмы могут сопровождаться головными болями, эпилептическими припадками, ишемией окружающих тканей (синдром обкрадывания) или внутримозговыми кровотечениями.
Наиболее частым осложнением болезни Ослера-Рандю-Вебера является постгеморрагическая железодефицитная анемия, которая может достигать крайних степеней выраженности, сопровождаться тяжелой неврогенной симптоматикой, дистрофическими изменениями в органах (миокарде, почках, печени и др.). Вместе с тем при малой кровоточивости у больных иногда выявляются высокие показатели гемоглобина и эритроцитов (вторичная полиглобулия), чаще у больных с наличием в легких артериовенозного шунта. При этом рентгенологически в легких обнаруживаются очаговые затемнения, которые ошибочно трактуются как проявления хронической пневмонии, бронхоэктазии, туберкулеза легких, рака легких и т.д. Затем у таких больных развивается картина типичной легочно-сердечной недостаточности, которая становится причиной смерти. Гепатомегалия, спленомегалия, портальная гипертензия с признаками цирроза печени (ослеровский цирроз) выявляются у больных с обширным гемангиоматозным поражением печеночных сосудов.
Диагноз устанавливают при наличии классической тирады – кожных телеангиэктазий, наследственного характера заболевания и частых кровотечений. За рубежом разработаны современные международные критерии, которые основываются на 4 признаках: спонтанные периодические носовые кровотечения, слизисто-кожная телеангиэктазия, поражение внутренних органов и заболевание родственников 1-ой степени (близких родственников). Диагноз является «точным» при наличии 3 признаков, «вероятным» при наличии 2 признаков, «маловероятным» при наличии менее 2 признаков. Дифференциальный диагноз проводят с рядом наследственных, мягко протекающих коагулопатий, для которых характерны изменения коагуляционного и тромбоцитарного гемостаза, например с болезнью Виллебранда. Следует помнить о возможном сочетании наследственной геморрагической телеангиэктазии с болезнью Виллебранда.
Лечение симптоматическое. Для коррекции железодефицитной анемии показаны препараты железа, при более выраженной анемии – гемотрансфузии. При носовых кровотечениях производят переднюю и заднюю тампонаду полости носа с использованием различных гемостатических средств, прижигание слизистой оболочки носа кристаллической трихлоруксусной и хромовой кислотами, азотнокислым серебром, а также гальванокаустика и диатермокоагуляция. При тяжелых рецидивирующих носовых кровотечениях иногда рекомендуется перевязка верхнечелюстной, решетчатой, наружной сонной артерий. Успех хирургических методов ограничен из-за периодичности заболевания. Единственное лечение, эффективность которого подтверждается рандомизированными исследованиями, это использование женских гормонов у пациентов с сильной зависимостью от переливания крови.
Прогноз в большинстве случаев для жизни благоприятный. Случаи смерти от повторных кровотечений редки и составляют, по статистическим данным, около 4%. Среди причин смерти явно преобладают упорные кровотечения с тяжелой постгеморрагической анемией и сердечной недостаточностью. Смертность среди более молодых пациентов с наследственной геморрагической телеангиэктазией выше, чем среди пациентов в возрасте более 60 лет.
При лёгочном кровотечении:
Избегать резких движений, запретить ему говорить, приподнять головной конец кровати, ввести в/в 10 мл 10% раствора хлорида кальция если больной не получает гликозиды, 10 мл 10% раствора хлорида натрия 2—4 мл 12,5% раствора этамзилата, при возбуждении и сильном кашле — до 10—20 мг сибазона (диазепама) или 50 мг пропазина (2,5% 2 мл). При обильном легочном кровотечении больной находится в положении Тренделенбурга; в/в капельно (при систолическом давлении меньше 80 мм рт. ст. струйно) вводятся полиглюкин — до 10 мл/кг, физиологический раствор, сердечные и сосудистые средства — только при отсутствии эффекта от введения жидкостей.
При кровотечении из вен пищевода:
- Дицинон вводят в/в 2-4 мл 12,5% р-ра, затем через каждые 4-6 ч. по 2 мл. Можно вводить в/в капельно, добавляя к обычным растворам для инфузий. - 5% р-р эпсилон-аминокапроновой кислоты по 100 мл через каждые 4 часа; 5-10% р-р аскорбиновой кислоты по 1-2 мл в/в. - 10%раствор кальция хлорида до 50-60 мл/сутки в/в. - 1% или 0,3% р-ра викасола соответственно 1-2 и 3-5 мл. - Внутривенное введение Н2-блокаторов гистамина (ранитидина) по 50 мг 3-4 раза в сутки, фамотидин (квамател) по 20 мг 2 раза в сутки, ингибиторы протоновой помпы (омепрозол по 40 мг 1-2 раза в сутки).
Ответ 3.
Хрони́ческая боле́знь по́чек — повреждение почек либо снижение их функции в течение 3 месяцев и более.
Современная классификация основана на двух показателях — скорости клубочковой фильтрации (СКФ) и признаках почечного повреждения (протеинурия, альбуминурия). В зависимости от их сочетания выделяют пять стадий хронической болезни почек.
|
cтадия |
описание |
СКФ, мл/мин |
|
1 |
Признаки нефропатии, нормальная СКФ |
> 90 |
|
2 |
Признаки нефропатии, легкое снижение СКФ |
60 – 89 |
|
3 |
Умеренное снижение СКФ |
30 – 59 |
|
4 |
Тяжелое снижение СКФ |
15 – 29 |
|
5 |
Терминальная хроническая почечная недостаточность |
< 15 |
Стадии 3—5 соответствуют определению хронической почечной недостаточности (снижение СКФ 60 и менее мл/мин). Стадия 5 соответствует терминальной хронической почечной недостаточности (уремия).
Факторы риска развития ХБП
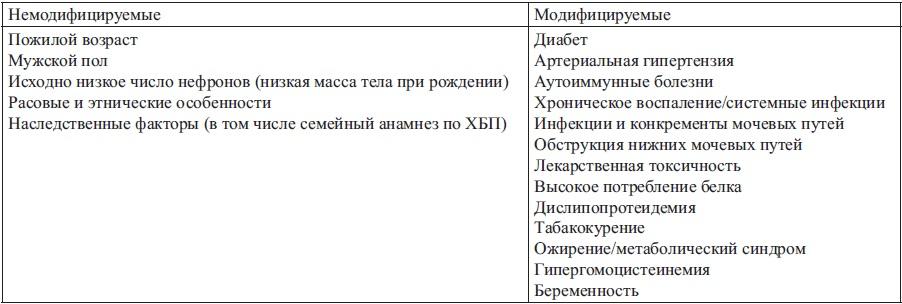
Факторы прогрессирования ХБП
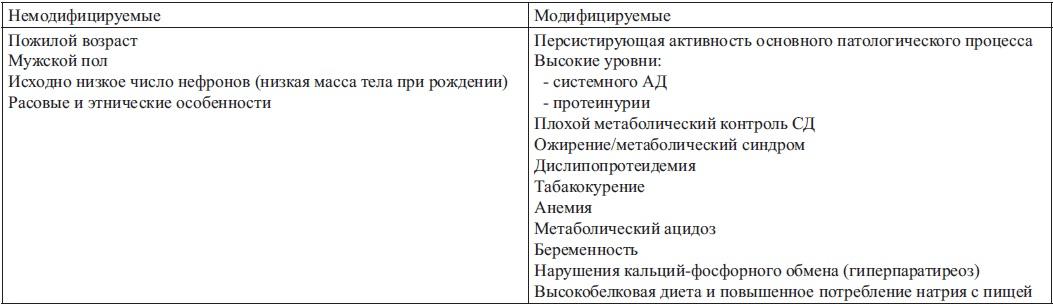
Основой первичной профилактики ХБП является устранение или минимизация факторов риска ее развития в соответствии с принципами доказательной медицины.
Подходы к первичной профилактике ХБП неотделимы от мероприятий по ее скринингу и выявлению факторов риска.Основой первичной профилактики ХБП являются диспансерное наблюдение представителей групп риска, разработка индивидуальных медицинских рекомендаций по контролю модифицируемых факторов риска и контроль за их выполнением.
Наличие ХБП следует считать важным независимым фактором риска развития и прогрессирования сердечнососудистых заболеваний. Пациенты с отсутствием традиционных факторов сердечно-сосудистого риска, но страдающие ХБП стадий С1‐С2 и альбуминурией А1 относятся к группе
среднего риска; пациенты с ХБП стадий С1‐С2 и альбуминурией А2‐А3 или ХБП стадии С3а,
независимо от уровня альбуминурии/протеинурии, относятся к группе высокого риска; пациенты с ХБП стадий С3б –С5 независимо от уровня альбуминурии/протеинурии и традиционных факторов риска принадлежат к группе очень высокого риска.22
Выраженность нарушения функции почек тесно связана с развитием сердечно‐сосудистых заболеваний. При этом даже умеренное снижение СКФ или появление сравнительно небольшой протеинурии/альбуминурии связано с нарастанием риска развития кардиоваскулярных заболеваний и сопровождается повышением уровня общей смертности.
Все это дает основания рассматривать пациентов с ХБП как самостоятельную важную группу сердечно‐сосудистого риска и требует тщательной стратификации таких больных. При этом при оценке степени сердечно‐сосудистых рисков следует пользоваться общепринятыми градациями.
Вторичная профилактика ХБП должна быть одновременно направлена на замедление темпов прогрессирования ХБП (ренопротекция) и предупреждение развития сердечно‐сосудистой патологии (кардиопротекция).
Рено‐ и кардиопротекция представляет собой двуединую задачу, требующую комплексного подхода,поскольку прогрессирующее снижение функции почек и развитие сердечно‐сосудистых осложнений тесно взаимосвязаны, и каждый из этих факторов имеет решающее значение для общего прогноза.Сердечно‐сосудистые осложнения являются основной причиной гибели пациентов с ХБП, в то же время почечная дисфункция и альбуминурия –важнейшие факторы сердечно‐сосудистого риска.
Общность причин (артериальная гипертония, нарушения углеводного, жирового, пуринового,фосфорно‐кальциевого обмена и др.) и механизмов прогрессирования (например, гиперактивация ренин‐ангиотензин‐альдостероновой системы, экспрессия медиаторов воспаления и факторов
фиброгенеза) поражения почек и сердечно‐сосудистой системы дает основание особо выделять методы профилактики, нелекарственного и лекарственного лечения с двойным положительным эффектом: рено‐ и кардиопротективным, что имеет большое значение для пациентов с ХБП. К ним относятся низкосолевая диета, борьба с ожирением и курением, коррекция нарушений углеводного обмена, лечение препаратами, подавляющими ренин‐ангиотензин‐альдостероновую систему (ингибиторы АПФ, блокаторы ангиотензиновых рецепторов, ингибиторы ренина), статинами,некоторыми антагонистами кальция и препаратами, улучшающими микроциркуляцию. Эффективность новых методов лечения пациентов с ХБП следует оценивать, в первую очередь, по их влиянию на комбинированный исход, включающий развитие ТПН и сердечно‐сосудистых осложнений.
Ответ 4.
Спазмолитики — лекарственные препараты, уменьшающие спазм гладкой мускулатуры.
Миотропные спазмолитики (папаверин, дротаверин, мебеверин,).
Дротаверин является производным изохинолина, проявляющим спазмолитическое действие на клетки гладкой мускулатуры ингибируя фермент фосфодиэстеразу IV (ФДЭ IV). Следствием этого является повышение концентрации цАМФ, что инактивирует лёгкую цепочку киназы миозин, что, в свою очередь, ведет к расслаблению гладких мышц.
Мебеверин Блокирует быстрые натриевые каналы клеточной мембраны миоцита и нарушает вход ионов Na+ в клетку, блокирует вход ионов Ca2+ через медленные каналы, замедляет процессы деполяризации мембраны и препятствует сокращению мышечных волокон.
Тримебутин – воздействует на энкефалинергическую систему ЖКТ. Нормализует тонус гладкой мускулатуры.
М-холиноблокаторы понижают тонус гладкой мускулатуры внутренних органов (ЖКТ, желчевыводящих путей, бронхов, сосудов), снижают секрецию НСl в желудке и других экскреторных желез (слюнных, слизистых, потовых), увеличивают ЧСС, вызывают мидриаз, паралич аккомодации и повышение внутриглазного давления.
Побочные эффекты: Головокружение, сердцебиение, потливость, чувство жара, аллергический дерматит (воспаление кожи).
Токсические эффекты: в больших дозах нарушает предсердно-желудочковую проводимость, снижает возбудимость сердечной мышцы, может вызвать остановку сердца и паралич дыхательного центра.
