
- •22 Российский химико-технологический университет им. Д.И. Менделеева
- •Содержание
- •1. Приближение Борна-Оппенгеймера. Молекулярная структура
- •Энергии реакций изомеризации (ккал/моль)
- •2. Метод Хартри-Фока для молекул
- •3. Приближение мо лкао. Уравнения Рутана
- •4. Электронная корреляция
- •5. Конфигурационное взаимодействие. Теорема Бриллюэна
- •6. Теория возмущений
- •7. Метод валентных связей. Понятие валентного состояния атома
- •8. Влияние учета электронной корреляции на точность расчета. Расчет энергии диссоциации химических связей
- •9. Иерархия методов квантовой химии
- •10. Неэмпирическая квантовая химия. Базисные функции для неэмпирических расчетов Вид аналитических базисных функций
- •Минимальный атомный базисный набор
- •Расширенный атомный базисный набор
- •Поляризационные и диффузные функции
- •Базисные наборы Попла
- •Роль базисных функций при описании свойств молекул
- •11. Полуэмпирическая квантовая химия
- •12. Полное пренебрежение дифференциальным перекрыванием
- •13. Принципы параметризации полуэмпирических методов
- •14. Методы, использующие частичное пренебрежение дифференциальным перекрыванием
- •17. Метод мо Хюккеля
- •18. Расширенный метод Хюккеля
- •19. Расчет свойств молекул
- •20. Точность квантово-химического расчета свойств молекул
- •Литература
22 Российский химико-технологический университет им. Д.И. Менделеева
|
|
Цирельсон В.Г. Бобров М.Ф. |
Раздаточный материал к лекциям по квантовой химии
Содержание
|
Введение…………………………………………………………………… |
2 |
|
2 |
|
6 |
|
8 |
|
11 |
|
12 |
|
13 |
|
14 |
Расчет энергий диссоциации химических связей |
15 |
|
16 |
|
17 |
|
11. Полуэмпирическая квантовая химия……………………………..……… |
23 |
|
12. Полное пренебрежение дифференциальным перекрыванием |
25 |
|
13. Принципы параметризации полуэмпирических методов……………….. |
28 |
|
14. Методы, использующие частичное пренебрежение дифференциальным перекрыванием ……………………………………………...……………… |
30 |
|
15.Разделение - и -электронов. -электронное приближение………… |
33 |
|
16.Метод Парризера-Попла-Парра…………………………………...……… |
35 |
|
17.Метод МО Хюккеля………………………………………………..……… |
36 |
|
18.Расширенный метод Хюккеля……………………………………………… |
37 |
|
19.Расчет свойств молекул…………………………………………………….. |
38 |
|
20.Точность квантово-химического расчета свойств молекул |
46 |
|
Литература…………………………………………………………………... |
|
Введение
Квантовая химия рассматривает молекулу как образование из электронов и точечных ядер с целочисленными массами и зарядами. Энергия молекулы имеет составляющие, связанные как с кинетическими энергиями каждого электрона и ядра, так и с парными энергиями их кулоновских взаимодействий (Табл.1).
Таблица 1.Составляющие энергии молекулы HF
(равновесная геометрия, неэмпирический расчет в базисе 6-31G**)
|
составляющие энергии |
значение энергии (атомные единицы) |
вклад в полную энергию |
|
кинетическая энергия электронов Tэ |
99.8688 |
-100% |
|
электрон-ядерное притяжение Vэя |
-250.7302 |
251% |
|
электрон-электронное отталкивание +обмен |
45.5611 |
-46% |
|
ядер-ядерное отталкивание Vяя |
5.2887 |
-5% |
|
полная энергия |
-100.0117 |
100% |
Не зависящее от времени нерелятивистское уравнение Шредингера:
Н точн ({r, R})=Е точн ({r, R}). (1)
H - молекулярный гамильтониан, точн({r,R}) – точная молекулярная волновая функция,
E - полная энергия молекулы, {r, R} - совокупность координат всех электронов и ядер, соответственно.
Нерелятивистский гамильтониан молекулы (М ядер и N электронов):
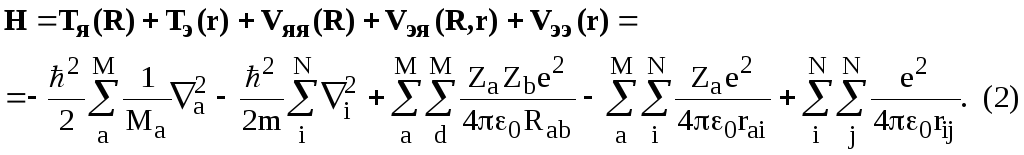
Индексы
i, j относятся к электронам, a и b - к ядрам,
Mа
и
m - массы ядер и электронов, Rab
- расстояние между ядрами, rai
- расстояние между ядром а
и электроном i,
rij
-
расстояние между электронами; операторы
i
и a
действуют на координаты электронов и
ядер, соответственно. Использована
атомная система единиц: е=1, m=1,
![]() =1,
=1,
![]() =1.
=1.
