Отчеты по лабораторным работам - 2003 / 2 / 1,5 - диоксинафталин
.docОтчет о лабораторной работе 2
студентов группы О-24
Полуэмпирический расчет молекулы 1,5 -диоксинафталина методом MNDO (МПДП).
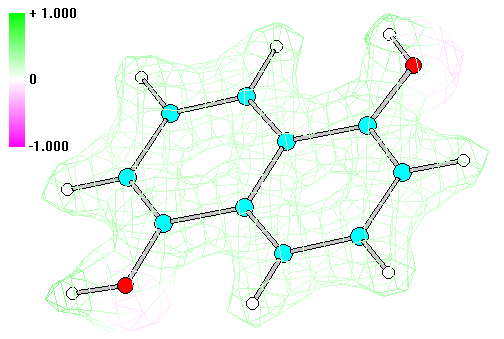
Общий вид молекулы Общий вид молекулы с нумерацией атомов
Цель работы. Знакомство с программным комплексом HyperChem 5.1. Проведение полуэмпирического квантовохимического расчета по методу MNDO с помощью программного комплекса HyperChem 5.1 и химическая интерпретация полученных результатов.
Интерпретация полученных результатов
1. Строение молекулы 1,5 -диоксинафталинa.
-
Длина связи
Данные ММ расчета, A
Данные MNDO расчета, A
C1-C2
1.343
1.401
C2-C3
1.338
1.418
C3-C4
1.339
1.384
C4-C5
1.346
1.436
C5-C10
1.353
1.438
C10-C1
1.352
1.455
C1-O11
1.362
1.360
O11-H19
0.969
0.945
средн. C-H
1.098
1.091
Точность проведенного расчета составляет 0.02 Å
2. Построение диаграммы энергетических уровней. Графическое изображение ВЗМО и НВМО.
Энергия ВЗМО (№30) -8.1694 эВ ; Энергия НВМО (№31) +0.4074 эВ
Энергетическая диаграмма

Вид ВЗМО Вид НВМО (HyperChem 5)
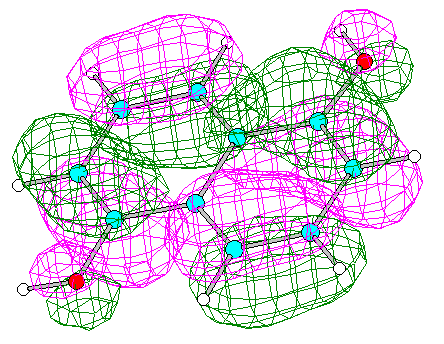
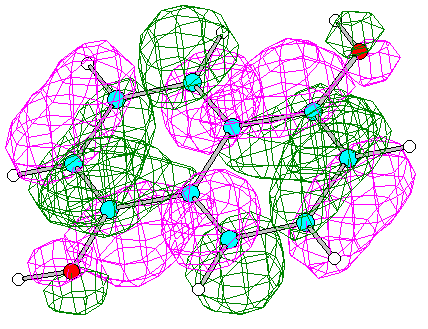
3. Вклады атомных орбиталей в ВЗМО и НВМО.
|
|
ВЗМО (HyperChem 5) |
НВМО (HyperChem 5) |
|
С1 Pz |
-0.39141 |
0.37958 |
|
С2 Pz |
0.30339 |
-0.29870 |
|
С3 Pz |
0.25773 |
-0.18322 |
|
С4 Pz |
0.41109 |
0.37329 |
|
С5 Pz |
-0.02791 |
-0.07229 |
|
O11 Pz |
0.25396 |
-0.12782 |
Положительные значения коэффициентов при атомных орбиталях дают связывающие вклады в МО, отрицательные значения - разрыхляющие вклады
4. Определение нуклеофильных и электрофильных свойств
Энергия НВМО положительна, следовательно 1,5 -диоксинафталин - нуклеофил
5. Построение распределения электростатического потенциала
|
|
Данный рисунок показывает области положительного и отрицательного распределения электростатического потенциала и визуализирует неподеленные электронные пары на атомах кислорода (красный цвет говорит об отрицательном значении потенциала). Это позволяет, например, сделать предположение о взаимодействии молекулы с растворителем. Очевидно, что катионы стремятся подойти к области отрицательного потенциала, анионы - к положительной области. |
6. Квантово-химическое обоснование модели резонансных структур.
В случае молекулы п-метоксифенола представляет интерес сравнить распределение заряда с классическими представлениями
|
|
C1 С2 С3 С4 С5 O11 |
0.106049 -0.080726 -0.042317 -0.051980 -0.022367 -0.251819 |
Наблюдаемое распределение зарядов согласуется с существующим представлением, что замещение бензола донорным заместителем приводит к возрастанию отрицательного заряда в орто- и пара- положениях, а замещение акцепторным заместителем приводит к возрастанию положительного заряда на атоме углерода, связанном с акцептором. Полученные результаты дают количественную оценку данного эффекта. |