
ЛАБОРАТОРНАЯ РАБОТА №1 по Квантовой Химии.
Неэмпирический квантовохимический расчет свойств молекулы формальдегида HCHO.
1. Цели и задачи расчета.
Цель расчета: Определение критериев выбора и изучение принципов построения стандартного базисного набора для расчета молекулярных систем. Изучение методов интерпретации результатов расчета и представления молекулы в виде вектора свойств на их основе. Знакомство с программным комплексом GAMESS.
Задача расчета: Выбрать наименьший из возможных оптимальный базис для неэмпирического расчета длин связей и валентных углов молекулы HCHO с по программному комплексу GAMESS с точностью порядка 0.01 Å для длин связей и 1 градус для валентных углов, сравнимой с экспериментальной. На основании результатов расчета оценить стабильность и факторы, определяющие реакционную способность этой молекулы.
2. ХАРАКТЕРИСТИКА И ОБОСНОВАНИЕ МЕТОДА РАСЧЕТА.
Расчет молекулы HCHO осуществлен по программному комплексу GAMESS в стандартном базисном наборе Попла 6-31G*. Этот базис является валентно-расщепленным. Валентные МО представлены линейными комбинациями 2 сжатых комбинаций гауссовых орбиталей, остовные МО – 1-й. На каждом неводородном атоме также центрировано по 6 компонент поляризационных d-функций. Таким образом, базис для расчета молекулы HCHO состоит из 34 функций:
2*H(2(1s)) +
1*C(1(1s) + 2*4(2s + 2p) + 6(3d)) +
1*O(1(1s) + 2*4(2s + 2p) + 6(3d)) = 34.
Все валентные базисные функции двухэкспоненциальные (6-31G*), остовные 1s МО - одноэкспоненциальны. s- и p-сжатия, соответствующие (с формальной точки зрения) одному главному квантовому числу n, свернуты в sp-оболочки [(2s + 2p), (3s + 3p)] и представлены различными линейными комбинациями гауссовых примитивов с одинаковыми экспонециальными множителями.
Каждая экспонента остовного сжатия представлена линейной комбинацией из 6 гауссовых примитивов (6-31G*). Каждая экспонента сжатия для валентных электронов представлена линейной комбинацией либо из 3 (6-31G*), либо из 1 (6-31G*) гауссовых примитивов.
Базис 6-31G* является наименьшим из возможных базисов для расчета длин связей и валентных углов молекулы HCHO с экспериментальной точностью. Добавление поляризационных d-функций (6-31G*) учитывает поляризацию «рыхлых» электронных оболочек атомов галогенов при образовании связей (обеспечивает уменьшение длины связей ~ 0.05 Å).
3. ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ РАСЧЕТА.
1. Оценка стабильности молекулы.
Энтальпия образования молекулы HCHO из простых веществ равна:
fH0 (HCHO) = E(HCHO) – 1/2E(C2) – 1/2E(O2)– 2/2E(H2) = -113.8663 - 1/2*(-75.379) - 1/2*(-149.533) - 2/2*(-1.127) = -0.2833 а.е. = -177.774 ккал/моль = -743.804 кДж/моль
Вывод: Молекула HCHO стабильна в стандартных условиях.
2. Свойства связей молекулы hcho.
Уточненная геометрия и порядки связей молекулы HCHO:
|
Связь Å порядок связи O=C 1.184 1.937 C-H 1.092 0.914 |
Валентный угол, град. O=C-H 122.15 |
Двухгранный угол: 180 град. (плоская молекула)
Обычно неэмпирические расчеты в базисе 6-31G* позволяют получить геометрию молекул, подобных исследуемой, с экспериментальной точностью. Аналогичной степени точности следует ожидать и для молекулы HCHO.
Валентность атомов по Коулсону в молекуле HCHO:
ATOM ВАЛЕНТНОСТЬ
1 O 1.960
2 C 3.764
3 H 0.925
Сопоставляя длину связей в молекуле HCHO с их порядком и валентностью атомов, можно сделать вывод: Связи в молекуле HCHO ковалентные.
3. Энергетическая диаграмма (а.е.):
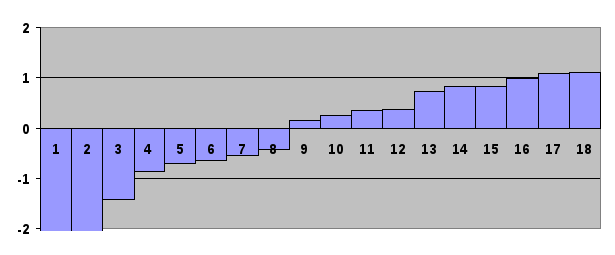
4.Определение нуклеофильных и электрофильных свойств молекулы HCHO.
Энергия НВМО (9) молекулы HCHO положительна (0.1458 а.е. ).
Вывод: Молекула HCHO нуклеофил.
5. Определение жесткости и мягкости молекулы.
Разность энергий НСМО и ВЗМО значительна.
Вывод: Молекула HCHO является жестким реагентом.
Жесткость молекулы HCHO:
=
![]() (ЕНВМО
– ЕВЗМО)
= 0.2907
а.е
(ЕНВМО
– ЕВЗМО)
= 0.2907
а.е
6. Определение положения реакционных центров.
Реакционная способность молекулы HCHO как жесткого реагента определяется зарядами на атомах. Распределение зарядов на атомах по Малликену следующее:
ATOM ЗАРЯД
1 O -0.415701
2 C 0.134646
3 H 0.140528
Максимальный отрицательный заряд на атомах O.
Вывод: Атомы O – наиболее вероятные центры электрофильной атаки.
7. Оценка растворимости.
