
Лабораторные работы / Лабораторные работы - 2003 / Отчёты / 2 / Хинон
.doc-
Отчёт по лабораторной работе №2
Студентов группы Мц-25
Полуэмпирический расчет молекулы хинона методом MNDO (МПДП).
О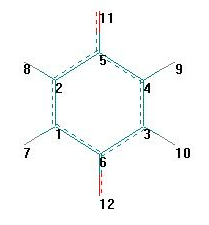
 бщий
вид молекулы Общий вид молекулы с
нумерацией атомов
бщий
вид молекулы Общий вид молекулы с
нумерацией атомов
Цель работы. Знакомство с программным комплексом HyperChem 5.1. Проведение полуэмпирического квантовохимического расчета по методу MNDO с помощью программного комплекса HyperChem 5.1 и химическая интерпретация полученных результов.
Интерпретация полученных результатов
1. Строение молекулы хинона.
|
Длина связи или валентный угол |
Данные ММ расчета |
Данные MNDO расчета |
|
12O-6C C6-C1 C1-H C1-C2 O12-C6-C1 C6-C1-C2 C6-C1-H7
|
1.21099 1.35569 1.10423 1.34127 121.954 121.951 119.103 |
1.22634 1.50122 1.09253 1.34933 122.13 122.13 116.848 |
Точность проведенного расчета составляет 0.02 Å для длинах связей и 3 для валентных углов.
2. Построение диаграммы энергетических уровней. Графическое изображение ВЗМО и НВМО.
Энергия ВЗМО (№20) -10.958 эВ ; Энергия НВМО (№21) -1.510 эВ
Э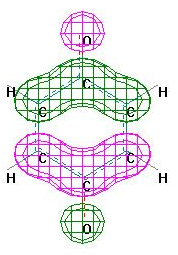
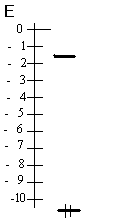 нергетическая
диаграмма Вид ВЗМО Вид
НВМО
нергетическая
диаграмма Вид ВЗМО Вид
НВМО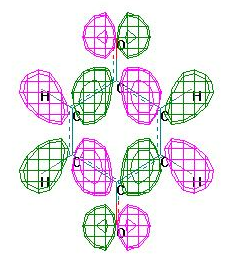
3. Вклады атомных орбиталей в ВЗМО и НВМО.
ВЗМО НВМО
Pz C 1 -0.00000 0.35757
Pz C 2 -0.00000 -0.35757
Pz C 3 -0.00000 0.35757
Pz C 4 -0.00000 -0.35757
Pz C 5 0.00000 -0.33663
Pz C 6 0.00000 0.33663
Pz O 11 0.00000 0.36191
Pz O 12 0.00000 -0.36191
Положительные значения коэффициентов при атомных орбиталях дают связывающие вклады в МО, отрицательные значения - разрыхляющие вклады
4. Определение нуклеофильных и электрофильных свойств
Энергия НВМО отрицательна, следовательно хинон - электрофил
5. Построение распределения электростатического потенциала
|
|
Данный рисунок показывает области положительного и отри-цательного распределения электростатического потенциала и визуализирует неподеленные электронные пары на атомах кислорода (красный цвет говорит об отрицательном значении потенциала). Это позволяет, например, сделать предполо-жение о взаимодействии молекулы с растворителем. Очевидно, что катионы стремятся подойти к области отрицательного потенциала, анионы к положительной области. |
6. Квантово-химическое обоснование модели резонансных структур.
В случае молекулы нитробензола представляет интерес сравнить распределение заряда с классическими представлениями
|
|
C1 С2 С3 С4 С5 C6 O11 O12 H9 H10 H7 H8 |
-0.0897 -0.0897 -0.0897 -0.0897 0.2679 0.2679 -0.2613 -0.2613 0.0864 0.0864 0.0864 0.0864 |
Хинон крайне химически активен и ведёт себя как непредельный кетон с сопряжённой системой связей С=С-С=О |
Примечание. Заряды приведены только для симметрично-независимой части молекулы


