
Джефферсон - Сборник упражнений и задач - 2000 / Student Guide7
.pdf
46 |
Глава 7: Получение энергии из пищи - Введение. |
Глава 7
Получение энергии из пищи. Введение.
Резюме главы
В этой главе обсуждается общая стратегия образования энергии из трех главных классов пищевых молекул: углеводов, жиров и белков. На примере окисления глюкозы рассмотрен главный метаболический путь образования энергии и сопоставлены три стадии этого процесса: гликолиз, цикл лимонной кислоты и транспорт электронов. Значение восстановленных коферментов NADH и FADH2 и роль окислительно-восстановительных потенциалов, Е0′ в определении энергетики реакции освещается с использованием уравнения Нернста. Л окализация в клетке этих трех стадий обсуждается вместе с механизмом, обеспечиваю щим поступление продуктов окисления жирных кислот и аминокислот в главный метаболический путь. Объясняется, почему одни организмы способны превращать ж ирные кислоты в глюкозу, а другие - нет.
Цели урока
♦Полная энергетика окисления глюкозы.
♦Три стадии образования энергии: гликолиз, цикл лимонной кислоты и транспорт электронов.
♦Направление переноса электронов в окислительной реакции.
♦Различие между окисленной и восстановленной формами двух кофакторов NADH и FADH2.
♦Значение атомов водорода в балансе восстановительных реакций кофакторов.
♦Количество и тип эквивалентов энергии, образующихся на каждой из трех стадий.
♦Влияние аэробных и анаэробных условий на кругооборот NADH особенно в мышцах.
♦Локализация цикла лимонной кислоты в клетке и особенность структуры мембран митохондрий.
♦Роль кофермента А как переносчика ацетильной группы.

Глава 7: Получение энергии из пищи - Введение. |
|
47 |
|
|
|
♦ Этапы, превращения пирувата в ацетил- |
♦ Химическая природа тиоэфирной связи. |
|
ÑîÀ. |
♦ |
Вычисление G 0′с использованием |
♦ Локализация электронтранспортной |
|
уравнения Нернста. |
системы в клетке. |
♦ Способ интеграции окисления жирных |
|
♦ Ðîëü Î2 è Í2О в транспорте электронов |
|
кислот и аминокислот в схему полного |
при окислении глюкозы. |
|
образования энергии. |
♦ Метод полуреакций и расчет величин |
♦ |
Взаимосвязь между |
сопряженной Е0′ èç |
|
взаимопревращением глюкозы и |
восстановительных потенциалов |
|
жирных кислот у различных |
полуреакции. |
|
организмов. |
Прогулка по главе
Общая стратегия запасания энергии
Энергия поставляется в результате окисления глюкозы в реакции, которая, по существу соответствует горению, поскольку окисляющим агентом служит кислород, а продуктами горения являются …………(1) и ………..(2). Реакция является крайне экзотермической ( G0′ составляет -2820 кДж . ìîëü-1). Весь процесс может быть разделен на три стадии: гликолиз, который происходит
â……………….(3) клетки, цикл трикарбоновых кислот (ЦТК), также известный как цикл Кребса или …….………………(4), протекающий внутри митохондрий эукариот, и транспорт электронов во ……..………….(5) митохондриальной мембране клеток эукариот.
Окисление представляет собой процесс ………………….(6). Как только молекула глюкозы окисляется, она теряет свои электроны, которые переносятся на …………..(7). Как только кислород принимает электроны из молекулы глюкозы, он восстанавливается до ………….(8). Перенос электронов с глюкозы на кислород происходит в серии последовательных этапов, в которых участвуют много промежуточных соединений - переносчиков электронов. Два из них - никотинамидадениндинуклеотид (NAD+) и флавинадениндинуклеотид (FAD) подробно обсуждаются
âэтой главе. Поскольку NAD+ - небольшая органическая молекула, участвующая в ферментативных реакциях, его называют коферментом. В этих реакциях NAD+ выполняет функцию переносчика электронов и претерпевает циклические редокс превращения, принимая (при восстановлении) и отдавая в процессе ………………..(9) два электрона. Электроны часто переносятся вместе с атомом водорода в виде так называемого гидрид-иона (Н-). Восстановленная форма этого кофермента, несущего гидрид-ион, записывается………………..(10). В химических реакциях ее сопровождает протон, NADH + H+, для уравновешивания двух водородов (один как H+, а другой как Н-), которые теряет окисляемое соединение. Принимая электроны, FAD превращается
в……………….(11), (также как и родственное соединение FMN, которое превращается в FMNH2). Эти переносчики электронов играют роль, подобно NAD+/NADH, но имеют некоторые важные отличия, которые станут более понятными позже.
48 |
Глава 7: Получение энергии из пищи - Введение. |
|
|
Ответы: (1) СО2; (2) Í2О; (3) цитоплазме; (4) цикл лимонной кислоты; (5) внутренней; (6) по тери электронов; (7) кислород; (8) Н2О; (9) окисления; (10) NADH; (11) FADH2.
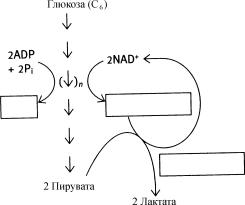
Гликолиз
Первый этап образования энергии из глюкозы - ………………….(1), - включает серию реакций, в которых шести-………………..(2) сахар расщепляется на две молекулы трехуглеродного метаболита ……………………(3). При этом происходит образование двух молекул …………….(4)
и двух молекул восстановленного кофермента…………….(5). Образующийся NADH должен превратиться обратно в NAD+ для продолжения цикла; при этом реализуется один из двух механизмов, в зависимости от обеспеченности …………..….(6). Когда кислород присутствует в достаточных количествах (……………(7) условия), эту функцию могут выполнять митохондрии эукариот. В том случае, когда кислорода мало или совсем нет (………(8) условия), что часто имеет место в мышечных клетках, пируват восстанавливается до ла ктата при участии фермента
……………..(9). О том, как образующийся лактат подвергается круго обороту в других метаболических процессах, будет сказано ниже.
Ответы: (1) гликолиз; (2) углеродный; (3) пирувата; (4) АТР; (5) NADH; (6) кислородом; (7) аэробные; (8) анаэробные; (9) лактатдегидрогеназы.
Заполните следующее
В клетках дрожжей в сходных анаэробных условиях из пирувата образуется ацетальдегид с последующим накоплением этанола в ходе процесса реокисления NADH до NAD+. Эта реакция известна как брожение. Если субстратное обеспечение гликолиза осуществляет гликоген, происходит образование трех молекул АТР, а не двух, как это имеет место в случае использования молекул глюкозы.
Глава 7: Получение энергии из пищи - Введение. |
49 |
Цикл лимонной кислоты
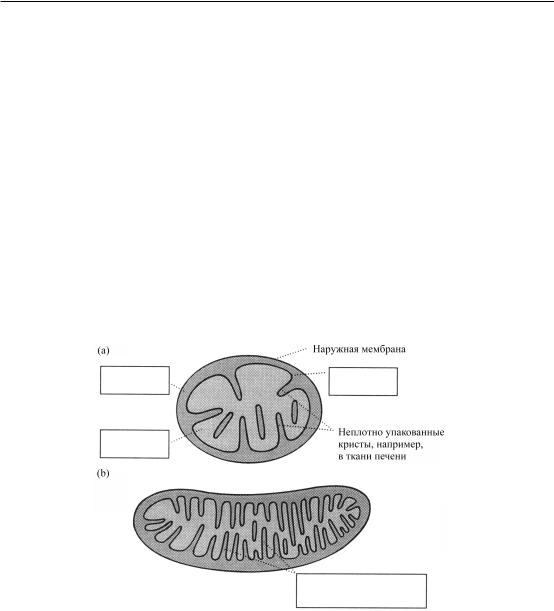
Вторая стадия окисления - глюкозы, цикл лимонной кислоты, - происходит в митохондриях, которые представляют собой органеллы с двойной мембраной, внутренней и наружной. Пируват, образующийся на первом этапе окисления глюкозы, проникает через внутреннюю мембрану митохондрий в матрикс.
Здесь пируват превращается в высокореакционноспособный метаболит ацетил-кофермент А (ацетил-СоА), который и поступает в ЦТК. Кофермент А является кофактором, несущим ацетильную группу, соединенную тиоэфирной связью (см. обзор по органической химии). Процесс превращения пирувата в ацетил-СоА, называемый окислительным декарбоксилированием, включает отщепление СО2 (декарбоксилирование), восстановление одной молекулы NADH и перенос образовавшейся ацетильной группы (полученной после декарбоксилирования пирувата) на коферментом А. ЦТК завершает окисление углеродов глюкозы до СО2 и в ходе этого процесса образуется три восстановленных молекулы NADH, одна восстановленная молекула FADH2 и одно высокоэнергетическое соединение фосфата на каждую ацетильную группу, поступающую в цикл.
Заполните следующее
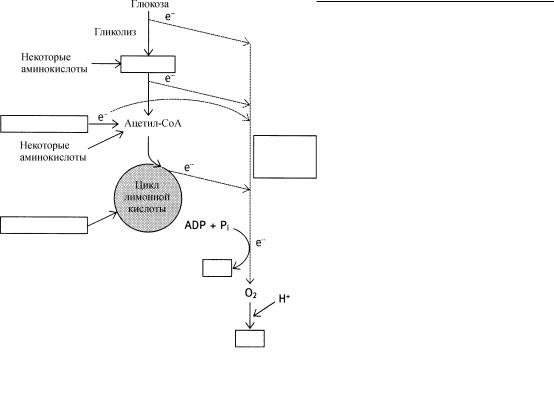
Транспорт электронов
Третья стадия образования энергии из глюкозы - перенос электронов электронтранспортной системой внутренней мембраны митохондрий на кислород. Полная реакция включает перенос электронов от восстановленных (несущих электрон) кофакторов (NADH и FADH2) на кислород (О2) с образованием воды. Реакции, принимающие участие в транс порте электронов, могут быть подразделены на полуреакции, характеризующие индивидуа льные этапы и отдельные реагирующие соединения, которые получают электроны от теряющих их реагентов. Каждая окислительновосстановительная реакция включает одну полуреакцию каждого типа.

50 Глава 7: Получение энергии из пищи - Введение.
Электрохимия (обзор)
За превращением энергии, связанной с этими отдельными и с уммарными этапами, можно следить, используя окислительно-восстановительный (редокс) потенциал, Е0′. Значения Е0′ могут быть приложимы как к отдельной реакции, в которой единственное соединение присоединяет или теряет электроны, так и к суммарной реакции, в которой участвуют два вещества, одно из которых теряет, а другое присоединяет электроны. На практике для сравнения значений Е0′ полуреакций используют реакцию, записываемую как восстановление; в ней единственное участвующее соединение присоединяет электроны и, следовательно, восстанавливается. При меньшем (более отрицательном) значении Е0′ (восст.) реагент имеет более низкое сродство к электрону, и вероятность того, что реакция восстановления произойдет, меньше. Поэтому, спонтанный перенос электронов (по шкале энергии вниз) происходит от никотинамидного кофактора с Е0′ (восст.) = -0,32 В на кислород с Е0′ (восст.) = 0,82 В, поскольку О2 имеет большее сродство к электронам, чем никотинамидный кофактор.
При вычислении изменения свободной энергии, связанной с таким транспортом электронов, используется уравнение Нернста вместе со значением Е0′, соответствующим сопряженным полуреакциям. Для этого добавляются значения Е0′ (восст.) для полуреакций, но с изменением знака величины Е0′ (восст.), соответствующей окислительной половине реакции. В реакции между никотинамидным кофактором NADH и кислородом О2 происходит окисление NADH, так что знак Е0′ (восст.) для этого соединения должен быть изменен перед его добавлением к величине Е0′
(восст.) для О2 полуреакции;
Å0′ = 0,32 Â + 0,816 Â = 1,136 Â.
Это положительное значение Е0′ для объединенных полуреакций дает сильно отрицательную (благоприятную) величину для G0′ в уравнении Нернста (-219,25 кДж . ìîëü-1). Описание способа определения Е0′ очень хорошо рассматривается в основном учебнике. Уравнение Нернста является математическим выражением, связывающим изменение редокс-потенциала электрохимической пары с изменением свободной энергии (и таким образом, с константой равновесия). Применение этого уравнения к переносу электронов от NADH на О2 показывает, что в ходе этого процесса выделяется большое количество энергии, которая высвобождается в серии реакций, сопряженных с образованием ATP из ADP и Рi.
Глава 7: Получение энергии из пищи - Введение. |
51 |
Заполните следующее
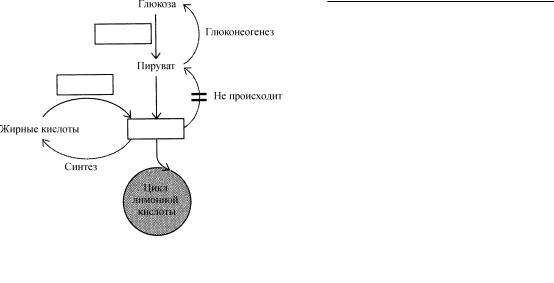
Роль жиров
Окисление жиров (главным образом жирнокислотной части ТАГ) и аминокислот с образованием АТР хорошо сопряжено с тремя стадиями окисления глюкозы. От …….……….(1), высвобождаемых из ТАГ, отщепляются два атома углерода и присоединяются к ………………..(2), поступающему в цикл лимонной кислоты. Превращение длинной углеродной цепи жирной кислоты в двухуглеродные фрагменты приводит также к образованию NADH и FADH2, поступающим в электронтранспортную стадию окисления глюкозы. Для окисления каждой из 20 аминокислот требуется реакция …………..……(3). Остающийся углеродный скелет (различный для каждой аминокислоты) превращается либо в пируват или ацетил-СоА , либо в другой промежуточный продукт цикла лимонной кислоты. То обстоятельство, что избыток глюкозы может быть превращен и сохранен в виде ……………..(4) является результатом использования ацетил-СоА для синтеза жирных кислот. Тем не менее, животные не способны превращать жирные кислоты в …………….(5),
поскольку ацетил-СоА не может быть превращен в ……………….(6). У организмов, осуществляющих это превращение, функционирует ……………..(7) цикл.
Ответы: (1) жирных кислот; (2) коферменту А; (3) дезаминирования; (4) жиров; (5) глюкозу; (6) пируват; (7) глиоксилатный.
52 |
Глава 7: Получение энергии из пищи - Введение. |
Заполните следующее
Обзор вопросов в конце главы 7
∙ Сделайте таблицу для запоминания этих понятий.
Стадии образования энергии |
Локализация |
|
|
Гликолиз |
Цитоплазма |
|
|
Цикл лимонной кислоты |
Митохондриальный матрикс |
|
|
Транспорт электронов |
Внутренняя митохондриальная мембрана |
|
|
∙В структуре никотинамидного кофермента имеется “рабочая” группировка, представляющая
собой шестичленное кольцо, содержащее азот и присоединенную амидную группу СОNH2. В восстановленном состоянии кофермента два атома водорода присоединены к атому углерода кольца напротив атома азота и двух двойных связей кольца. В окисленной форме кофермента у этого атома углерода имеется только один атом водорода с тремя двойными связями в кольце, в результате чего сам атом азота заряжен положительно. Рассматривая перенос водорода, биохимики часто обозначают два атома водорода (Н·) каждый с одним электроном. Это имеет место вследствие того, что в химической реакции восстановленная форма (гидрид-ион) всегда уравновешена другим ионом водорода - Н+.
∙Система FAD/FADH2 играет сходную роль, аналогичную NAD+/NADH
∙Аэробный означает в присутствии О2, а анаэробный - в его отсутствии. Мышцам часто приходится использовать глюкозу в анаэробных условиях, потому что снабжение кислородом не соответствует повышенным потребностям в нем. В этом случае образующийся пируват превращается в лактат, обеспечивая дальнейшее протекание гликолиза NAD+.

Глава 7: Получение энергии из пищи - Введение. |
53 |
∙ Кофермент А имеет в качестве “рабочей” группировки концевую SH-группу. Этот тиол реагирует аналогично гидроксилу -ОН, образуя эфиры с карбонильными группами. Однако тиоловые эфиры, образующиеся между СоА и карбонилом, имеют более высокий энергетический потенциал, по сравнению с простыми эфирами кислорода, что соответствует более отрицательному значению G0′ гидролиза. Причина этого различия состоит в том, что размеры атома серы больше атома кислорода, и электронные орбитали обоих атомов не перекрываются, так как перекрываются орбитали атома кислорода с атомом углерода (размеры которого также малы). Последнее означает, что связь между атомами серы и углерода в тиоловом эфире менее стабильна, чем соответствующая связь О-С в простом эфире. Поэтому такая менее стабильная молекула обладает более высокой энергией.
∙Важность пируватдегидрогеназной реакции объясняется тем, что она связывает гликолиз с циклом лимонной кислоты посредством высокореакционноспособного метаболита, ацетил-СоА.
∙Ацетил-СоА соединяет гликолиз и цикл лимонной кислоты.
∙Два восстановленных кофактора NADH и FADH2 функционируют сходным образом, приводя в конечном счете к образования энергии АТР.
∙Обычно значения Е0′ описываются для реакций восстановления. Для вычисления Е0′ в сопряженной системе мы должны изменить знак полуреакции, что соответствует окислению и
прибавить значение Е0′. Правильным уравнением является: Е0′ = 0,816 Â + 0,219 Â = +1,035 Â.
∙Ацетил-СоА является метаболитом, соединяющим многие пути обмена.
∙ Глюкоза → жирные кислоты |
Äà |
Жирные кислоты → глюкоза |
Нет, у животных; да у бактерий. |
Дополнительные вопросы к главе 7
1.Объясните с точки зрения свободной энергии продуктов и исходных реагентов, почему реакции с G0′ < 0 являются самопроизвольными?
2.Сколько энергии освободится, если глюкозу окислить до СО2 è Í2Î?
3.Какая молекула восстанавливается при окислении глюкозы? Напишите равновесную полуреакцию, указав продукт этого этапа.
4.«Уравновесьте» следующие реакции ионами Н+:
5.В чем различия между аэробными и анаэробными условиями?
54 |
Глава 7: Получение энергии из пищи - Введение. |
|
|
6.В чем особенности строения мембраны митохондрий?
7.При каких условиях лактат является основным продуктом гликолиза? Приведите два примера.
8.Какова химическая структура ацетильной группы, присоединенной к СоА?
9.Какой фермент превращает пируват в ацетил-СоА?
10.Каковы продукты реакции превращения пирувата в ацетил-СоА?
11.Какова роль солевого мостика в аппарате для измерения редокс-потенциала?
12.Если реакция, в которой переносятся два электрона, имеет суммарный клеточный потенциал Е0′= 0,25 В, каково значение G0′. Является ли эта реакция энергетически благоприятной?
13.Реакция 2Fe3+ + 2e → 2Fe2+ имеет Е0′ = 0,77 В, а реакция 1/2О2 + 2Í+ + 2å → Í2О имеет
Å0′ =0,82 В. Будет ли 2Fe2+ окисляться до 2Fe3+ в присутствии О2? (Отметьте, что цифра 2 перед Fe2+ è Fe3+ отражает баланс числа электронов, переносимых в каждой отдельной полуреакции, n=2).
14.Почему проблем с пищевым рационом было бы меньше, если бы наш организм мог осуществлять превращение ацетил-СоА в пируват?
15.Каким образом можно использовать аминокислоты для получении энергии?
16.Составьте перечень компартаментов клетки, в которых осуществляются три главных стадии окисления глюкозы.
