
Лекция 11.Галогеноуглеводороды 24.08.09
.doc|
Лекция 11 |
Галогеноуглеводороды
Фтор-, хлор-, бром-, иодпроизводные, а также смешанные (с разными галогенами). Изомерия – по структуре углеродной цепи и по положению галогена. Для простых и часто встречающихся веществ применяется радикально-функциональная номенклатура:
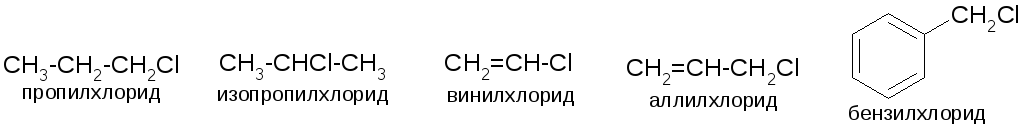
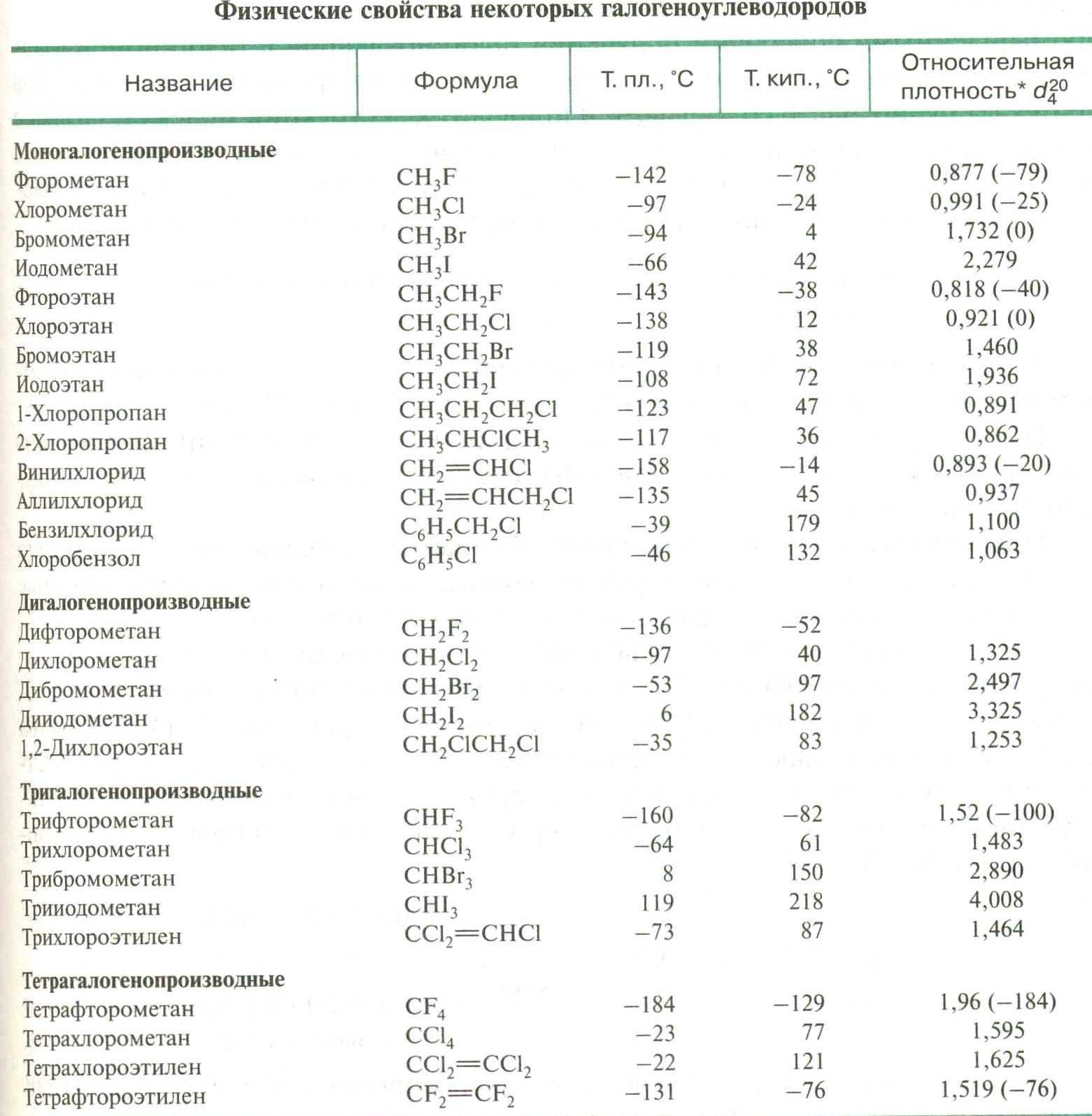
Физические свойства
Низшие производные – газы или низко кипящие жидкости с характерным сладковатым запахом. С увеличением массы галогенов (F→Cl→Br→I) и количества их атомов увеличивается плотность и т. кип., а также снижается горючесть вещества (CCl4 – в огнетушителях).
Способы получения
1. Галогенирование углеводородов
а) Для получения хлор- и бромпроизводных широко применяется радикальное галогенирование алканов (см. "Алканы").
С йодом эта реакция не идет.
Прямое фторирование углеводородов из-за его высокой экзотермичности приводит к разрыву С-С-связей и деструкции углеродных цепей, и во всех случаях продуктами реакции являются CF4 и HF:
![]()
б) Для получения хлор- и бромпроизводных ароматических углеводородов применяется прямое галогенирование в присутствии катализаторов – кислот Льюса (см. "Ароматические углеводороды").
в) Присоединение галогенов и галогеноводородов к непредельным соединениям (см. "Алкены" и Алкины").
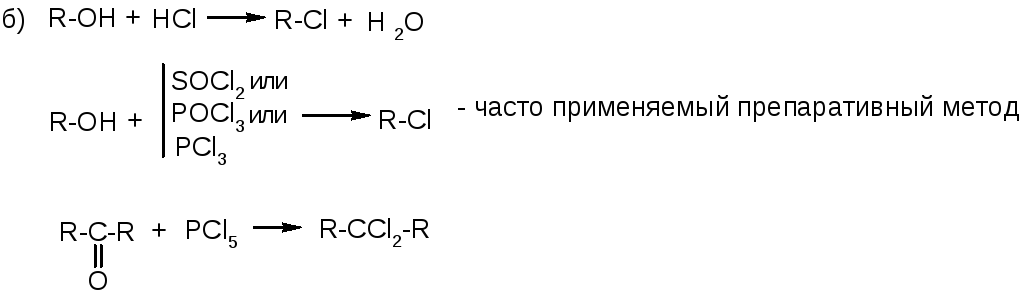
2. Замещение на галоген других групп
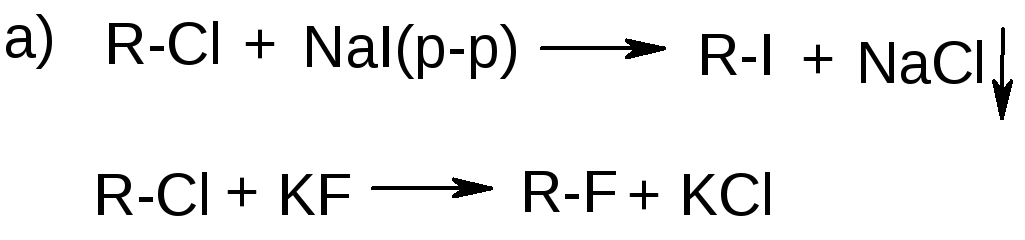
Химические свойства
Галогенопроизводные – один из наиболее важных в синтетическом отношении классов.
Реакционная способность определяется поляризацией связи С-Hal:
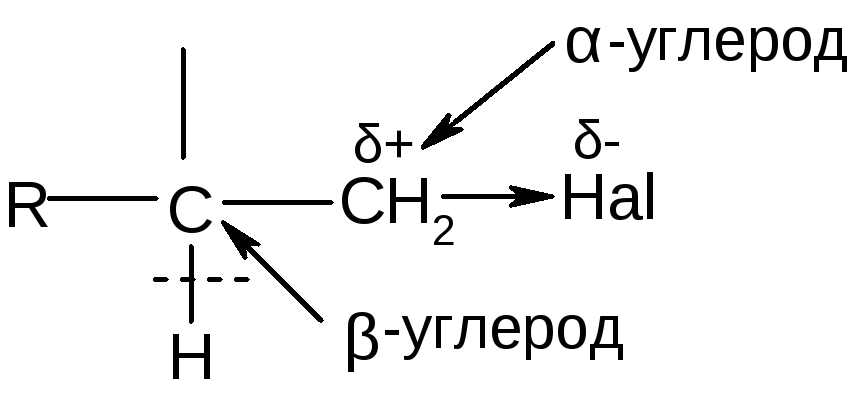
α-углерод – центр нуклеофильной атаки; β-углерод – СН-кислотный центр (в присутствии оснований отщепляет Н+, образующийся анион может быть атакован электрофилом).
1.Реакции нуклеофильного замещения (SN)
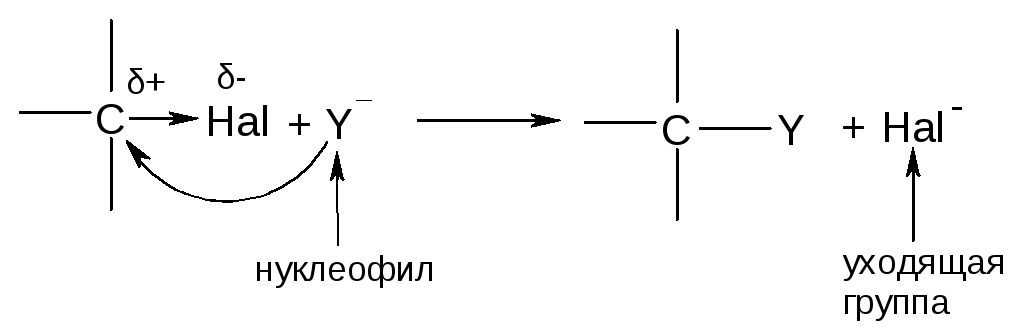
Скорость реакции увеличивается при увеличении полярности связи C-Hal и при увеличении устойчивости уходящей группы. Отсюда легкость ухода галогенов изменяется в следующем ряду:
I > Br > Cl >> F
МЕХАНИЗМ РЕАКЦИИ
1. Бимолекулярная реакция (SN2)
Одностадийный процесс
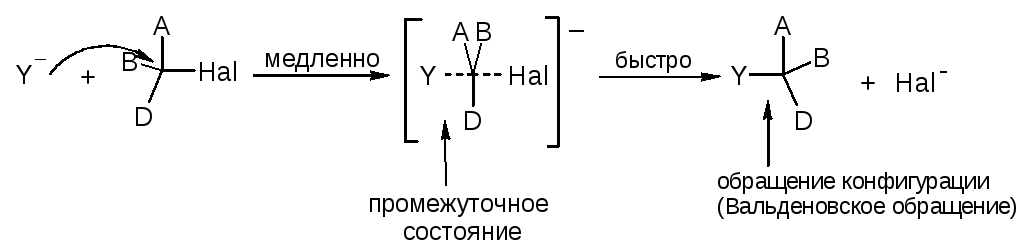
Скорость реакции зависит от концентрации обоих исходных реагентов.
Скорость реакции определяется устойчивостью промежуточного состояния и силой нуклеофила (нуклеофильностью) Y.
Нуклеофильность – это способность отдавать неподелённую пару электронов другому атому (кроме протона).
Нуклеофильность и основность чаще всего изменяются параллельно, но в отличие от основности нуклеофильность зависит от поляризуемости. Поэтому, например, по основности: HO- > HS-, а по нуклеофильности: HO- < HS-.
По механизму SN2 реагируют 1) сильные нуклеофилы и 2)производные первичных и простых вторичных алкилов: в случае третичных и объемных вторичных алкилов значительно снижается устойчивость промежуточного состояния (пространственные затруднения). Реакциям SN2 способствуют 3) полярные апротонные растворители, повышающие устойчивость промежуточного состояния.
2. Мономолекулярная реакция (SN1)
Двустадийный процесс
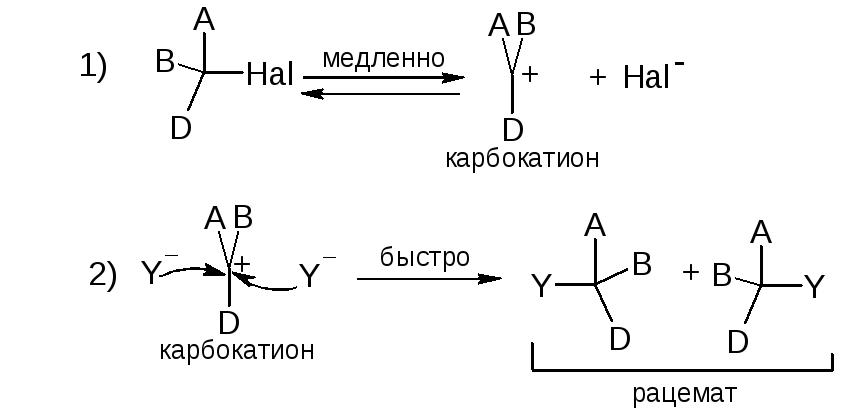
Скорость реакции не зависит от концентрации и свойств нуклеофила Y.
По механизму SN1 реагируют
1) производные третичных и объемных вторичных алкилов, в карбокатионе которых (+)-заряд значительно делокализован и устойчивость карбокатиона повышена.
2) В ряду производных F → Cl → Br → I возрастает полярность и поляризуемость связи С-Hal и способность к диссоциации с образованием карбокатиона. Поэтому реакции SN1 идут преимущественно с бром- и иодпроизводными, реже с хлорпроизводными, практически не идут с фторпроизводными.
3) Реакциям SN1 способствуют полярные протонные растворители, которые "разрыхляют" связь С-Hal и сольватируют образующийся карбокатион.
Использование реакций нуклеофильного замещения
для получения соединений различных классов
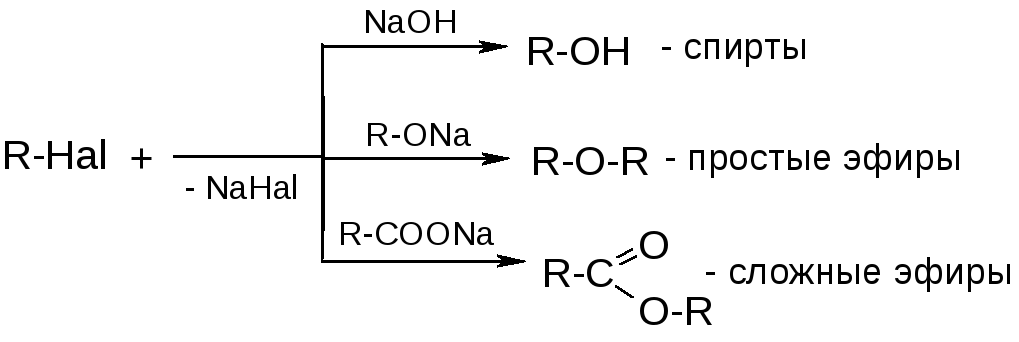
1) О-содержащие нуклеофилы
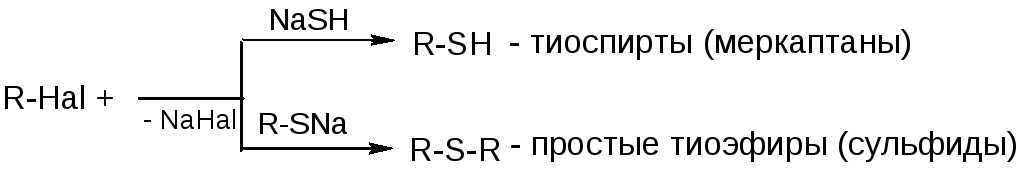
2) S-содержащие нуклеофилы
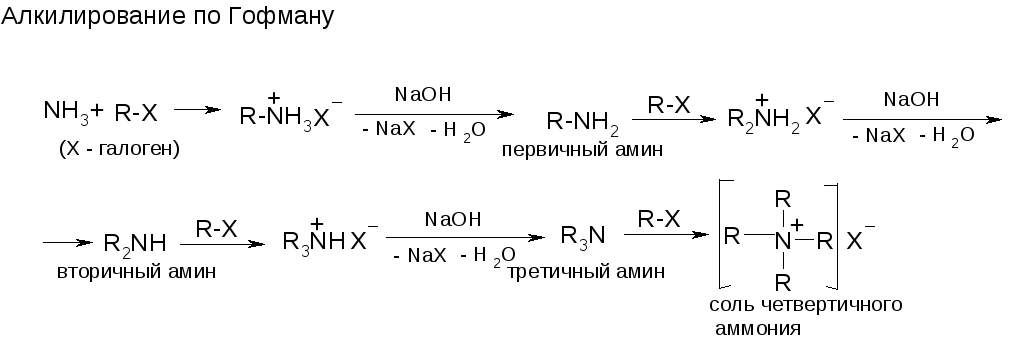
3) N-содержащие нуклеофилы
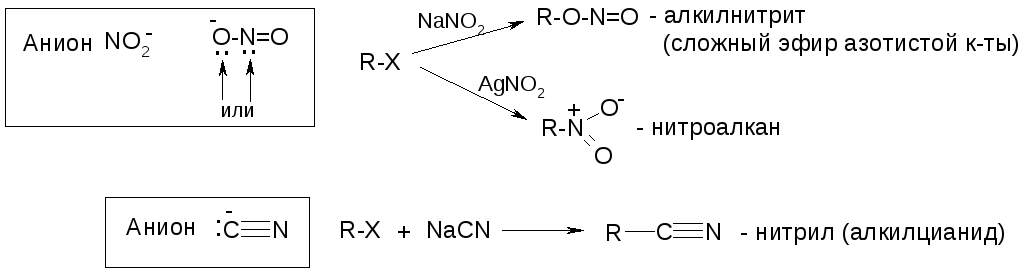
4) Другие нуклеофилы
Реакции элиминирования (отщепления) (Е)
Дегидрогалогенирование – отщепляются Н+ анион галогена Х-.
α-Элиминирование:
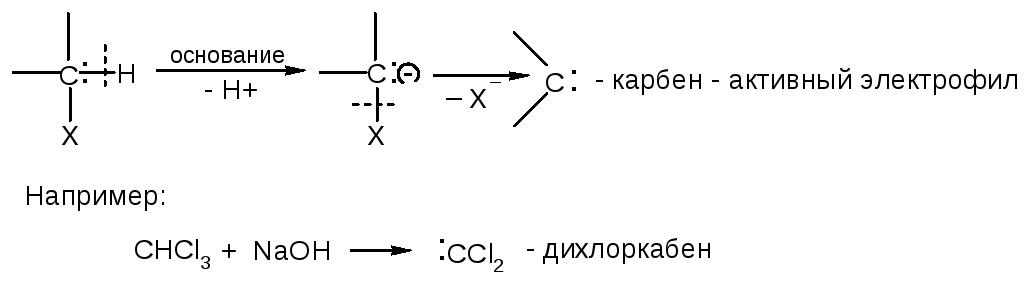
Наиболее распространено β-элиминирование:
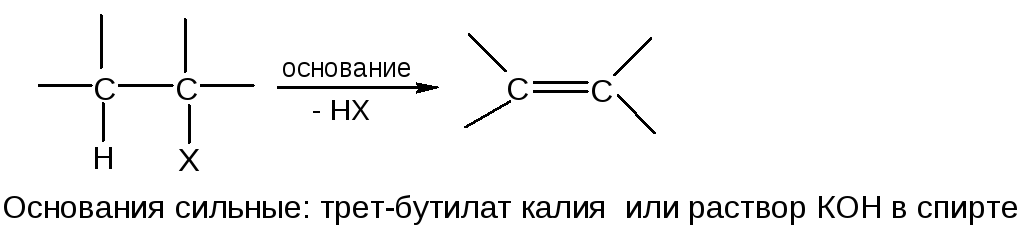
1. Бимолекулярная реакция (Е2)
Процесс одностадийный. Нуклоефил-основание одновременно отщепляет протон из β-положения и вытесняет анион галогена из α-положения:
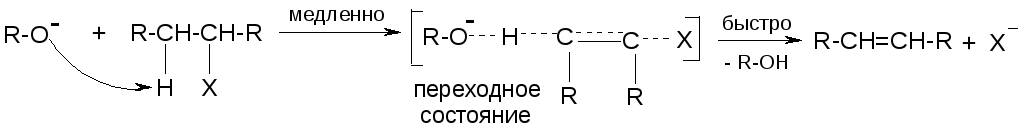
Реакция 2-го порядка: скорость реакции зависит от концентраций и галогенопроизводного, и нуклеофила-основания.
По этому механизму происходит дегидрогалогенирование первичных и небольших по объему вторичных алкилгалогенидов.
Правило Зайцева
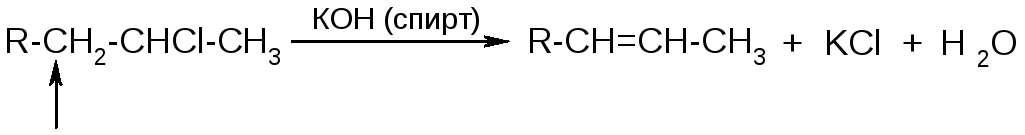
При дегидрогалогенировании алкилгалогенидов водород отщепляется от наименее гидрированного атома углерода.
В результате образуются продукты, содержащие у двойной связи наибольшее количество заместителей (более разветвленные), т.е. термодинамически наиболее устойчивые.
2. Мономолекулярная реакция (Е1)
Двустадийный процесс:

Реакция 1-го порядка: скорость её зависит только от концентрации галогенопроизводного.
Растворители: спирты, водно-спиртовые смеси, карбоновые кислоты – хорошо сольватирующие карбокатионы.
Реакции аллил- и бензилгалогенидов
У аллилгалогенидов реакции нуклеофильного замещения идут особенно легко. Например:
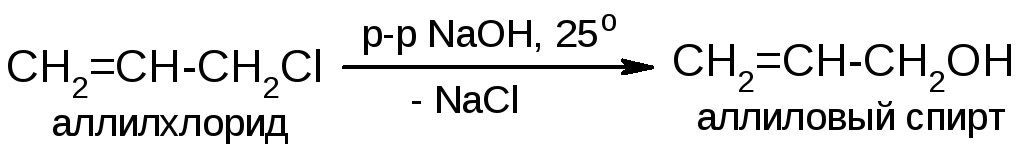
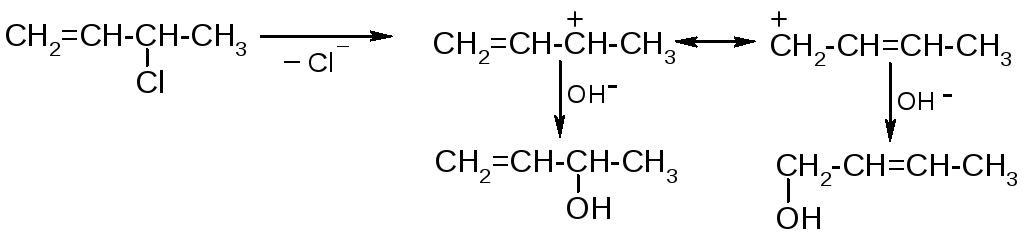
Реакция идет по механизму SN1. Аллильное сопряжение сильно стабилизирует промежуточный карбокатион. Оно также является причиной его перегруппировки, в результате которой в более сложных структурах образуются два продукта:
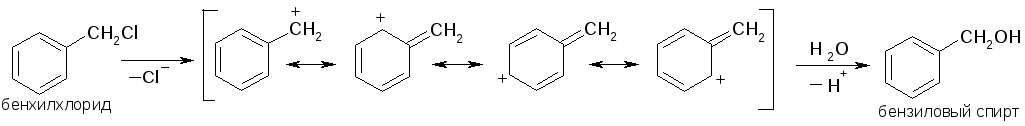
Подобная же стабилизация происходит и у бензилкатиона, что облегчает нуклеофильное замещение галогена в бензилгалогенидах:
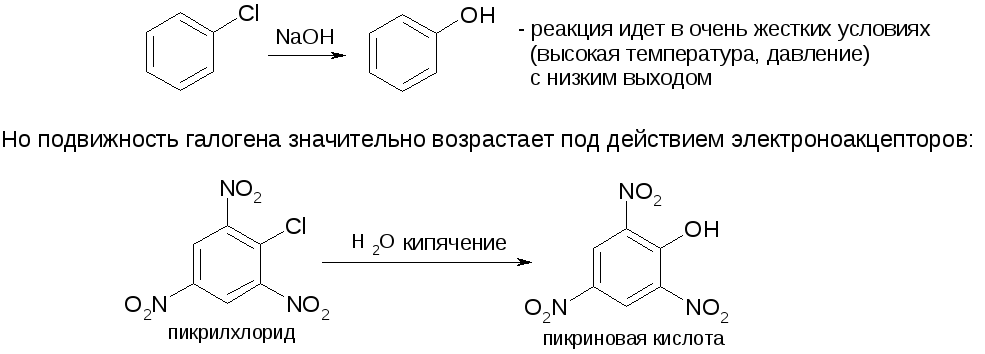
1.Реакции винил- и арилгалогенидов
В соединениях, содержащих галоген у двойной связи, подвижность последнего резко снижается. Связь =CH-Hal становится частично двойной и более прочной:
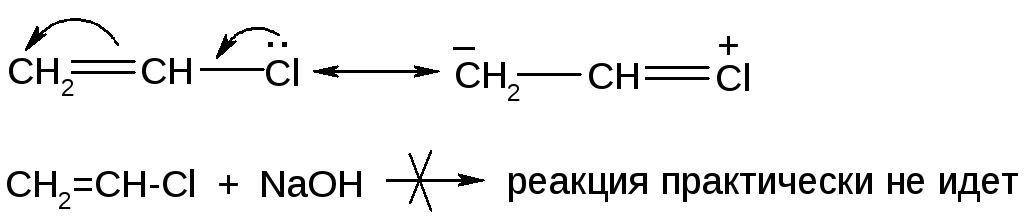
Аналогично для арилгалогенидов:
Отдельные представители галогенопроизводных – см. учебник
ЛИТЕРАТУРА:
1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – Дрофа, М., 2003 г., с. 298 – 336.
24.08.09
