
Лекция 02.Химическая связь31.07.09
.doc|
Лекция 2 |
Химическая связь
Химическая связь – это совокупность взаимодействий между электронами и ядрами, приводящая к соединению атомов в молекулу.
Электроны в атоме ведут себя как волны, и их движение описывается с помощью волновой функции:
ψ = f(x,y,z)
Уравнение Шредингера – математическая модель электрона в атоме. Оно определяет волновые функции ψ и энергетические уровни электронов. Электронная плотность в данной точке пространства определяется величиной |ψ|2 и всегда положительна.
Атомная орбиталь (АО) – это область пространства, где вероятность нахождения электрона максимальна (95%).
Квантовые числа характеризуют энергетическое состояние электрона в атоме. Строение электронных оболочек описывается с помощью квантовых чисел с учетом принципа Паули, правила Гунда и принципа минимума энергии.
Формы орбиталей:
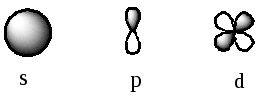
При сближении атомов происходит перекрывание АО и образование молекулярных орбиталей (МО).
Локализованная связь – это связь, оба электрона которой находятся между связанными атомами.
Ковалентная связь – это связь, образованная обобществлением электронов связывающихся атомов (по 1 электрону от каждого).
σ-связь – образуется осевым перекрыванием s-s-, s-p- или p-p-орбиталей:

π-связь – образуется боковым перекрыванием p-орбиталей:

ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА УГЛЕРОДА
Атом углерода во внешней электронной оболочке имеет 4 атомных орбитали:
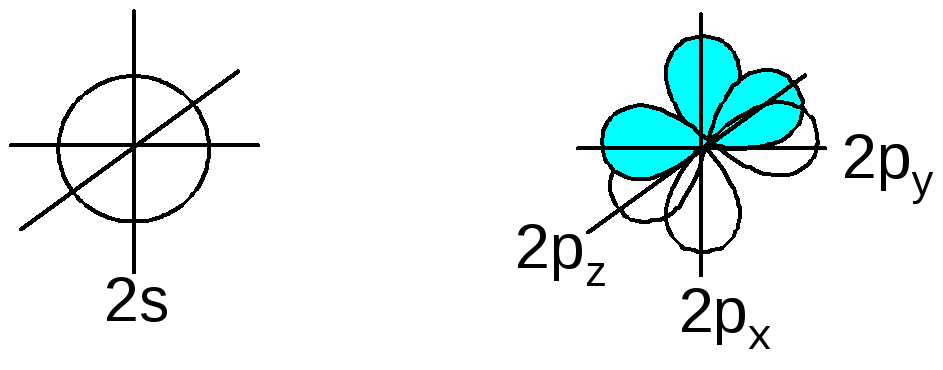
При образовании связей происходит т.н. гибридизация атомных орбиталей: несколько близких по энергии орбиталей как бы усредняются, образуя такое же количество орбиталей равных по энергии и отличающихся геометрической направленностью. Гибридные орбитали обеспечивают более полное перекрывание при образовании связей, и это делает гибридизацию энергетически выгодной.
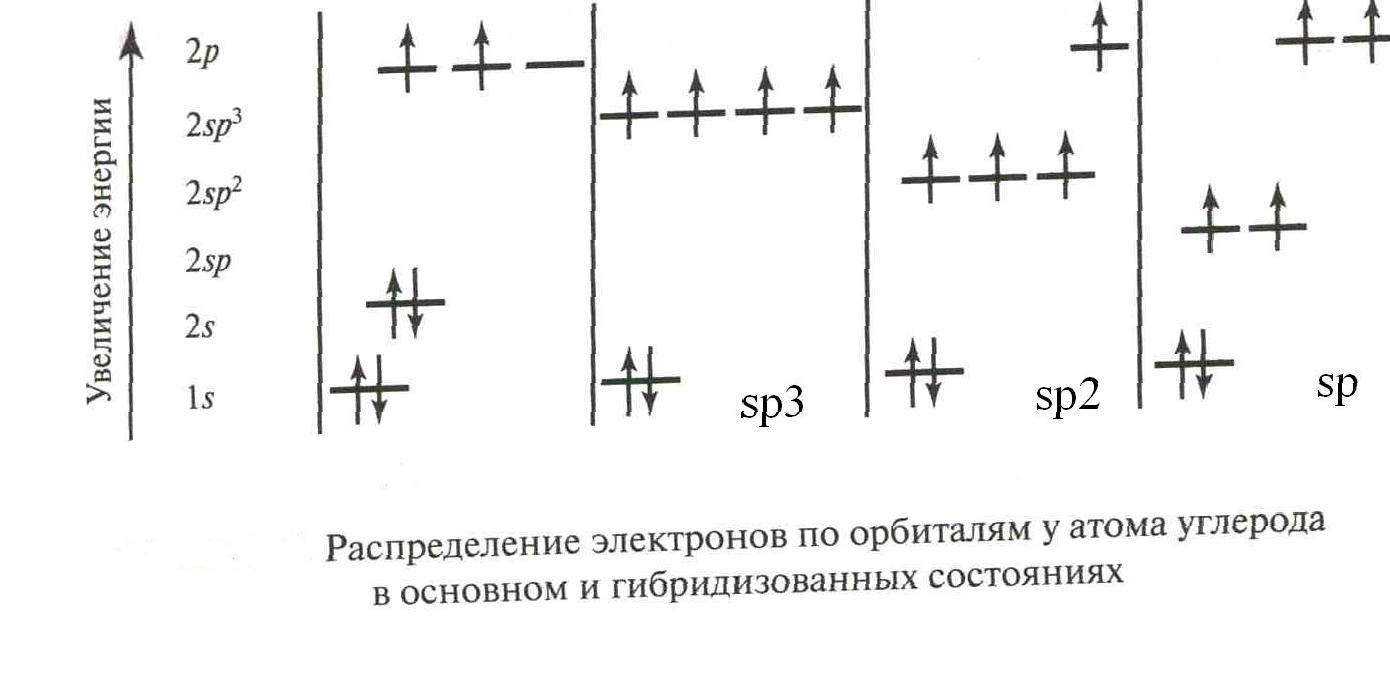
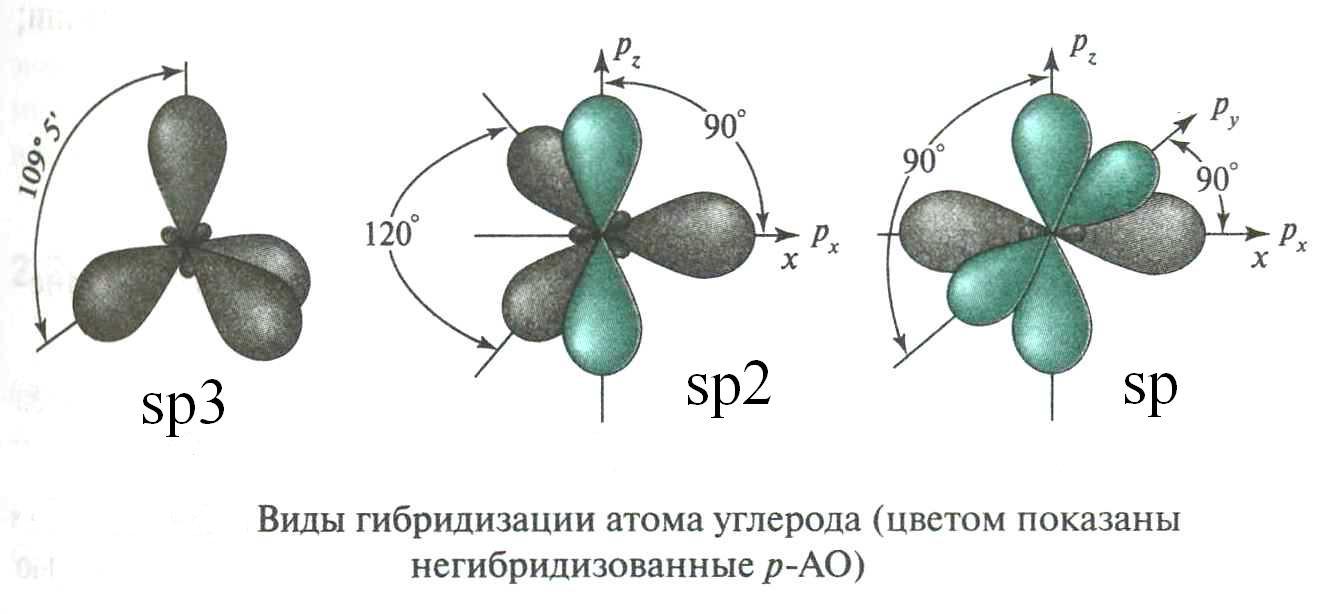
У атома углерода различаются три типа гибридизации:
-
sp3 гибридизация, в ней участвует s-орбиталь и три р-орбитали;
-
sp2 гибридизация: s-орбиталь и две р-орбитали;
-
sp гибридизация: s-орбиталь и одна р-орбиталь.
ПРОСТЫЕ И КРАТНЫЕ УГЛЕРОД-УГЛЕРОДНЫЕ СВЯЗИ
Простая (ординарная) σ-связь образуется путем осевого перекрывания гибридных орбиталей. Молекула этана имеет трехмерную (тригональную) геометрическую структуру:
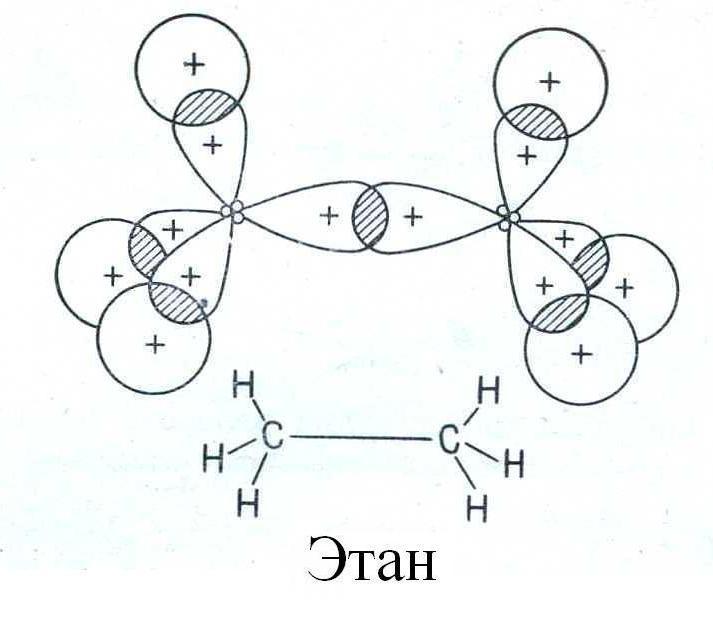
Двойная связь образуется между двумя sp2-гибридизованными атомами и состоит из σ-связи, образованной осевым перекрыванием гибридных орбиталей, и π-связи, образованной боковым перекрыванием негибридизованных р-орбиталей. Молекула этилена имеет дигональную (планарную) геометрическую структуру - все σ-связи расположены в одной плоскости:

Тройная связь образуется между двумя sp-гибридизованными атомами и состоит из σ-связи и двух π-связей, причем плоскости π-связей перпендикулярны друг другу. Молекула ацетилена имеет линейную геометрическую структуру (все σ-связи находятся на одной прямой):
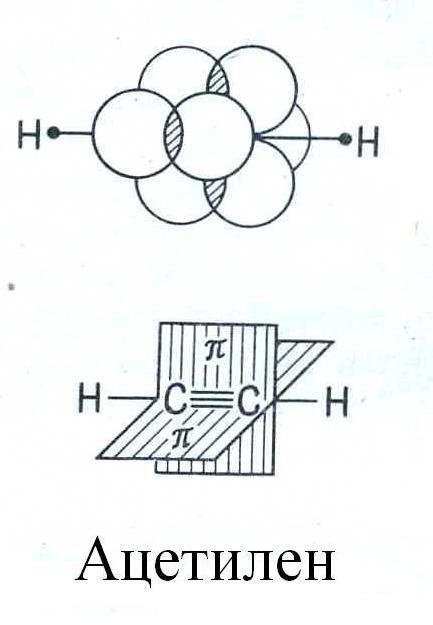
Длины связей уменьшаются в следующей последовательности:
ординарная > двойная > тройная
МЕТОДЫ ОПИСАНИЯ ЭЛЕКТРОННОЙ СТРУКТУРЫ
Метод МО ЛКАО (Хюккель)
ψ = С1ψ1 + С2 ψ2 + С3ψ3 + ... + Сnψn
ψ – молекулярная орбиталь
ψn – атомные орбитали
Этот метод применяется для расчетов энергетических параметров молекул и δ-зарядов на атомах.
Метод валентных схем
Применяется для описания структур, которые не могут быть однозначно описаны одной структурой. В основе метода лежит концепция мезомерии (К.Ингольд, 1922 г.) и теория резонанса валентных структур (Л.Полинг,1928 г.).
Примеры:

Донорно-акцепторная (координационная) связь – это ковалентная связь, образованная за счет пары электронов одного атома:
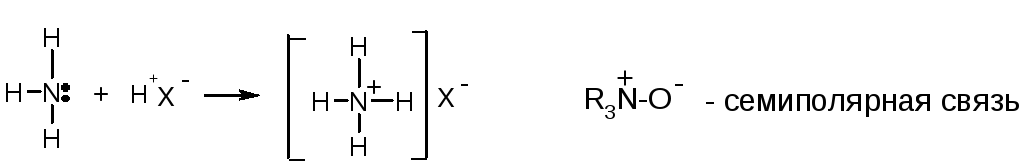
Координационные связи в комплексных соединениях:
комплексообразователь – лиганд
Донорами могут быть соединения с развитой системой π-электронов:

Характеристики ковалентной связи
Длина связи – расстояние (в нм) между центрами связанных атомов,
определяется методом рентгено-структурного анализа (РСА).
Ковалентный радиус атома – равен ½ длины ковалентной связи между одинаковыми атомами.
Ван-дер-ваальсов радиус – равен ½ расстояния между максимально сближенными атомами. Всегда больше ковалентного радиуса.
Валентные углы – углы между осями орбиталей (см. геометрическую конфигурацию атомных орбиталей С-атома с различной гибридизацией).
Энергия связи (кДж/моль) – энергия, которую нужно затратить для разрыва связи. Равна энергии образования связи. Является мерой прочности связи.
Может быть косвенно определена по энергии сгорания вещества.
Энергия связи уменьшается с увеличением её длины.
Кратные связи короче и прочнее ординарных, но не пропорционально; т.е.
σ-связь прочнее π-связи.
Энергия связи между одними и теми же атомами зависит от структурных особенностей, например, она уменьшается в ряду:
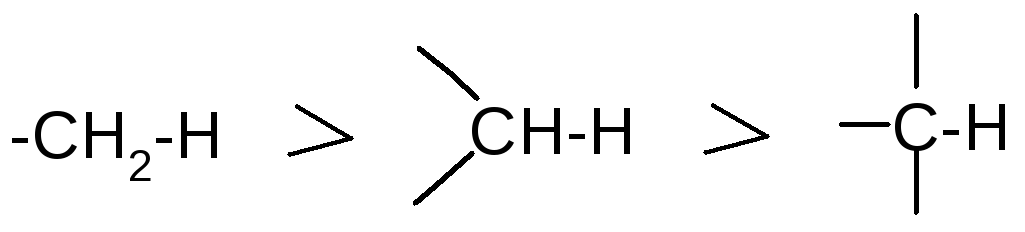
Полярность связи – смещение пары электронов, образующих связь, в сторону более электроотрицательного атома.
Электроотрицательность – способность атома притягивать электроны.

Электроотрицательность атомов (по Полингу):
-
F
O
N
Cl
Br
I
C
S
H
Mg
Li
Na
4,0
3,5
3,0
3,0
2,8
2,6
2,5
2,5
2,1
1,2
1,0
0,9
Электроотрицательность углерода:
-
sp3
sp2
sp
2,5
2,8
3,1
Дипольный момент – мера полярности связи:
μ = q·l
q – заряды на атомах (абсолютная величина)
l – длина связи
Для многоатомных молекул μ определяется как векторная сумма дипольных моментов всех связей.
Молекулы, содержащие высокополярные связи могут быть в целом неполярны: СО2, CCl4.
Поляризуемость связи – способность к динамическому смещению электронов под действием электромагнитного поля (воздействие приближающейся активной частицы или молекул растворителя). Определяет реакционную способность связи в значительной степени.
Поляризуемость увеличивается с увеличением длины связи, например:
С-O (1) C—S (2)
у (1) стационарный диполь больше, чем у (2), но в динамических условиях реакции легко поляризуемая (2) более реакционноспособна.
Поляризуемость π-связи значительно больше, чем σ-связи.
Водородные связи и другие слабые взаимодействия
Водородные связи
Связи Х-Н преимущественно сильно полярны, поэтому протон слабо экранирован и взаимодействует с электронами другого атома:
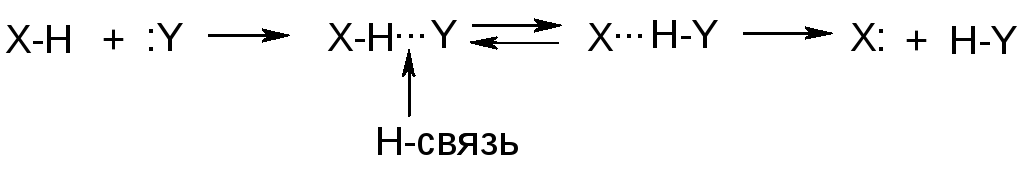
Такие переходы из-за малого энергетического барьера осуществляются легко (подвижность протона).
Энергия Н-связей составляет 10-20 кДж/моль, поэтому при нагревании они разрываются.
Роль водородных связей в физических свойствах ОН-содержащих соединений: вода, спирты, карбоновые кислоты. Гидратация полярных соединений и ионов в водных растворах.
Роль водородных связей в формировании вторичной и третичной структур биополимеров: белков, полисахаридов, НК.
Диполь-дипольное взаимодействие
полярные молекулы могут ассоциироваться так:
сила взаимодействия пропорциональна 3-й степени расстояния.
Повышают т.кип. и т.пл. вещества.
Дисперсионное взаимодействие
неполярные молекулы при тесном сближении взаимодействуют, индуцируя осциллирующие диполи, которые притягиваются друг к другу.
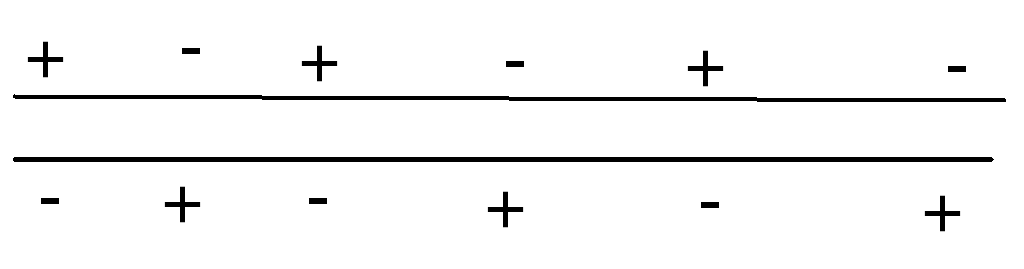
Сила такого взаимодействия пропорциональна 6-й степени расстояния и максимальна на расстоянии ван-дер-ваальсовых радиусов, а также увеличивается при увеличении размера молекулы (длины цепи).
Так происходит ассоциация гидрофобных фрагментов белковых цепей, принимающая участие в формировании вторичной и третичной структур белка. Такое взаимодействие играет большую роль в образовании комплекса лекарственного вещества с рецептором.
ЛИТЕРАТУРА:
Основная
1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – ДРОФА, М., 2003 г., с. 39 – 55.
Дополнительная
1.Н.А.Тюкавкина, Ю.И.Бауков – Биоорганическая химия – ДРОФА, М.,
2007 г., с. 24-36.
31.07.09
