
Лекции - 2006 / 9. окисл.фосф
..doc
8. Окислительное фосфорилирование
Суммарный процесс последовательного катаболического превращения од-ного моля глюкозы в ходе гликолиза, окислительного декарбоксилирова-ния пирувата и в цикле Кребса приводит к образованию 10 молей NADH, 2 молей FADH2, 2 молей АТФ и 2 молей ГТФ. Теперь аэробная клетка может использовать энергию, выделяющуюся при окислении восстанови-тельного потенциала NADH, для образования максимального количества АТФ. В простейшем виде эта реакция записывается уравнением:
![]()
Изменение свободной энергии в этом процессе составляет 220 кДж/моль, что примерно соответствует окислению водорода кислородом (52,6 ккал/моль). Эта энергия должна оптимальным образом использоваться для образования АТФ, на биосинтез которого из АДФ и фосфата в среднем затрачивается 14 ккал/моль. Если учесть, что в сутки организм человека потребляет 2800 ккал/моль, то это соответствует образованию примерно 100 кг АТФ, хотя в организме его стационарное содержание равно пример-но 50 г. Эти цифры показывают с какой эффективностью работает меха-низм воспроизводства расходуемого АТФ в зависимости от потребности в нем, которая меняется в зависимости от рода деятельности в каждый от-дельный момент (активная работа, отдых, сон и т.д.).
Еще на ранней стадии биохимических исследований было установлено, что энергетическими «фабриками» аэробных эукариотических клеток являются митохондрии, а у прокариот синтез АТФ идет в клеточных мемб-ранах. Митохондрии представляют собой органеллы красновато-коричне-вого цвета размером около 0,51,5 мкм, число которых в клетках живот-ных колеблется в пределах от нескольких сотен до нескольких тысяч. Строение митохондрий из разных организмов единообразно. Они окруже-ны двойной мембраной. Внешняя гладкая мембрана содержит транспорт-ные белки и ферменты, отвечающие за превращения аминогрупп (моно-аминоксидазы), а также ферменты, участвующие в обмене жирных кислот. Внутренняя мембрана митохондрий для увеличения ее поверхности обра-зует множество впячиваний, называемых кристами. Итак, содержимое митохондрии разделено на два объема: межмембранное пространство и внутреннее пространство (матрикс), отделенное от межмембранного про-странства внутренней мембраной. Среднее время существования мито-хондрий составляет около 10 суток. Митохондрии делятся, причем они содержат свою собственную нитевидную ДНК и набор РНК, что позволяет сделать предположение о том, что их присутствие в клетке представляет собой нечто вроде симбиоза: они могли образоваться в результате эндоци-тоза аэробных прокариот анаэробными эукариотами и сохраниться в них, получая питательные вещества и снабжая приютившую их клетку адено-зинтрифосфатом. Все митохондрии в клетках организмов, размножающих-ся половым путем, получены от материнской клетки. Это позволяет использовать ДНК митохондрий для установления родства.
Основные катаболические процессы локализованы в матриксе митохонд-рий. Сюда соответствующими транспортными системами переносятся суб-страты для цикла Кребса и катаболического превращения жирных кислот (пируват, глутамат, аспартат, малат, 2‑кетоглутарат, цитрат, жирные кис-лоты), а также АДФ и фосфат, из которых образуется АТФ. Именно в матриксе митохондрий протекают конечные стадии катаболического пре-вращения углеводов и жирных кислот, сопровождающиеся образованием восстановительного потенциала.
Что же мы знаем о механизме образования АТФ в митохондриях? Суб-стратный путь образования АТФ, который реализуется живой природой при анаэробном катаболическом превращении глюкозы (перенос макроэр-гической фосфатной связи на АДФ с 1,3-дифосфоглицерата и с фосфоенол-пирувата), очевидно, не может быть достаточно эффективно использован при окислении восстановительного потенциала, заложенного в NAD(P)H и в FADH2. Поэтому эволюция клеток в кислородсодержащей среде пошла по принципиально иному пути, использующему для синтеза АТФ электро-химический потенциал и градиент концентраций протонов, причем коэф-фициент полезного действия в этом случае достигает 60 %. Этот процесс называют окислительным фосфорилированием.
Реакция окисления NADH может быть представлена двумя полуреакция-ми. Сначала NAD(Р)H отдает пару электронов:
![]() ,
,
в стандартных биохимических условиях окислительно-восстановительный потенциал Е0 этого процесса равен -0,320 В. Затем пара электронов пере-носится на кислород:
![]()
Здесь окислительно-восстановительный потенциал Е0 имеет значение +0,816 В. Для суммарной реакции окисления NAD(P)H кислородом полу-чаем разность 1,136 В, что соответствует G0 около 220 кДж/моль, тогда как на образование одного моля АТФ затрачивается более 60 кДж.
Движение электронов, отданных восстановленными формами никотин-амидадениндинуклеотида (или его фосфата) и флавопротеинов, во внут-ренней мембране митохондрий происходит в результате окислительно-восстановительных превращений молекул убихинона, атомов железа в железо-серных белках и в гемовых структурах в составе цитохромов (их называют обычно пигментами электронпереносящей цепи). Движение электронов по компонентам электронпереносящей цепи сопровождается снижением восстановительного потенциала каждого принявшего электрон участника процесса. Понятно, что снижение восстановительного потенциа-ла сопровождается выделением энергии, которая может быть использована для синтеза АТФ. При этом субстратный путь с образованием макроэр-гических соединений из компонент электронпереносящей цепи и фосфатов исключается, так как при нарушении целостности внутренней мембраны митохондрии она продолжает окислять NADH, но перестает генерировать АТФ. Есть даже митохондрии с пористой внутренней мембраной (мито-хондрии бурого жира), которые предназначены исключительно для генери-рования тепла. Было установлено, что в межмембранном пространстве устанавливается кислая среда и есть много соединений, которые хорошо растворяются в липидах мембран как в виде аниона, так и в протониро-ванном виде. Оказалось, что в их присутствии даже сплошная мембрана перестает синтезировать АТФ. Такие вещества называют разобщителями окислительного фосфорилирования. Классическим примером таких ве-ществ является 2,4-динитрофенол. Некоторое время его даже использовали в качестве медикаментозного средства для снижения веса. Его присутствие в организме приводит к непроизводительному расходованию пищевых веществ, выражающемуся в повышении температуры тела. Антибиотик валиномицин, имеющий структуру баранки, составленной из повторяю-щихся фрагментов валина, гидроксиизовалериановой кислоты и молочной кислоты, переносит через мембраны ионы калия, снижая тем самым электрохимический мембранный потенциал. Это вещество послужило отправной точкой для получения циклических структур – краун-эфиров, используемых в качестве катализаторов межфазного переноса.
Митохондриальная цепь переноса электронов включает:
-
никотинамидадениндинуклеотидный акцептор электронов и флавопро-теин с флавинмононуклеотидом
-
белки с железо-серными кластерами, в которых атомы железа (два и бо-лее) связаны с сульфгидрильными группами цистеиновых фрагментов белка с участием неорганических сульфидных структурных элементов
-
убихинон, связанный с мембраной исключительно за счет гидрофобно-го взаимодействия олигоизопреноидного остатка этого вещества с липидными компонентами мембран
-
цитохромы (cyt b, cyt c1, cyt c, cyt a, cyt a3) – белки с различными гемами.
Все компоненты этой цепи, кроме цитохрома с (этот низкомолекулярный белок легко отмывается солевыми растворами), интегрированы в мем-брану. В старых учебниках по биохимии приводится такая последователь-ность движения электронов по электрон-переносящей цепи:
NAD(P)H FMN убихинон cyt b cyt c1 cyt c cyt aa3 O2
Железо-серные белки выполняют роль посредников (накопителей электро-нов) при контакте FMN с убихиноном и цитохрома b с цитохромом с1. В железо-серных белках и в цитохромах перенос электронов осуществляется за счет окисления и восстановления атомов железа Fe2+ и Fe3+.
Убихинон (кофермент Q) переносит электроны за счет превращения его в гидрохинон:
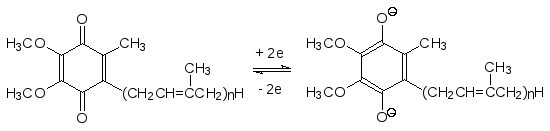
Понятно, что с помощью убихинона идет не только транспорт электронов, но и перенос протонов, которые при образовании аниона гидрохиноновой формы могут быть приняты в матриксе, а при окислении с образованием хиноновой формы они могут быть отданы уже в межмембранное простран-ство. У гидрохинонов есть три степени окисления: сами гидрохиноны, свободнорадикальные семихиноны (- е) и хиноны (- 2е), все они включены в систему перекачки протонов против градиента концентрации.
Перенос протонов возможен и за счет окислительно-восстановительных превращений гемов, так как в максимальной степени окисления атом же-леза связан с одним анионным остатком, а в двухвалентном состоянии этот анион может быть протонирован.
Очень важна роль цитохромов а и а3, связанных в прочный комплекс. Эти переносчики электронов имеют две гемовых компоненты и два атома ме-ди, которые также участвуют в переносе электронов за счет перехода
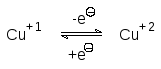
Важность согласованной работы комплекса цитохромов а и а3 состоит в том, что они должны одновременно перенести на молекулу кислорода четыре электрона. Любой сбой в этой системе вызовет образование актив-ного окислителя – супероксида (один электрон), пероксида (два электрона) или гидроксильного радикала (три электрона).
В соответствии со старыми представлениями о работе системы окисли-тельного фосфорилирования предполагалось, что перенос электронов от NAD(Р)H сопровождается переносом из матрикса в межмембранное пространство шести протонов, в результате чего в нем устанавливается кислая среда с рН около 4,0. Возникший градиент концентраций протонов при обратной диффузии их через АТФ-синтетазный комплекс белков приводит к фосфорилированию АДФ активным фосфатом:
Сегодня считается, что интегрированные в мембрану пигменты электрон-переносящей цепи скомпонованы в четыре комплекса. В состав первого входит NAD, второй включает FAD, третий включает цитохромы b и с1 и четвертый – цитохромы а и а3. Цитохром с – это периферический гемо-протеин с небольшой молекулярной массой (в его составе кроме гема око-ло ста аминокислот), он растворим в воде и легко перемещается по внеш-ней стороне внутренней мембраны, осуществляя связь между разными комплексами электронпереносящей цепи.
Установлено, что непосредственно для синтеза одной молекулы АТФ из межмебранного пространства в матрикс входят три протона, но для этого из матрикса должны выйти четыре протона, так как один протон теряется при обмене молекулы АТФ, образовавшейся в матриксе, на поступающие из межмембранного пространства АДФ и фосфат. Работа электрон-переносящей цепи, сопровождающая окисление восстановительного по-тенциала одной молекулы NAD(P)H, завершается выходом из матрикса в межмембранное пространство десяти протонов. Окисление молекулы FADH2 с более низким восстановительным потенциалом сопровождается выходом шести протонов. Из них, очевидно, два протона – это результат образования в матриксе недиссоциирующей молекулы воды из молекулы кислорода (связывание двух протонов в матриксе эквивалентно появлению двух протонов в межмембранном пространстве), а еще восемь (или четыре от FADH2) – это не установленная во всех деталях работа убихинона и других пигментов электронпереносящей цепи. В соответствии с этим окисление одного моля NAD(P)H завершается образованием 2,5 моля АТФ, а окисление одного моля FADH2 дает 1,5 моля АТФ.
Внутренняя (обращенная к матриксу) поверхность крист внутренней мем-браны плотно покрыта сферическими белковыми структурами, которые прикреплены к ней тонкими ножками. Это – выступающая из мембраны часть АТФ-синтетазы, сложнейшего ансамбля многих белков, осуществля-ющего биосинтез АТФ из АДФ и фосфата. Долгое время не удавалось установить механизм работы АТФ-синтетазы. Было известно, что она со-стоит из двух принципиально различных комплексов белков. Один из них с обозначением Fo интегрирован в мембрану, другой (F1) прочно связан с первым, но выступает из мембраны. Современные достижения в иссле-довании пространственного строения белков, включая электронную мик-роскопию, позволили получить точное представление о функционирова-нии этой системы, похожей на электромотор из белковых молекул.
В мембрану встроена система транслокации протонов, включающая по крайней мере 12 белков (с-субъединицы), образующих статор этого «мо-торчика» (Fо). В мембрану погружен также белок, обозначаемый как а, который через еще одну субъединицу b прикреплен к субъединице , которая вместе с тремя парами белков, обозначаемых буквами и об-разует ту саму выступающую из мембраны кристы шарообразную головку АТФ-синтетазы (F1), которая хорошо видна на микрофотографиях. Через погруженный в мембрану статор из белков с и три двойки белков и проходит белковый «стержень ротора» с прикрепленным к нему белком . Проход трех протонов через комплекс белков Fo вызывает поворот белка на 120. Роль белков а, b и состоит в том, чтобы препятствовать вращению шестерки белков из трех пар и вместе с ротором, состоящим из белков и . На рисунке представлено схематическое изображение АТФ-синтетазы из бактерии Escherichia Coli
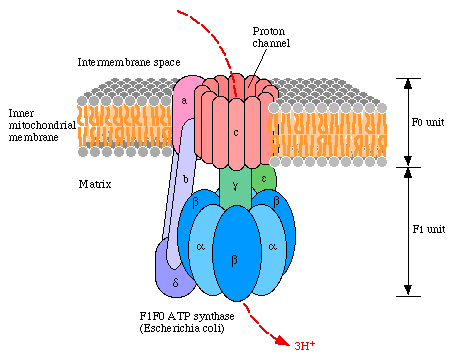
Активные центры, отвечающие за биосинтез АТФ, расположены между и субъединицами. В одном фиксированном положении активный центр открыт и в него входят и соответственно ориентируются молекулы АДФ и фосфорной кислоты. При следующем повороте на 120 субъединицы и оказываются в другом положении, и это вызывает структурную перестрой-ку в создающих активный центр белках и . В новом окружении соз-даются условия для фосфорилирования АДФ фосфорной кислотой и обра-зуется АТФ (по приведенной выше реакции активации фосфорной кислоты с образованием фосфорцентрированного катиона). В следующем повороте на 120 активный центр раскрывается и образовавшаяся молекула АТФ покидает его. Поскольку в состав комплекса Fo входят три пары и субъединиц, один полный оборот пары и в самом благоприятном случае приводит к образованию трех молекул АТФ. Интересно, что работа этой системы носит обратимый характер. В избытке АТФ ротор вращается, вызывая транспорт протонов против градиента концентраций (АТФ при этом гидролизуется на АДФ и фосфат). Аналогичные системы за счет энергии АТФ вращают жгутики бактерий и сперматозоидов.
В АТФ-синтетазе природой реализован не имеющий аналогов механизм использования энтропийного фактора для образования источника свобод-ной химической энергии. Так впервые был подтвержден постулат Э.Шре-дингера, утверждавшего, что живые системы питаются отрицательной энтропией.
Для раскрытия деталей этого механизма было использовано много ориги-нальных методик, включая, например, присоединение к выступающему из АТФ-синтетазы концу ротора длинной линейной белковой молекулы с присоединенными к функциональным группам не ее поверхности молеку-лами люминофора, светящегося в УФ-свете. Так его вращение можно было увидеть в микроскоп и даже определить скорость вращения. Весь этот комплекс исследований был отмечен Нобелевской премией 1998 года.
