
Курсовая работа / Расчет окисления SO2 - Sokol - 2006 / курсач по охт
.doc|
|
Российский химико-технологический университет им.Д.И. Менделеева Кафедра общей химической технологии
|
Курсовая работа
по теме :
«Расчет контактного аппарата окисления SO2 в SO3»
Выполнил: студент гр П-43
Соколов Виктор
Проверил: Семенов Г.М.
Москва 2006
Исходные данные
Вариант 26
SO2 в газе – 11 об.дол
O2 в газе – 10 об.дол
расход газа V = 13 000 м3/ч
конечная степень превращения 0,5
общее давление 1 атм
температура Т= 595 °С
скорость газа w= 1,15 м/с
энергия активации Е= 85 000 кДж/кмоль
коэффициент запаса φ= 1,2
константа скорости k= 14,3 при Т= 585 °С
Физико-химические основы окисления SO2
В производстве серной кислоты контактным методом окисление SO2 по реакции SO2 + 1/2О2 = SO3 происходит в присутствии катализатора. Для этого газ приводят в соприкосновение с катализатором, находящимся в стационарном или в псевдоожиженном состоянии. Количество окисленного SO2 характеризуют долей общего содержания диоксида серы в газе или в процентах (к общему первоначальному количеству SO2 в газе). Эту величину называют степенью превращения, или степенью окисления.
Способностью ускорять окисление SO2 обладают различные металлы, их сплавы и оксиды, некоторые соли, силикаты и многие другие вещества. Каждый катализатор обеспечивает определенную, характерную для него степень превращения. В заводских условиях выгоднее пользоваться катализаторами, при помощи которых достигается наибольшая степень превращения, так как остаточное количество неокисленного SO2 не улавливается в абсорбционном отделении, а удаляется в атмосферу вместе с отходящими газами.
Длительное время лучшим катализатором данного процесса считали платину, которую в мелкораздробленном состоянии наносили на волокнистый асбест, силикагель или сульфат магния. Однако платина, хотя и обладает наивысшей каталитической активностью, очень дорога. Кроме того, ее активность сильно понижается при наличии в газе самых незначительных количеств мышьяка, селена, хлора и других примесей. Поэтому применение платинового катализатора приводило к усложнению аппаратурного оформления из-за необходимости тщательной очистки газа и повышало стоимость готовой продукции.
Среди неплатиновых катализаторов наибольшей каталитической активностью обладает ванадиевый катализатор (на основе пентоксида ванадия V2O5), он более дешевый и менее чувствительный к примесям, чем платиновый катализатор.
Реакция окисления SO2 экзотермична; тепловой эффект ее, как и любой химической реакции, зависит от температуры. В интервале 400—700 °С тепловой эффект реакции окисления (в кДж/моль) с достаточной для технических расчетов точностью может быть вычислен по формуле
Q= 10 142 —9.26Т или 24 205 — 2,21Т (в ккал/моль)
где Т — температура, К.
Реакция окисления SO2 в SO3 обратима. Константа равновесия этой реакции (в Па~0.5) описывается уравнением
![]()
где Pso3, Pso2, Po2—равновесные парциальные давления SO3, SO2 и O2, Па.
Величина Кр зависит от температуры. Значения Kр в интервале
390—650°С могут быть вычислены по формуле
lgKp = 4905/T – 4,6455
Степень превращения SO2, достигаемая на катализаторе, зависит от его активности, состава газа, продолжительности контакта газа с катализатором, давления и др. Для газа данного состава теоретически возможная, т. е. равновесная степень превращения, зависит от температуры и выражается уравнением
![]()
В производственных условиях существенное значение имеет скорость окисления SO2. От скорости этой реакции зависит количество диоксида серы, окисляющегося в единицу времени на единице массы катализатора, и, следовательно, расход катализатора, размеры контактного аппарата и другие технико-экономические показатели процесса. Процесс стремятся вести так, чтобы скорость окисления SO2, а также степень превращения были возможно более высокие.
Скорость окисления SO2 характеризуется константой скорости
![]()
где k0—коэффициент; Е — энергия активации, Дж/моль; R—универсальная газовая постоянная, 8,31 Дж/(моль-К); Т — абсолютная температура, К.
Из кинетической теории газов известно, что доля молекул, обладающих энергией, достаточной для того, чтобы при их столкновении произошла реакция, составляет в первом приближении e~E/RT. Таким образом, этот член в уравнении скорости реакции характеризует долю эффективных столкновений, приводящих к образованию молекул SO3. Показатель степени в выражении e~ElRT отрицателен; следовательно, с повышением температуры скорость реакции возрастает, а с увеличением Е уменьшается.
Энергия активации Е реакции окисления SO2 в SO3 очень велика, поэтому без катализатора реакция гомогенного окисления практически не идет даже при высокой температуре. В присутствии твердых катализаторов энергия активации понижается, следовательно, скорость гетерогенной каталитической реакции возрастает. Таким образом, роль катализатора состоит в понижении энергии активации Е.
Процесс катализа состоит из нескольких этапов
-
диффузия реагирующих компонентов из ядра газового потока к зернам, а затем в порах контактной массы.
-
Сорбция кислорода катализатором (передача электронов от катализатора к атомам кислорода).
-
Сорбция молекул диоксида серы с образованием комплекса SO2-O-катализатор.
-
Перегруппировка электронов с образованием комплекса SO3-катализатор.
-
Десорбция SO3
-
Диффузия SO3 из пор контактной массы и от поверхности зерен.
Расчет контактного аппарата
Требуемый объем контактной массы для каждого слоя находим по уравнению
υ=φVτ
Так как значение φ известно, а величина V дается по условию, то для определения контактной массы необходимо установить время контакта τ,
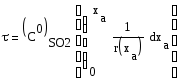
Скорость реакции окисления SO2 на ванадиевом катализаторе определяется уравнением Борескова-Иванова:
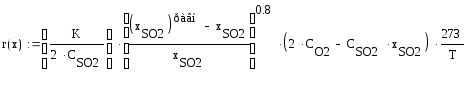
Из уравнения Аррениуса находим константу скорости для 595°С:


Константа скорости К=16,4 при Т= 595 °С
Константа равновесия описывается уравнением
lgKp = 4905/T – 4,6455
lgKp = 4905/(595+273) – 4,6455= 1, 005
Kp= 10, 13
Находим равновесную
степень превращения
![]() из
уравнения:
из
уравнения:

Подставляем свои значения константы равновесия и концентраций находим равновесную степень превращения x=0,799. Тогда:
Упрощаем: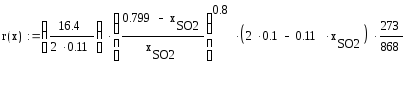
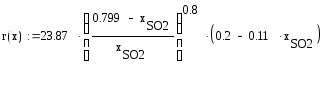
Для построения графика и решения интеграла строим таблицу
|
Ха |
0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
|
r(x) |
0 |
21,00 |
10,04 |
5,88 |
3,65 |
2,25 |
|
1/r(x) |
0 |
0,048 |
0,100 |
0,170 |
0,274 |
0,444 |
Фиктивное время соприкосновения газа с контактной массой ∑τ = 0,00836 с
Объем контактной массы
υ=φVτ=1,2*13000*0,00836 /3600= 0,036 м3
Площадь поперечного сечения реактора
F= V/3600*w = 13000/3600*1,15= 3,14 м2
Диаметр реактора

Высота слоя контактной массы
h= τ *w= 0,00836*1,15= 0,96 см
Схема контактного аппарата
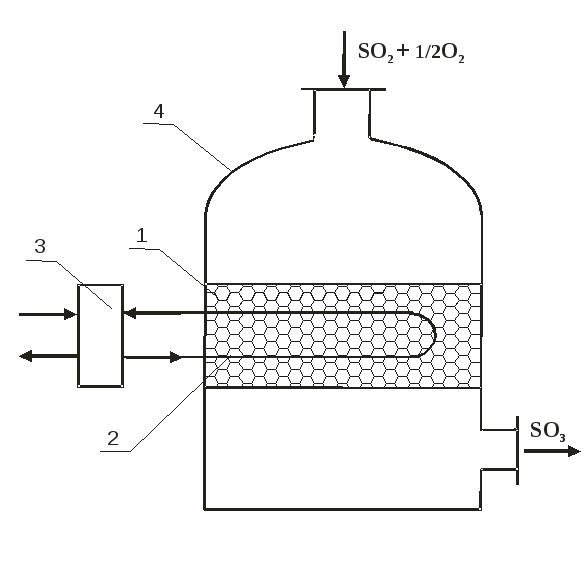
1- ванадиевая контактная масса 2- внутренний теплообменник 3- выносной теплообменник 4- корпус

