
Курсовая работа / Производство стирола - 2003 / Алексей-ОХТ / Соколов23
.doc
[Катализа-]
1
торный !• [комплекс]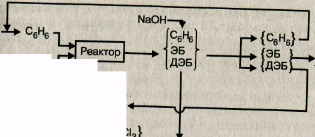
Реакция катализируется хлоридом алюминия и представляет собой электрофильное замещение в ароматическом ядре, протекающее через стадию образования промежуточного комплекса:
А1С13 + НС1 г± Н+ + А1С14~ СН2=СН2 + Н+ *± СН3-СН2+
на ректификацию
![]()
[О] + СН3-СН2+
Так как хлорид алюминия в твердом виде нерастворим в углеводородах и слабо катализирует реакцию алкилирования, на практике применяется предварительно приготовленный жидкий катализаторный комплекс хлорида алюминия с диэтилбен-золом (ДЭБ) и хлоридом водорода (комплекс Густавсона).
![]()
Комплекс Густавсона — это соль карбкатиона ДЭБ (ст-комп-лекс), окруженная сольватной оболочкой из нескольких (1—6) молекул ДЭБ, и получается пропусканием хлорида водорода при нагревании через суспензию хлорида алюминия в диэтилбен-золе.
(Н.А12С17| '(п-1)ДЭБ
Весьма эффективны также катализаторы на основе ионообменных сорбентов, например, кислотный катионит КУ-2 с активными сульфогруппами, получаемый сополимеризацией стирола с дивинилом с последующим сульфированием сополимера и омылением сульфопродукта щелочью или водой.
Алкилирование в присутствии хлорида алюминия по реакции (а) сопровождается необратимыми побочными реакциями последовательного введения этильных групп в ядро с образованием смеси продуктов различной степени алкилирования, важнейшей из которых является образование диэтилбензола:
С6Н6 + 2С2Н4 = С6Н4(С2Н5)2, (б)
а также реакции деструкции, окисления и смолообразования.
Одновременно с реакциями алкилирования протекают обратимые реакции переалкилирования полиэтилбензолов, например:
С6Н4(С2Н5)2 + С6Н6 +* 2С6Н5-С2Н5 (в)
Для подавления реакции (б) и смещения вправо равновесия реакции (в) алкилирование проводят в избытке бензола, а часть
§38
Г Кислые ] •\ продукты Ь [окисления]
Рис. 15.9. Принципиальная схема производства этилбензола:
I ЭБ-этилбензол, ДЭБ-диэтилбензол
образующегося ДЭБ возвращают в цикл. На рис. 15.9 представлена принципиальная схема производства этилбензола алкили-рованием бензола этиленом. Технологическая схема и парамет-1гры процесса алкилирования бензола рассматриваются ниже на •примере производства изопропилбензола в главе XVI.
Процесс алкилирования может проводиться в жидкой или в даровой фазе, при температуре от 95°С до 450°С и мольном отно-<шении бензол/этилен от 2:1 до 6:1. Полученный алкилат содержит 12—35% массовых этилбензола, 55—85% массовых бензола и 2,5—8% массовых диэтилбензола. Современные установ-|си по производству этилбензола достигают мощности 740 тыс. т продукта в год. Выход этилбензола в расчете на бензол составляет 95%, при расходных коэффициентах на 1 т продукта: бензол 0,77 т, этилен 0,3 т, хлорид алюминия 0,03 т.
История. Стирол впервые был выделен и идентифицирован в 1839 г. В. Симоном из стиракса — смолы амбрового дерева. Им же было дано «временное название углеводорода. Ш. Жерар и А. Каур в 1841 г. по--Дучили стирол разложением коричной кислоты, определили его состав |и дали название «циннамон». В 1845 г. Э. Копп установил тождественность обоих веществ. В 1867 г. А. Бертло синтезировал стирол, пропуская через раскаленную трубку смесь паров бензола и ацетилена. рн же установил присутствие стирола в ксилольной фракции камен-.ноугольной смолы. Стирол содержится также во многих продуктах тер-'мической деструкции органических веществ, в продуктах пиролиза рриродного газа, крекинга и пиролиза нефтепродуктов и сланцевом асле.
Промышленное производство стирола в нашей стране было орга-нзовано в 1949 г. на Воронежском заводе синтетического каучука из 'илбензола, получаемого алкилированием бензола. В 60-х годах ус-
^
339
