
РОССИЙСКИЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ
УНИВЕРСИТЕТ
им. Д. И. Менделеева
кафедра общей химической технологии
Курсовая работа:
“Расчет материального баланса производства азотной кислоты”
Выполнил: Магсумов М.И.
гр.: О-42
Руководитель: Игнатенков. В.И.
г. Москва
2001г.
Содержание.
|
Введение. 1. Данные для расчета. 2. Структурная и операторные схемы производства азотной кислоты. 3. Материальный баланс производства разбавленной азотной кислоты. 4. Материальный баланс контактного агрегата. 5. Материальный баланс конденсатора. 6. Материальный баланс абсорбционной установки. 7. Материальный баланс сборника азотной кислоты. |
3 4 5 6 9 10 11 13 |
Введение.
В 1914 г. разработан и в 1916 г. в Донецке пущен в эксплуатацию цех азотной кислоты на основе аммиака коксового газа. Сейчас получение азотной кислоты из аммиака - основной способ ее производства.
Сырьем является синтетический аммиак, кислород воздуха и вода.
Химическая схема и характеристики реакций следующие:
4NH3 + 5O2 = 4NO + 6H2O – реакция окисления аммиака экзотермическая, протекает во внешнедиффузионной области на платиновом катализаторе в виде сеток; температура
800 – 900 0С; концентрация NH3 – 10%;
NO +
![]() O2
= NO2 – реакция
газофазная, обратимая, экзотермическая;
O2
= NO2 – реакция
газофазная, обратимая, экзотермическая;
2NO2 + H2O
+
![]() O2
= 2HNO3 – гетерогенный
(«газ – жидкость») химический процесс
с дополнительным окислением.
O2
= 2HNO3 – гетерогенный
(«газ – жидкость») химический процесс
с дополнительным окислением.
1. Данные для расчета.
-
Производительность агрегата: 500 т/сутки.
-
Давление газа в системе: 7,3 ат.
-
Выход по поглащению: 98%.
-
Температура воздуха: 120 0С.
-
Содержание NH3 в АВС: 10%об.
-
Степень конверсии до NO: 96%.
-
Относительная влажность воздуха: 65%.
-
Общая степень конверсии: 98%.
2. Структурная и операторная схемы производства азотной кислоты.
1. Структурная схема производства азотной кислоты:

 вода пар
вода пар
1 2 6 7,8 9
N







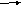 H3
H3





 вода вода
вода вода





 5 газы
5 газы
 11
11





 воздух 3 10
воздух 3 10








 12
12
вода 4



2. Операторная схема синтеза азотной кислоты.
 вода вода
вода вода
1 2 6 7 8 9
N H3
H3

 вода пар
вода пар
11 10 5



3
воздух


12
 вода 4
вода 4
Т ехнологические
единицы:
ехнологические
единицы:
1 – испаритель аммиака;


































 2
– нагреватель аммиака;
2
– нагреватель аммиака;
3 – компрессор;
4 – холодильник;
5 – теплообменник;
6 – смеситель;
7 – реактор окисления аммиака;
8 – котел – утилизатор;
9 – окислитель;
10 – конденсатор;
11 – абсорбционная колонна;
12 – сборник азотной кислоты.
3. Материальный баланс производства разбавленной азотной кислоты.
Для расчета материального баланса представим материальные потоки, входящие в реакционный узел и выходящие из него:
аммиак азотная кислота (разб.)
 воздух
аммиак
воздух
аммиак
вода газы (N2, O2,NO2)
Сначала составим материальный баланс производства 100%-ой азотной кислоты из аммиака и чистого кислорода.
Расчет начинаем с последней протекающей реакции:
3NO2 + H2O = 2HNO3 + NO.
Производительность установки – G
HNO![]() = 400 т/сутки или NHNO
= 400 т/сутки или NHNO![]() =
=
![]() = 6349.2
= 6349.2![]() ;
;
При 100%-ом выходе по поглащению рассчитываем расходы реагентов:
NNO![]() =
=
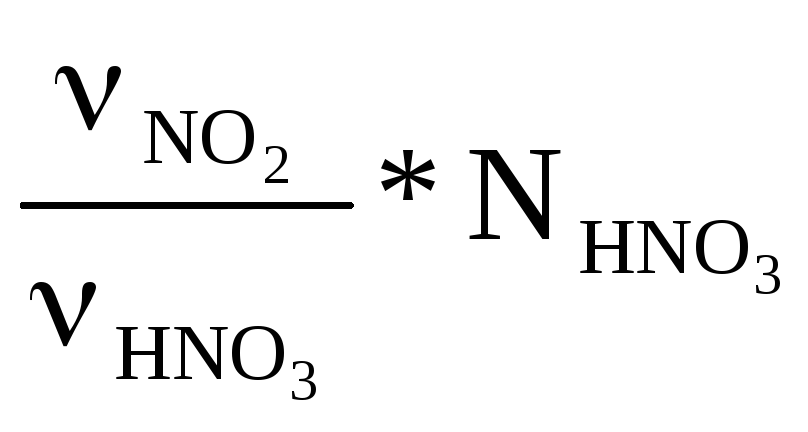 =
=![]() =9523.8
кмоль/сут.
=9523.8
кмоль/сут.
NH![]() O=
O=
![]() =3174.6
кмоль/сут.
=3174.6
кмоль/сут.
NNO = 3174.6 кмоль/сут.
При 97%-ом выходе по поглащению при той же производительности по азотной кислоте имеем:
NNO![]() =9523.8/0,97=9818.35;
следовательно в реакцию не вступает
ΔNNO
=9523.8/0,97=9818.35;
следовательно в реакцию не вступает
ΔNNO![]() =
294.55 кмоль/сут.
=
294.55 кмоль/сут.
NH![]() O
= 3174.6/0,97=3272.78; в реакцию не вступает
ΔNH
O
= 3174.6/0,97=3272.78; в реакцию не вступает
ΔNH![]() O
= 98.18 кмоль/сут.
O
= 98.18 кмоль/сут.
Используемый на последней стадии NO2, образуется в процессе окисления NO по реакции:
2NO + O2 = 2NO2.
По известному количеству NO2 рассчитаем необходимое количество О2 и NO:
NO![]() =
9523.8/2 = 4761.9 кмоль/сут.
=
9523.8/2 = 4761.9 кмоль/сут.
NNO = 9523.8 кмоль/сут.
Зная количество NO, которое получается по реакции поглащения, определим количество, получаемое по реакции окисления аммиака:
NNO = 9523.8 – 3174.6 = 6349.2 кмоль/сут.
Определим количество аммиака и кислорода, необходимого для получения
6349.2 кмоль/сут. NO по реакции окисления, а также количество образующейся воды:
4NH3 + 5O2 = 4NO + 6H2O;
NNH![]() =
6349.2 кмоль/сут.
=
6349.2 кмоль/сут.
NO![]() =
7936.5 кмоль/сут.
=
7936.5 кмоль/сут.
NH![]() O
= 9523.8 кмоль/сут.
O
= 9523.8 кмоль/сут.
Степень конверсии до NO составляет 93%, следовательно необходимое количество аммиака будет:
NNH![]() =
6349.2/0,93 = 6827.1 кмоль/сут.
=
6349.2/0,93 = 6827.1 кмоль/сут.
Общая степень конверсии аммиака составляет 97%, следовательно, 4% (204.8 кмоль/сут) исходного аммиака вступает в побочную реакцию:
4NH3 + 3O2 = 2N2 + 6H2O;
По реакции образуется 102.4 кмоль\сут. N2 и 307.2 кмоль/сут. H2O, расходуется 153.6 кмоль/сут O2.
В реакцию окисления не вступает 204.8 кмоль/сут. NH3 и 443.77 кмоль/сут О2.
Определим общее количество воды, образующейся в процессе получения азотной кислоты:
NΣH2O=9523.8 + 307.2 – 3174.6 = 6656.4 кмоль/сут.
Определим общее количество израсходованного кислорода:
NΣO2 = 4761.9 + 7936.5 + 443.77 + 153.6 = 13295.77 кмоль/сут.
По результатам расчета составим таблицу материального баланса производства 100%-ой азотной кислоты из аммиака и чистого кислорода:
|
Вход |
N, кмоль/сут |
G, тонн/сут |
Выход |
N, кмоль/сут |
G, тонн/сут |
|
NH3 |
6827.1 |
116.1 |
NH3 |
204.8 |
3.5 |
|
O2 |
13295.77 |
425.5 |
N2 |
102.4 |
2.9 |
|
|
|
|
NO2 |
294.55 |
13.5 |
|
|
|
|
H2O |
6656.4 |
119.8 |
|
|
|
|
HNO3 |
6349.2 |
400 |
|
|
|
|
О2 |
443.77 |
14.2 |
|
ИТОГО |
|
541.6 |
ИТОГО |
|
|
Δ = 0,00147%.
Запишем суммарное уравнение процесса:
8520,3NH3 + 16724,4O2 = 170,4NH3 + 85,2N2 + 243NO2 + 8556,36H2O+7937HNO3+298,2O2.
В промышленности получают разбавленную азотную кислоту.
Рассчитаем количество воды, которое необходимо добавить к продукту, чтобы получить 55%-ую азотную кислоту:
500 – 55%
Х – 100%; Х=909,1 тонн/сут. (кол-во разб. азотной кислоты)
Необходимо добавлять:
GH2O=909,1 – 500 = 409,1 тонн/сутки. Но, известно, что в процессе образуется 154,1 тонн/сут
воды, следовательно необходимо добавлять: 409,1 – 154,1 = 255 тонн/сут воды.
Данное утверждение верно, если в процессе используется сухой воздух.
В рассчитываемом процессе относительная влажность воздуха составляет 65%.
Рассчитаем количество воздуха, которое необходимо подавать в реакционный узел и количество воды, приходящее с ним:
По условию концентрация аммиака в АВС
равна 10%об, следовательно в
смеситель необходимо подавать: Nвозд=
![]() =85203-8520,3=76682,7
кмоль/сут или Gвозд=2211,53тонн/сут
=85203-8520,3=76682,7
кмоль/сут или Gвозд=2211,53тонн/сут
С воздухом, подаваемым в смеситель, подается 16103,37кмоль/сут(515,31 тонн/сут) О2 и 60579,33 кмоль/сут(1696,22 тонн/сут) N2.
Для протекания процесса необходимо
535,18 тонн/сут О2, следовательно
дополнительное количество воздуха
подается в конденсатор, минуя смеситель.
Рассчитаем это количество: ΔGO![]() =19,87
тонн/сут., ΔGN
=19,87
тонн/сут., ΔGN![]() =65,4
тонн/сут, ΔGвозд=85,27
тонн/сут.
=65,4
тонн/сут, ΔGвозд=85,27
тонн/сут.
Суммарное количество воздуха равно:
GΣвозд=2296,8
тонн/сут. в т.ч. GΣО![]() =535,18
тонн/сут, GΣN
=535,18
тонн/сут, GΣN![]() =1761,62
тонн/сут.
=1761,62
тонн/сут.
Определим количество воды, поступающей с воздухом:
Влагосодержание парогазовой смеси
определяется по формуле: x=0,622*![]() ,
где
,
где
П – общее давление смеси, 0,101МПа, Рнас – давление насыщенного пара при t=300C, 0,004241МПа, φ – относительная влажность воздуха.
х=0,622*![]()
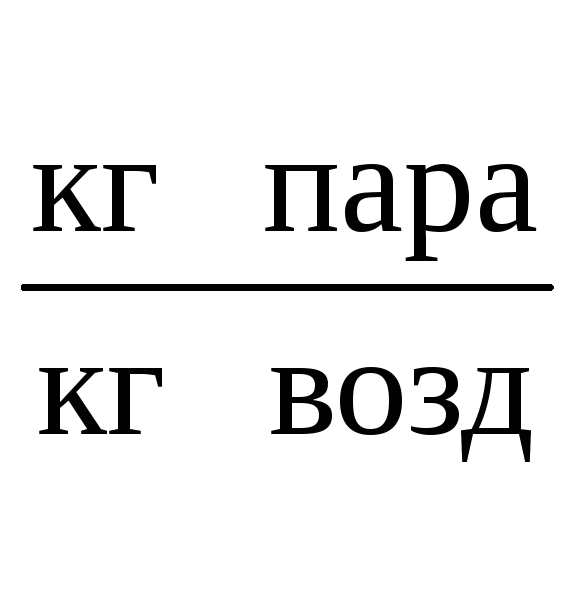 .
.
GH2O=0,01772*2296,8=40,7 тонн/сут.
Следовательно, для получения 55%-ой кислоты в реакционный узел необходимо добавить:
GH2O=255 – 40,7=214,3 тонн/сут.
Данные расчета запишем в таблицу материального баланса реакционного узла получения 55%-ой азотной кислоты из аммиака и кислорода воздуха:
|
Вход |
N, кмоль/сут |
G, тонн/сут |
Выход |
N, кмоль/сут |
G, тонн/сут |
|
NH3 |
8520,3 |
144,85 |
NH3 |
170,4 |
2,9 |
|
Воздух в т. ч.: О2 N2 H2O |
16724,4 62915 2273,3 |
2337,5 535,18 1761,62 40,7 |
NO2 |
243 |
11,178 |
|
O2 |
298,2 |
9,54 |
|||
|
N2 |
63000 |
1764 |
|||
|
55% р-рHNO3 |
|
909,1 |
|||
|
H2O |
11893,33 |
214,3 |
в т. ч.: HNO3 H2O |
7937 22727,78 |
500 409,1 |
|
ИТОГО |
|
2696,65 |
ИТОГО |
|
2696,72 |
Δ=0,0026%.
Запишем суммарное уравнение процесса(в тонн/сут):
144,85NH3 + 535,18O2 + 1761,62N2 + 255H2O = 2,9NH3 + 1764N2 + 11,178NO2 +
909,1HNO3(р-р 55%) + 9,54O2.
По данным расчета определим расходные
коэффициенты(![]() )
всех входящих потоков(
)
всех входящих потоков( ):
):
![]() NH
NH![]() =0,159;
=0,159;
![]() возд=2,571;
возд=2,571;
![]() H
H![]() O=0,236.
O=0,236.
4. Материальный баланс контактного агрегата (реактора окисления NH3).
Для расчета материального баланса представим материальные потоки, входящие в реакционный узел и выходящие из него:
Контактный агрегат

АВС газовая смесь
(вода, азот, кислород,
аммиак, NO)
В контактном агрегате протекают следующие процессы:
4NH3 + 5O2 = 4NO + 6H2O;
4NH3 + 3O2 = 2N2 + 6H2O;
Аммиачновоздушная смесь, с 10%-ым по объему содержанию аммиака, образуется в смесителе. Полная степень конверсии аммиака: 98%.
Степень конверсии по NO – 96%.
Определим количество аммиачновоздушной смеси и ее состав:
Для расчета пользуемся данными из материального баланса получения разбавленной азотной кислоты.
Количество влажного воздуха, подаваемого в смеситель: Gвозд=2211,53(1+0,01772)=2250,72 тонн/сут., в т.ч.:
GO![]() =515,31
тонн/сут.(16103,37 кмоль/сут), GN
=515,31
тонн/сут.(16103,37 кмоль/сут), GN![]() =1696,22
тонн/сут.(60579,33 кмоль/сут), GH
=1696,22
тонн/сут.(60579,33 кмоль/сут), GH![]() O=39,19
тонн/сут.(2177,2 кмоль/сут).
O=39,19
тонн/сут.(2177,2 кмоль/сут).
Количество подаваемого аммака: GNH![]() =144,85
тонн/сут.(8520,3 кмоль/сут).
=144,85
тонн/сут.(8520,3 кмоль/сут).
Количество АВС: GАВС=
GNH![]() +
Gвозд=144,85+2250,72=2395,57 тонн/сут.
+
Gвозд=144,85+2250,72=2395,57 тонн/сут.
Определим количество и состав газов, выходящих из контактного аппарата.
ΔGNH![]() =144,85*0,98=141,95
тонн/сут.( 8350,18кмоль/сут).
=144,85*0,98=141,95
тонн/сут.( 8350,18кмоль/сут).
GNH![]() =144,85–141,95=2,9тонн/сут(170,59кмоль/сут),
=144,85–141,95=2,9тонн/сут(170,59кмоль/сут),
GNO=8520,3*0,96*30/1000=245,38 тонн/сут(8179,5 кмоль/сут),
GN![]() =8520,3*0,02*0,5*28/1000+1696,22=1698,6
тонн/сут(60664,49 кмоль/сут).
=8520,3*0,02*0,5*28/1000+1696,22=1698,6
тонн/сут(60664,49 кмоль/сут).
GO![]() =515,31-(
=515,31-(![]() *8179,5+
*8179,5+![]() *85,2)*32/1000=184,04
тонн/сут(5751,26 кмоль/сут).
*85,2)*32/1000=184,04
тонн/сут(5751,26 кмоль/сут).
GH![]() O=39,19+(3*85,2+1,5*8179,5)*18/1000=264,64
тонн/сут(14702,07 кмоль/сут)
O=39,19+(3*85,2+1,5*8179,5)*18/1000=264,64
тонн/сут(14702,07 кмоль/сут)
По данным расчета составим таблицу материального баланса контактного аппарата:
|
Вход |
N, кмоль/сут |
G, тонн/сут |
Выход |
N, кмоль/сут |
G, тонн/сут |
|
АВС в т. ч.: NH3 O2 N2 H2O |
8520,3 16103,37 60579,33 2177,22 |
2395,57 144,85 515,31 1696,22 39,19 |
NH3 N2 O2 NO H2O |
170,59 60664,49 5757,26 8179,5 14702,07 |
2,9 1698,6 184,04 245,38 264,64 |
|
ИТОГО |
|
2395,57 |
ИТОГО |
|
2395,56 |
Δ=0,00042%.
Запишем суммарное уравнение процесса, протекающего в контактном аппарате(т/с):
144,85NH3 + 515,31O2 + 1696,22N2 + 39,19H2O = 2,9NH3 + 1698,6N2 + 245,38NO + 184,04O2 + 256,27H2O.
5. Материальный баланс конденсатора.


 Газы после окислителя газы на
абсорбцию(NO2, N2,
NH3)
Газы после окислителя газы на
абсорбцию(NO2, N2,
NH3)








разб. HNO3

Из материального баланса контактного аппарата находим массу газов после окислителя: Gгазов=2395,55 тонн/сут.
В окислителе до конца протекает реакция: 2NO + O2 = 2NO2
Следовательно, на выходе из него состав смеси газов будет следующий:
GNH3=2,9 тонн/сут(170,59 кмоль/сут),
GN2=1698,6 тонн/сут(60664,49 кмоль/сут),
GH2O=264,64тонн/сут(14702,07кмоль/сут),
GNO2=GNO*46/30=376,25тонн/сут(8179,5кмоль/сут),
GO2=184,04- NNO*32*0,5/1000=53,17 тонн/сут(1661,5 кмоль/сут).
При уменьшении температуры конденсируется вода из газовой смеси и происходит абсорбция нитрозного газа по реакции:
3NO2 + H2O = 2HNO3 + NO.
При адсорбции образуется разбавленная азотная кислота и NO, который окисляется кислородом до NO2 по реакции: 2NO + O2 = 2NO2.
Суммарная реакция:
2NO2
+ H2O
+
![]() O2
= 2HNO3.
O2
= 2HNO3.
В недостатке (по балансу) находится кислород, следовательно он полностью расходуется по реакции.
Определим потоки веществ:
GNH3=2,9 тонн/сут(170,59 кмоль/сут),
GN2=1698,6 тонн/сут(60664,49 кмоль/сут),
GNO2=376,25-4*1661,5*46/1000=70,534 тонн/сут(1533,35 кмоль/сут),
GН2O=264,64-2*1661,5*18/1000=204,83 тонн/сут(11379,22 кмоль/сут).
GНNO3=4*1661,5*63/1000=418,7 тонн/сут(6646 кмоль/сут).
Полученная кислота растворяется в воде и сливается в сборник азотной кислоты:
GНNO3(р-р)=204,83+418,7=623,53 тонн/сут.
Концентрация кислоты равна: (418,7/623,53)*100=67,15%.
Оставшиеся газы подаются на абсорбцию и доокисление в колонну.
По данным расчета составим таблицу материального баланса конденсатора.
|
Вход |
N, кмоль/сут |
G, тонн/сут |
Выход |
N, кмоль/сут |
G, тонн/сут |
|
NH3 N2 O2 NO2 H2O |
170,59 60664,49 1661,5 8179,5 14702,07 |
2,9 1698,6 53,17 376,25 264,64 |
NH3 N2 NO2 HNO3(р-р) в т. ч.:HNO3 H2O |
170,59 60664,49 1533,35
6646 11379,22 |
2,9 1698,6 70,534 623,53 418,7 204,83 |
|
ИТОГО |
|
2395,56 |
ИТОГО |
|
2395,564 |
Δ=0,00017%.
6. Материальный баланс абсорбционной установки.
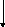 вода
вода
 г
г
 азы
после конденсатора газы(NH3,
O2, N2,
NO2)
азы
после конденсатора газы(NH3,
O2, N2,
NO2)


 дополнительный
воздух
дополнительный
воздух

 р-р
HNO3
р-р
HNO3

Определим количество дополнительного влажного воздуха, подаваемого в колонну:
Gвозд=85,27*(1+0,01772)=86,78 тонн/сут., в т. ч. GO2=19,87 тонн/сут.(620,94кмоль/сут), GN2=65,4 тонн/сут.(2335,71кмоль/сут), GH2O=1,51 тонн/сут.(83,89кмоль/сут).
Для абсорбции образовавшегося NO2 и получения разбавленной азотной кислоты сверху абсорбционной колонны подают 214,3 тонн/сут.(11893,33 кмоль/сут) воды(см. расет выше).
Состав и количество газов после конденсатора представим в виде таблицы:
|
Выход |
N, кмоль/сут |
G, тонн/сут |
|
NH3 N2 NO2
|
170,59 60664,49 1533,35
|
2,9 1698,6 70,534 |
Суммарная реакция, протекающая в абсорбционной колонне:
2NO2
+ H2O
+
![]() O2
= 2HNO3.
O2
= 2HNO3.
Из колонны выходит смесь газов и разбавленная азотная кислота. Определим состав и количество газов (см. расчет материального баланса производства разбавленной азотной кислоты):
GNН3=2,9 тонн/сут.(170,59 кмоль/сут),
GN2=1764 тонн/сут.(63000 кмоль/сут),
GNО2=11,18 тонн/сут.(243 кмоль/сут),
GО2=9,54 тонн/сут.(298,2 кмоль/сут).
Определим количество и концентрацию образующейся азотной кислоты:
GН2О=214,3+1,51-2*(620,94-298,2)*18/1000=204,19 тонн/сут.(11343,96 кмоль/сут).
GНNO3=4*(620,94-298,2)*63/1000=81.33тонн/сут.(1290.96кмоль/сут).
Производительность колонны по разбавленной азотной кислоте:
GНNO3(р-р)=204,19+81,33=285,52 тонн/сут.
Концентрация азотной кислоты равна 81,33/285,52*100=28,48%.
По данным расчета составим таблицу материального баланса абсорбционной колонны:
|
Вход |
N, кмоль/сут |
G, тонн/сут |
Выход |
N, кмоль/сут |
G, тонн/сут |
|
воздух в т.ч.: O2 N2 H2O |
620,94 2335,71 83,89 |
86,78 19,87 65,4 1,51 |
NH3 |
170,4 |
2,9 |
|
NO2 |
243 |
11,178 |
|||
|
O2 |
298,2 |
9,54 |
|||
|
H2O |
11893,33 |
214.3 |
N2 |
63000 |
1764 |
|
NH3 N2 NO2 |
170,59 60664,49 1533,35
|
2,9 1698,6 70,534 |
28,48%р-рHNO3 в т.ч. HNO3 H2O |
1290.96 11343,96 |
285,52 81.33 204.19 |
|
ИТОГО |
|
2073,114 |
ИТОГО |
|
2073,138 |
Δ=0,00116%.
7. Материальный баланс сборника азотной кислоты.
Для простоты расчета будем считать, что азотная кислота не разлагается.








67,15%-ая азотная кислота
из конденсатора 28%-ая азотная кислота
из абсорбционной колонны
на склад
Цель расчета материального баланса сборника заключается в определении концентрации получаемой азотной кислоты.
Определим общее количество воды и кислоты поступающих в сборник:
GH![]() O=204,19+204,83=409,02
тонн/сут(22723,33кмоль/сут).
O=204,19+204,83=409,02
тонн/сут(22723,33кмоль/сут).
GHNO3=81,33+418,83=500,16 тонн/сут(7939 кмоль/сут).
Производительность по разбавленной кислоте: GHNO3(р-р)=909,18 тонн/сут.
Концентрация получаемой кислоты равна: 500,16/909,18*100=55%.
Сравнивая данные, полученные при составлении материальных балансов всего реакционного узла производства азотной кислоты и отдельных элементов, можно сделать вывод о совпадении значении материальных потоков каждого из веществ, что говорит о корректности проведенных расчетов.
