
Курсовая работа / Расчет окисления SO2 (подробно) - 2000.zip / course
.doc
 Российский
Химико-Технологический Университет
имени Д.И. Менделеева
Российский
Химико-Технологический Университет
имени Д.И. Менделеева
Кафедра Общей Химической Технологии
Курсовая работа
«Расчет контактного аппарата окисления SO2 в SO3»
Вариант
Выполнила:
Проверила: Давидханова М.Г.
Москва - 2000
Исходные данные
-
Состав обжигового газа после обжига серосодержащего сырья в атмосфере воздуха:
-
Состав
Объемные %
SO2
18.10
SO3
0.21
Н2О
4.60
О2
2.70
N2
74.39
-
Перед подачей в реактор газ подвергается осушке и очистки от SO3, а также дополнительно разбавляется воздухом до содержания SO2 (объемные %):
Концентрация в объемн.% SO2 8,00
-
Окисление SO2 осуществляется в несколько стадий контактирования в каталитическом реакторе:
Каталитический реактор с вводом холодного сухого воздуха после 1 слоя катализатора и промежуточными теплообменниками между остальными слоями катализатора.
-
Заданная производительность установки (в тоннах 100%-ной серной кислоты в сутки):
П (H2SO4) 1000
Состав реакционной смеси перед реактором.
|
|
18.10 |
7.8 |
|
SO3 |
0.21 |
|
|
Н2О |
4.60 |
|
|
О2 |
1.6 |
|
|
N2 |
80.2 |
|
CSO![]() =
=![]()
![]()
Коэффициент
разбавления =
![]()
SO2 + 0.5 O2 = SO3
SO3
+ Н2О =
Н2SO![]()
1 кмоль SO2 - 1 кмоль Н2SO4
22,4 м3 SO2 - 98 кг Н2SО4
Х м3 SO2 - 1.3*106 кг/сутки Н2SO4 (производительность)
V
SO![]() = Х = 29,71*104 м3/сутки = 3,44 м3/с
= Х = 29,71*104 м3/сутки = 3,44 м3/с
V
Н![]() О
=
О
=
![]()
VO![]() =
=
![]()
VN![]() =
=
![]()
V
после очистки = VSO![]() + VN
+ VN![]() + VO
+ VO![]() =
3.44 + 21.22 + 0.42 = 25.08
=
3.44 + 21.22 + 0.42 = 25.08
V после разбавления = V после очистки * коэффициент разбавления = 25,08 * 1,76 =44,14 (обозначим как Vп)
V(N![]() + O
+ O![]() )
= V после разбавления – VSO
)
= V после разбавления – VSO![]() = 44,14 – 3,44 =40,70
= 44,14 – 3,44 =40,70
VN![]() = 0.79 * V(N
= 0.79 * V(N![]() +
O
+
O![]() )
= 0.79*40.70 =32.153
)
= 0.79*40.70 =32.153
VO![]() = 0.21 * V(N
= 0.21 * V(N![]() +O
+O![]() )
= 0.21*40.70 =8.5
)
= 0.21*40.70 =8.5
CSO![]() =
=
![]()
CN![]() =
=![]()
CO![]() =
=
![]()
CSO![]() + CN
+ CN![]() + CO
+ CO![]() = 7.79 + 72.84 + 19.37 = 100
= 7.79 + 72.84 + 19.37 = 100
Значение равновесной степени превращения диоксида серы (Хравн.) в зависимости от температуры.
Используем формулы:
Lg
Кр =
![]()
И ХSO![]() =
=
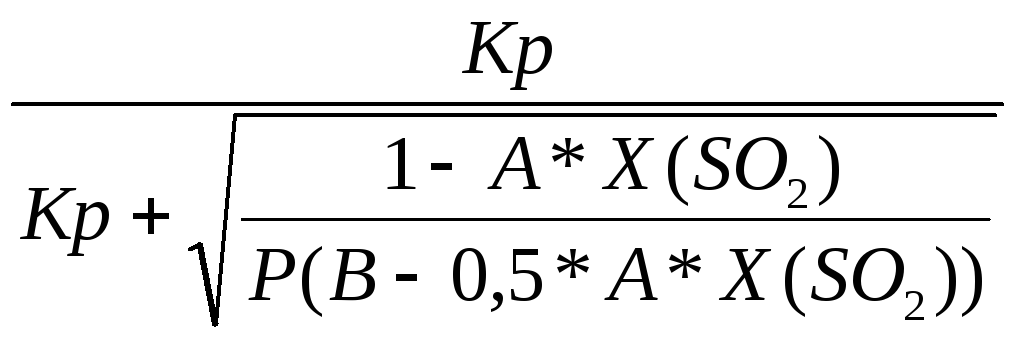
Где Т = 650 –900К
Р = 1 атм
А = 0,0779
В = 0,1937
Дальше считаю по программе (которую делала сама) и получаю результат:
Оптимальная температурная последовательность.
R
=
![]()
Где:
А = 0,0779
В = 0,1937
Т = 650-900К
Х = 0,8-0,99
Lg
Кравн =
![]()
К-константа скорости реакции [1/(атм * сек)]:
-
Если Т<673К, то LgK = 21,9-
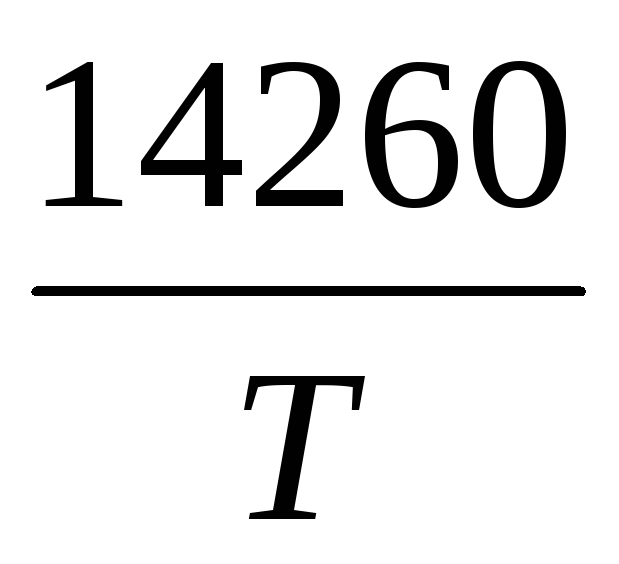

-
Если 673К <= Т => 803K, то LgК = 1,66-

-
Если Т > 803K, то К = 1,36
Для этого определим зависимость скорости реакции от температуры для 6 значений степени превращения (Х), выбранных в интервале от 0,8 до 0,99, установив интервал варьирования температуры 10 град.
Считаем по программе (делала сама) и получаем результат:
Построила зависимость r (T) для выбранных значений степени превращения и определила температуры Т (опт), соответствующие максимумам скорости (r мах) для каждого выбранного значения Х.
|
Х |
R мах(1/с) |
Т опт (К)
|
|
0,8 |
0,61587 |
804 |
|
0,83 |
0,49435 |
792 |
|
0,85 |
0,42030 |
782 |
|
0,87 |
0,34950 |
774 |
|
0,89 |
0,28206 |
764 |
|
0,9 |
0,24963 |
760 |
![]()
На диаграмму Х-Т вместе с равновесной линией Хравн (Т) наношу найденные значения Топт и строю линию оптимальных температур ЛОТ.
Чтобы точнее построить ЛОТ я беру Х = от 0,8 до 0,99 с шагом 0,01 и Т = 650-900К.
Пользуюсь программой лабораторного практикума по ОХТ.
Задаю:
Т = 650-900К
Х = 0,8-0,99
А = 0,0779
В = 0,1937
Р = 1 атм
И получаю значения:
Ограничиваю область протекания процесса окисления в реакторе величиной скорости реакции r = 0.8*r мах для каждого выбранного Х. Наношу их на диаграмму r – Т, определяю температуру, соответствующую r = 0.8*r мах.
-
R = 0.8 * 0.61587 = 0.4927
-
R = 0.8 * 0.49435 = 0.39548
-
R = 0.8 * 0.42030 = 0.33624
-
R = 0.8 * 0.34950 = 0.2796
-
R = 0.8 * 0.28206 = 0.2256
-
R = 0.8 * 0.24963 = 0.1997
Находим значения температур:
|
Т1 |
Т2
|
|
736 |
832 |
|
723 |
823 |
|
715 |
816 |
|
710 |
802 |
|
701 |
798 |
|
690 |
792 |
На диаграмме Х-Т изображаю температурный режим окисления в каталитическом реакторе. Для этого определим положение адиабаты, соответствующей разогреву в 1-ом слое катализатора, используя формулу:
![]() Тад
=
Тад
=
![]()
где: Qр – тепловой эффект реакции
А – концентрация SO2 = 0,0779
Cр – теплоемкость смеси
Qр
= -![]() Н
Н
![]() Н
= - 101420 + (9,26*Т) = -101420 + (9,26*693) = -95*103 Дж/моль
= -95 КДж/моль
Н
= - 101420 + (9,26*Т) = -101420 + (9,26*693) = -95*103 Дж/моль
= -95 КДж/моль
Qp = 95 КДж/моль * 44,64 моль/м3 = 4240,8 КДж/м3
Ср =
АSO![]() * СрSO
* СрSO![]() +ВO
+ВO![]() * CpO
* CpO![]() + YN
+ YN![]() * CpN
* CpN![]()
Cp берем из справочника при Т = 500 С в КДж/м3*С
Ср = (0,0779 * 2,068) + (0,1937 * 1,403) + (0,7284 * 1,331) = 0,1611 + 0,2718+0,9695 = 1,4024 КДж/м3*С
![]() Тад =
Тад =![]()
Чтобы построить адиабату использую программу лабораторного практикума с кафедры ОХТ.
Задаю:
Хн = 0
Хк = 0,99
Тн = 693К
Тх.г. = 473К
А = 0,0779
В = 0,1937
Р = 1 атм
![]() Тад
= 235,6
Тад
= 235,6
и получаю результат:
|
Слой |
Хн |
Хк |
Тн |
Тк |
|
V
|
|
1 |
0 |
0.7230 |
693.0 |
863.3 |
0.195 |
0.621 |
|
2 |
0.4488 |
0.8815 |
715.0 |
817.3 |
0.358 |
1.000 |
|
3 |
0.8815 |
0.9674 |
719.4 |
739.6 |
0.536 |
1.000 |
|
4 |
0.9674 |
0.9848 |
707.3 |
711.4 |
0.757 |
1.000 |
|
5 |
0.9848 |
0.9900 |
689.6 |
690.8 |
1.579 |
1.000 |
Объем катализатора в каждом слое
V(катализатора)
= VSO![]() *
*
![]()
Где
VSO![]() –
объемный расход (или объемная
скорость) м3/сек = 3.44 м3/сек
–
объемный расход (или объемная
скорость) м3/сек = 3.44 м3/сек
Сначала я нахожу объем маленькой клеточки.
20 клеток – 1 20 клеток – 0,1
1 клетка –Х 1 клетка - у
Х = 0.05 –ось у у =0.005 – ось х
Тогда площадь одной клеточки будет:
S0= Х *У = 0.05 * 0.005 = 0.00025 сек.
Находим площадь каждого слоя по формуле: S = S0 * число клеточек;
А затем
находим объем катализатора по формуле:
V = VSO![]() * S, где [VSO
* S, где [VSO![]() ]
= [м3/сек], а [S]
= [сек]
]
= [м3/сек], а [S]
= [сек]
В первом слое:
S1 = 1027 * 0.00025 = 0.257 сек.
V1 = 3.44 *0.257 = 0.88 м3
Во втором слое:
S2 = 1948 * 0.00025 = 0.487 сек.
V2 = 3.44 * 0.487 = 1.675 м3
В третьем слое:
S3 = 1664 * 0.00025 = 0.416 сек.
V3 = 3.44 * 0.416 = 1.431 м3
В четвертом слое:
S4 = 440 * 0.00025 = 0.11 сек.
V4 = 3.44 * 0.11 = 0.378 м3
В пятом слое:
S5 = 323 * 0.00025 = 0.081 сек.
V5 = 3.44 * 0.081 = 0.279 м3
Список используемой литературы
-
Амелин А.Г. Технология серной кислоты. М. Химия, 1983, 360с.
-
Общая химическая технология в 2-х частях (под ред. Мухленова) М. Высшая школа. 1977,288с.
-
Бесков В.С., Давидханова М.Г., Царев В.И. Автоматизированная система расчетных работ в общеинженерных курсах по химической технологии. Учебное пособие (РХТУ им. Д.И. Менделеева. М., 1997, 83с.)
-
Общая химическая технология. Под редакцией проф. Амелина А.Г. М., Химия, 1977

 SO2
SO2