
Химия_очное / khimia
.docxТест по теме 2.3.: Элементы химической термодинамики
|
код |
1-й уровень |
|
2.1.3.4./1 |
1. Стандартным условиям соответствуют:
Эталон ответа: г).
|
|
2.1.1.2./1 |
2. Термодинамическими функциями являются
Эталон ответа: а); в); г).
|
|
2.1.1.4./1 |
3. Размерность энтальпии
Эталон ответа: г).
|
|
2.1.1.6./1 |
4. Размерность энергии Гиббса
Эталон ответа: г).
|
|
2.1.2.1./1 |
5. 1-й закон термодинамики
Эталон ответа: б).
|
|
2.1.1.4./2 |
6. Функцию «энтальпия» определяет выражение
Эталон ответа: г).
|
|
2.1.3.3./1 |
7. Эндотермическим процессам отвечает неравенство:
Эталон ответа: г).
|
|
2.1.1.1./1 |
8. Изолированные системы
Эталон ответа: а).
|
|
2.1.1.1./2 |
9. Открытые системы
Эталон ответа: в).
|
|
2.1.1.1./3 |
10. Система - это группа тел, …
Эталон ответа: в).
|
|
2.1.1.2./2 |
11. Функция состояния системы зависит от …
Эталон ответа: а).
|
|
2.1.3.3./2 |
12. Реакции, протекающие с поглощением теплоты, называются…
Эталон ответа: б).
|
|
|
2-й уровень |
|
2.1.3.5./1 |
1. Энтальпией образования вещества называется тепловой эффект …
Эталон ответа: в).
|
|
2.1.3.6./1 |
2. Энтальпией сгорания вещества называется тепловой эффект реакции …
Эталон ответа: б).
|
|
2.1.2.2./1 |
3. Изохорный процесс протекает при …
Эталон ответа: в).
|
|
2.1.2.3./1 |
4. Изобарный процесс протекает при …
Эталон ответа: а).
|
|
2.1.3.1./1 2.1.3.8./1 |
5. Тепловой эффект реакции зависит от …
Эталон ответа: б).
|
|
2.1.2.2./2 |
6. Теплота, подводимая к системе, расходуется на изменение внутренней энергии в …
Эталон ответа: а).
|
|
2.1.1.5./1 |
7. Самопроизвольное протекание процесса в изолированной системе сопровождается
Эталон ответа: а).
|
|
2.1.1.6./2 |
8. Самопроизвольное протекание процесса в неизолированной системе сопровождается
Эталон ответа: в).
|
|
2.1.1.6./3 |
9. Условием равновесия является
Эталон ответа: г).
|
|
|
3-й уровень |
|
2.1.3.5./2 |
1. Теплотой образования CO2 является тепловой эффект реакции
Эталон ответа: в).
|
|
2.1.3.2./1 |
2. Экзотермической является реакция
Эталон ответа: в).
|
|
2.1.3.8./2 |
3. Первое следствие из закона Гесса: тепловой эффект химической реакции равен
Эталон ответа: б).
|
|
2.1.3.8./3 |
4. Второе следствие из закона Гесса: тепловой эффект химической реакции равен
Эталон ответа: а).
|
|
2.1.3.9./1 2.1.3.8./4 |
5. Изменение энтальпии реакции сгорания метана CH4 + 2O2 CO2 + 2H2O рассчитывается по формуле Эталон ответа: б).
|
|
2.1.3.9./2 2.1.3.8./5 |
6. Изменение энтальпии при сгорании ацетилена 2C2H2 + 5O2 4CO2 + 2H2O; H - ? Эталон ответа: б).
|
|
2.1.1.5./2 |
7. Энтропия при протекании реакции 4NH3(Г) + 3O2(Г) 2N2 (Г) + 6H2O(Ж)
Эталон ответа: б).
|
|
2.1.1.5./3 |
8. Энтропия при протекании реакции 2SO2(Г) + O2(Г) 2SO3(Г)
Эталон ответа: б).
|
|
|
4 -5 уровень |
|
2.1.3.10./1 2.1.3.8./6 |
1. Изменение энтальпии реакции: C2H5OH(Ж) + CH3COOH(Ж) CH3COOC2H5(Ж) + H2O(Ж) [
Эталон ответа: б).
|
|
2.1.3.5./3 2.1.3.10./2 |
2. Энтальпия образования HBr 2HBr(Г) H2(Г) + Br2(Г); H = 72,6 кДж.
Эталон ответа: в).
|
|
2.1.3.5./4 2.1.3.10./3 |
3. Определите энтальпию образования HCl, если при протекании реакции H2(Г) + Cl2(Г) 2HCl(Г) выделяется 92,31 кДж.
Эталон ответа: г).
|
|
2.1.3.5./5 2.1.3.10./4 |
4. Изменение энтальпии реакции C6H6(Ж) + 7,5O2(Г) 6CO2(Г) + 3H2O(Г) равно: [
Эталон ответа: в).
|
Тест по теме 2.2.: Направленность химических процессов
|
Код |
1 й уровень |
||||||||
|
2.2.2.3/1 |
1. Для самопроизвольных процессов в неизолированных системах:
Эталон ответа: ж).
|
||||||||
|
2.2.2.3/2 |
2. Для несамопроизвольных процессов в неизолированных системах:
Эталон ответа: з).
|
||||||||
|
2.2.2.1./1 |
3. Изменение энергии Гиббса при протекании химической реакции:
Эталон ответа: г).
|
||||||||
|
2.2.1.3./1 |
4. Формула для расчета изменения энтропии:
Эталон ответа: б).
|
||||||||
|
2.2.1.1./1 |
5. Самопроизвольные процессы для своего осуществления
Эталон ответа: б); в); д).
|
||||||||
|
|
2-й уровень |
||||||||
|
2.2.1.4./1 |
1. Самопроизвольные процессы в изолированной системе сопровождаются…
Эталон ответа: б).
|
||||||||
|
2.2.2.2./1 |
2. Самопроизвольные процессы в неизолированной системе сопровождаются
Эталон ответа: а).
|
||||||||
|
2.2.2.1/2 |
3. Энергия Гиббса является функцией состояния и ее изменение равно
Эталон ответа: в).
|
||||||||
|
2.2.1.3/2 |
4. Энтропия является функцией состояния и ее изменение равно
Эталон ответа: в).
|
||||||||
|
|
3-й уровень |
||||||||
|
2.2.1.3./3 |
1. Энтропия при протекании реакции N2(Г) + O2(Г) 2NO(Г).
Эталон ответа: б).
|
||||||||
|
2.2.1.3/4 |
2. Соответствие между цифрами и словами
S Т
Эталон ответа: 1 - а); 2 - в); 3 - б).
|
||||||||
|
2.2.1.3/5 |
3. Изменение энтропии при протекании реакции 2C4H10(Г) + 13O2(Г) 8CO2(Г) + 10H2O(Г)
Эталон ответа: а).
|
||||||||
|
2.2.2.3./3 |
4. Самопроизвольно в обратном направлении протекают реакции:
Эталон ответа: а); б).
|
||||||||
|
2.2.2.3./4 |
5. Самопроизвольно в системе Fe2O3(Т) + 3H2(Г) 2Fe(Т) + 3H2O (Г), G = 55,28 кДж. будет протекать
Эталон ответа: б).
|
||||||||
|
2.2.2.3/5 |
6. Реакция протекает самопроизвольно, если изменение свободной энергии Гиббса равно
|
||||||||
|
2.2.1.3/6 |
7. Энтропия при протекании реакции 2C(Т) + 3H2(Г) C2H6(Г)
Эталон ответа: г).
|
||||||||
|
2.2.1.3/7 |
8. Энтропия при протекании реакции 3Fe(Т) + 2CO(Г) Fe3C(Т) + CO2(Г)
Эталон ответа: а).
|
||||||||
|
|
4-й уровень |
||||||||
|
2.2.1.3/8 |
1. Изменение энтропии реакции: 2C4H10(Г) + 13O2(Г) 8CO2(Г) + 10H2O(Г) , если SC4H10 = a, SO2 = b, SCO2 = c, SH2O = d,
Эталон ответа: в).
|
||||||||
|
|
|
||||||||
|
|
|
Тест по теме 2.3.: Химическая кинетика
|
|
1-й уровень |
|||||||||||||||||||||||||
|
2.3.1.2./1 |
1. Средняя скорость гомогенной реакции выражается формулой: Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.7./1 |
2. Математическая зависимость скорости реакции от температуры описывается:
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.2.7./2 |
3. Математическая зависимость скорости реакции от температуры описывается уравнением: Эталон ответа: г).
|
|||||||||||||||||||||||||
|
2.3.2.7./3 |
4. Температурный коэффициент скорости химической реакции принимает значения:
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.1.3./2 2.3.2.11./1 |
5. Измельчение твердого вещества скорость химической реакции
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.9./1 2.3.2.11./2 |
6. Катализатор скорость химической реакции:
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.4./1
|
7. Скорость химической реакции при увеличении концентрации реагирующих веществ:
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.11./3 |
8. Cкорость химической реакции зависит от
Эталон ответа: а); в).
|
|||||||||||||||||||||||||
|
|
2-й уровень |
|||||||||||||||||||||||||
|
2.3.1.2./2 |
1. В уравнении VСР = С/t выбирают знак минус, если скорость реакции вычисляют…
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.6./1 |
2. Порядок реакции - это сумма показателей степеней
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.2.4./2 |
3. Константа скорости химической реакции равна скорости химической реакции …
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.2./1
|
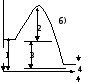
4. Энергия активации на энергетической диаграмме реакции обозначена цифрой
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.4./3 |
5. Тепловой эффект на энергетической диаграмме реакции обозначен цифрой
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.2.9./2 |
6. Катализатор изменяет скорость реакции, потому что…
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.4./4 |
7. Скорость обратной химической реакции CaCO3(Т) CaO(Т) + CO2(Г): Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.7./4 |
8. Температурный коэффициент показывает:
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.1./1 |
9. Активные молекулы обладают
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.5./1 |
10.
Константа скорости реакции
Эталон ответа: а); б).
|
|||||||||||||||||||||||||
|
|
3-й уровень |
|||||||||||||||||||||||||
|
2.3.2.11./4 |
1. Константа скорости реакции PCl3(Г) + Cl2(Г) PCl5(Г) изменится при
Эталон ответа: г).
|
|||||||||||||||||||||||||
|
2.3.2.4./5 2.3.2.7./5 2.3.2.8./1 |
2. Соответствие:
Эталон ответа: а - 2); б - 4); в - 1).
|
|||||||||||||||||||||||||
|
2.3.2.8./2 |
3. Предэкспоненциальный множитель в уравнении Аррениуса
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.4./6 |
4. Закон действующих масс строго соблюдается для
Эталон ответа: г).
|
|||||||||||||||||||||||||
|
2.3.2.4./7 |
5.
Выражение для скорости
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
|
4-й уровень |
|||||||||||||||||||||||||
|
2.3.2.4./8 |
1. Скорость прямой реакции CO2(Г) + СТВ 2CO(Г) …….. ,если увеличить давление в 2 раза.
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.2.4./9 |
2. Скорость обратной реакции CO2(Г) + СТВ 2CO(Г) ….., если увеличить давление в 2 раза.
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.7./6 |
3. Температуру надо ……., для того чтобы скорость реакции CO2(Г) + СТВ 2CO(Г) увеличилась в 32 раза (температурный коэффициент 2).
Эталон ответа: г).
|
|||||||||||||||||||||||||
|
2.3.2.4./10 |
4. Скорость реакции N2 + 3H2 2NH3. ……, если концентрацию азота увеличить в 4 раза и концентрацию водорода - в 2 раза:
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.4./11 |
5. Скорость реакции 4HCl(Г) + O2(Г) 2Cl2(Г) + 2H2O(Г) ….. при увеличении давления в 3 раза:
Эталон ответа: в).
|


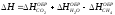

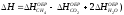

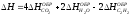
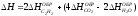
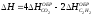
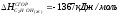 ;
;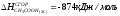 ;
; ;
]
;
]
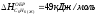 ;
;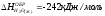 ;
;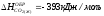 ]
]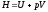
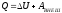
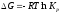
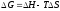
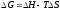 .
.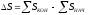 .
. .
.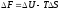 .
.
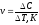
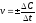
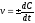
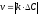
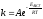
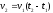
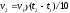
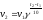

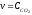

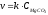

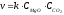
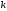 зависит от
зависит от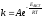
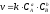
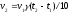
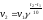
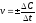
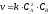 соответствует реакции
соответствует реакции