
Лекция 7.
Кинетика химических реакций. Химическое равновесие.
План.
-
Введение. Основные термины.
-
Понятие о скорости гомогенных и гетерогенных реакций.
-
Зависимость скорости реакции от концентрации реагирующих веществ.
-
Зависимость скорости реакции от температуры.
-
Катализ.
-
Химическое равновесие.
Разнообразные химические реакции могут протекать с различными скоростями. Некоторые из них полностью протекают за секунды. Например, нейтрализация кислоты основанием происходит сразу же после того, как мы смешаем их в одном сосуде. Другие реакции могут осуществляться в течение минут, часов, дней и месяцев. Например, взаимодействие оксида магния с водой:
MgO + H2O = Mg(OH)2 (тв.) при 25оС - 5 6 месяцев (медленно)
крист. осадок при 50оС - 1 2 недели (относительно быстро).
Характеристика же любого химического процесса определяется 2 факторами:
-
возможность или невозможность протекания процесса (эти вопросы разрешает термодинамика);
-
быстрота протекания – этим занимается химическая кинетика.
Термин кинетика произошел от греческого слова «kinẽtikos”, что означает “движущийся”. Движение происходит во времени. Таким образом, кинетика изучает реакцию как процесс, протекающий во времени, изучает механизм этого процесса и его закономерности. Химическая кинетика – раздел физической химии, посвященный изучению закономерностей протекания реакций.
Каковы же причины для изучения скорости реакции? Для чего это нужно?
-
Во-первых, от знания того, как быстро реакционная смесь достигает равновесного состояния, зависит эффективность производственного процесса (затраты на осуществление процесса могут быть минимизированы);
-
В химической промышленности при производстве того или иного вещества от скорости зависят размеры и производительность аппаратуры, количество вырабатываемого продукта;
-
Зная и оценивая факторы, влияющие на скорость (температура, давление, наличие катализатора), можно проводить процесс с оптимальной скоростью, т.е. предотвращать аварийные ситуации, взрывы; эффективно регулировать процесс;
-
Изучение скорости помогает изучению механизма реакции. “Механизм реакции” – это совокупность элементарных актов, составляющих процесс превращения исходных реагентов в продукты реакции.
В зависимости от того, принимает ли непосредственное участие в элементарном акте одна, две или три исходные частицы, элементарные реакции классифицируются как мономолекулярные, бимолекулярные и тримолекулярные. Большинство элементарных реакций имеет молекулярность 1 или 2; некоторые реакции происходят путем одновременного столкновения трех частиц.
К мономолекулярным реакциям относятся реакции изомеризации либо разложения:
CH3 – N =C → CH3 – C ≡ N
Br2 → 2Br.
Бимолекулярные реакции:
2 NOCl (газ) → 2NO (газ) + Cl2 ,
Br• + H2 → HBr + H•.
Тримолекулярные реакции встречаются очень редко. Вот два таких случая:
2NO + O2 → 2NO2
2I• + H2 → 2HI,
где I• - свободный радикал йода – активная частица, имеющая неспаренный электрон.
Понятие «скорость» в химии имеет такое же значение, как и в физике, - это изменение какой-либо величины за единицу времени. Что происходит при химическом взаимодействии? Реагенты вступают во взаимодействие друг с другом, в результате чего образуются новые вещества – продукты реакции. По мере протекания реакции содержание (или концентрация) реагентов все время уменьшается, а концентрация продуктов увеличивается. Поэтому вполне логично определить скорость химической реакции как скорость химического превращения исходных веществ в продукты реакции. Например, для реакции вида
аА + bB → cC + dD,
где а, b, c, d – стехиометрические коэффициенты реагентов и продуктов соответственно. В замкнутом постоянном объеме реагенты А и В будут исчезать со скоростью
υ = - Δ СA / Δ t,
υ = - Δ СВ/ Δ t,
где Δ – изменение, приращение, t – время, СA и СВ – молярная концентрация реагентов А и В, моль/л, знак минус в этих уравнениях означает уменьшение концентрации,
а продукты С и D будут накапливаться со скоростью
υ = Δ СС / Δ t,
υ = Δ СD / Δ t.
Так как скорость исчезновения реагентов равна скорости появления продуктов, то скорость реакции можно выразить по любому реагенту или продукту:
υр = - Δ СА /Δ t = - Δ СВ /Δ t = Δ СС/ Δ t = Δ СD / Δ t.
Поэтому и определить скорость реакции в эксперименте также можно по убыванию любого из реагентов, или по увеличению любого из продуктов реакции. Приведенное выше выражение справедливо только для закрытых систем, где реакция происходит без изменения объема!
При рассмотрении вопроса о скорости реакции необходимо различать реакции гомогенные и гетерогенные.
Гомогенные реакции – реакции, в которых все реагенты находятся в одном агрегатном состоянии. Примеры:
разложение 2N2O5 (г) → 4NO2 (г) + O2 (г)
горение этана 2C2H6 (г) + 7O2 (г) → 4CO2 (г) + 6H2O (г)
В каждом примере реагенты находятся только в одном агрегатном состоянии – газообразном.
Гетерогенные реакции – реакции, в которых реагирующие вещества находятся в различных агрегатных состояниях. Примеры:
-
СаО(тв) + СО2(г) → СаСО3 (тв)
СО2 (г) + КОН (р-р) → КНСО3 (р-р)
СаСО3 (тв) + НСl (р-р) → CaCl2 (р-р) + CO2 + H2O (ж)
В этих примерах реагирующие вещества находятся в трех различных агрегатных состояниях: твердом, жидком и газообразном.
Если реакция протекает в гомогенной системе и реагенты хорошо перемешиваются, то взаимодействие идет во всем объеме этой системы. Например, при сливании растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора.
H2SO4 + Na2S2O3 = Na2SO4 + H2O + SO2↑ + S↓
Поэтому скорость гомогенной реакции можно выразить через изменение концентрации одного из веществ системы.
Если реакция протекает между веществами, образующими гетерогенную систему, то она уже происходит не во всем объеме системы. Например, растворение мела в кислоте
CaCO3 + 2HCl = СаCl2 + H2О + СО2↑
В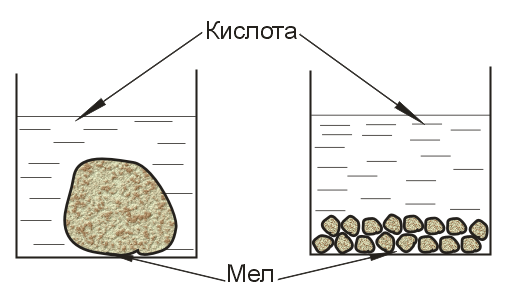 заимодействие
карбоната кальция с кислотой может
протекать только на поверхности частиц
карбоната кальция, потому что только
здесь соприкасаются друг с другом оба
реагента.
заимодействие
карбоната кальция с кислотой может
протекать только на поверхности частиц
карбоната кальция, потому что только
здесь соприкасаются друг с другом оба
реагента.
Рис.
2. Схема, показывающая различие в
поверхности кускового и
порошкового
материалов.
Реагенты, вступающие во взаимодействие, занимают не весь объем системы: и карбонат кальция и кислота занимают только некоторую часть объема системы. Поэтому скорость гетерогенных реакций не выражают через объемную концентрацию. Скорость гетерогенной реакции определяется площадью поверхности фазы, на которой происходит взаимодействие
υгетерог = Δn / SΔt,
где S – площадь поверхности фазы; Δn – количество вещества, вступающего в реакцию на данной поверхности; Δt – промежуток времени, в течение которого происходит взаимодействие.
И чем больше площадь реакционной поверхности, тем быстрее протекает реакция. (Это необходимо пояснить: если просто анализировать математическую формулу υгетерог= Δn/SΔt, то с увеличением в знаменателе S, величина υгетерог должна уменьшаться. Однако, необходимо помнить, что одновременно с увеличением поверхности увеличивается и количества вещества, вступающего в реакцию Δn, что приводит к уменьшению времени взаимодействия. Поэтому в целом величина υгетерог будет увеличиваться.)
Реакцию в гетерогенной системе, например, между твердым веществом и жидким, можно провести по-разному: твердое вещество можно использовать в виде одного монолитного куска или в виде порошка. На следующем слайде представлена схема, иллюстрирующая различие между кусковым и порошковым материалами:
Если в реакции используется один кусок, например, карбоната кальция – это одна поверхность, если этот кусок раздробить на более мелкие, то это уже будет другая, бόльшая поверхность.
Понятие о кинетической кривой
Скорость химической реакции определяют экспериментально. По полученным результатам эксперимента строят график изменения концентрации реагирующего вещества (или образующегося продукта) во времени, за которое протекает реакция:
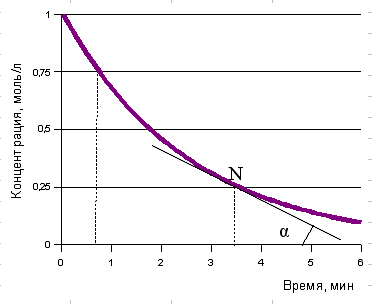
Как видно на кинетической кривой в различные моменты времени скорость реакции имеет различные значения. Истинная же скорость реакции (ее называют мгновенной скоростью) в данный момент времени определяется наклоном касательной, проведенной к кинетической кривой в точке, соответствующей рассматриваемому моменту времени, или тангенсом угла наклона α:
tg α = 0,25/3,5 = 0,25/210 = 0,0012 моль/л ٠с.
Средняя скорость за период 3,5 минуты равна
υср = (1 – 0,25) / 3,5 = 0,75 / 210 = 0,0036 моль/л ٠с.
Экспериментальные исследования показывают, что на скорость реакции оказывают влияние лишь несколько факторов:
-
концентрация реагентов,
-
температура,
-
физическое состояние реагентов,
-
наличие катализаторов.
М. Гульдберг (1836 – 1902) п. Ваге (1833 – 1900)
Рассмотрим зависимость скорости реакции от концентраций реагирующих веществ.
В 1864 – 1867 годах норвежские ученые: Като Максимилиан Гульдберг и Петер Ваге для расчета скорости химической реакции предложили закон действующих масс, который был установлен экспериментальным путем для многих реакций. Для реакции вида
аА + bB = cC
закон выражается формулой
υ = k • СAa • СBb,
где k – коэффициент пропорциональности, называемый константой скорости реакции, а СA и СB – молярные концентрации реагентов.
Степень, в которой концентрация входит в уравнение скорости, называется порядком реакции по данному веществу, а общий порядок – это сумма показателей степеней всех концентраций. Для выше приведенной реакции порядки могут быть следующие: если скорость не зависит от концентрации реагирующих веществ «А» и «В», то – нулевой; если зависит только от «А» или только от «В», то – первый и если зависит от «А» и «В», то – второй.
Важное замечание! Концентрация конденсированной фазы не включается в выражение ЗДМ, т.к. она является постоянной величиной. Пример, для реакции
СаО (тв) + СО2 (г) = СаСО3
выражение ЗДМ должно быть записано в виде υ = k • С СО2 .
для реакции H2O (ж) + NH3 (г) = NH4OH
ЗДМ имеет вид υ = k • С NH3 .
Порядок реакции указывает на сложность ее механизма. При этом его величина, предсказываемая ЗДМ часто не совпадает с действительной величиной. Например, для реакции
2N2O5 → 2N2O4 + O2
по ЗДМ порядок должен быть равен 2. Однако экспериментальные данные о скорости данной реакции дают порядок, равный 1. Поэтому порядок реакции всегда определяют только экспериментально.
Еще пример:
Реакция гидролиза сахарозы (сахар)
С12Н22О11 + Н2О + Н3О+→ 2С6Н12О6
Катализируется в присутствии кислот, должна иметь согласно ЗДМ 3 порядок
υ = k • С (С12Н22О11 ) • С(Н2О) • С(Н3О+).
Но из-за избытка количества воды по сравнению с другими реагентами и постоянства концентрации ионов гидроксония Н3О+ (потому что катализатор не расходуется в реакции), фактически со временем изменяется только концентрация сахара и поэтому реальный порядок реакции равен 1
υ = k • С (С12Н22О11 ).
ЗДМ был предложен в 19 в. на основании опытных данных. Уже в 20 в. закон был объяснен на основании так называемой «теории столкновений», которая позволила разобраться в механизме протекания реакций.
Чтобы молекулы двух веществ прореагировали, они должны войти в контакт между собой, т.е. столкнуться. Рассмотрением столкновений молекул как раз и занимается теория столкновений. В соответствии с этой теорией скорость реакции определяется 2 факторами:
-
числом столкновений между молекулами веществ (атомами или ионами) в единицу времени;
-
долей столкновений, которые приводят к химическому превращению (такие столкновения называются эффективными).
Роль 1 фактора очевидна: чем больше концентрация реагентов (а концентрация реагентов – это количество частиц в единице объема), тем больше вероятность столкновения между ними. Но на самом деле не все столкновения между молекулами приводят к образованию продуктов. Доля эффективных столкновений определяется природой реагирующих веществ и их температурой. И все же первейшим условием осуществления реакции является столкновение между молекулами.
Рассмотрим гипотетическую реакцию А + В = С. И будем исходить из предположения, что вещества реагируют друг с другом самым простым образом – в результате прямого взаимодействия при столкновении молекулы А с молекулой В. Предположим, что в единице объема содержится 6 молекул А и 3 молекулы В. На следующей схеме приведены различные возможные столкновения между этими молекулами, могущие привести к химическому взаимодействию. Нетрудно подсчитать, что столкновения могут осуществиться в результате 18 различных комбинаций, а это число равно произведению числа молекул А на число молекул В, что как раз и равно произведению молярных концентраций реагирующих веществ.
С помощью теории столкновений рассмотрение простейшей реакции между гипотетическими А и В можно распространить и на реальные системы, в которых
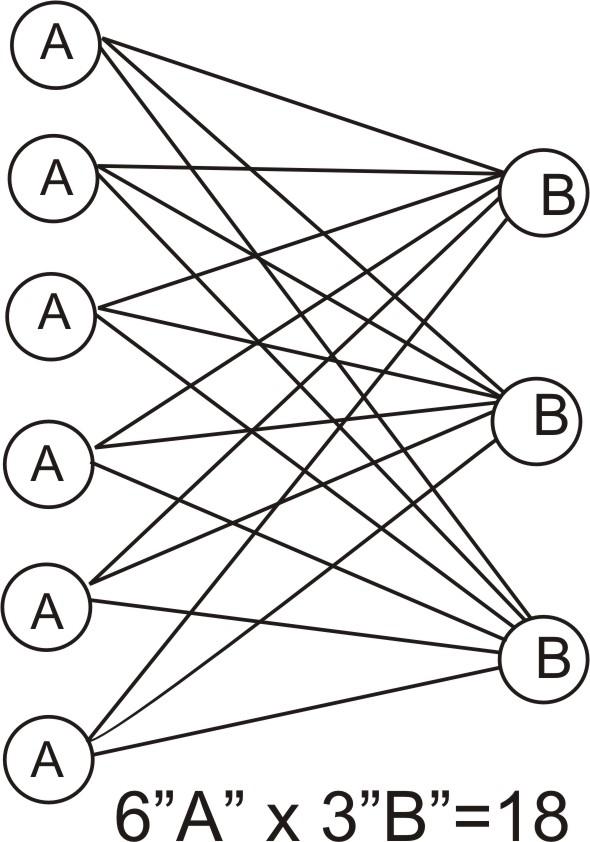 одновременно
принимает участие большое число
одновременно
принимает участие большое число
частиц. Но вместо данных об истинном числе молекул в
единице объема используют молярную концентрацию
или парциальные давления газов для газовых реакций.
Таким образом, произведение концентраций
реагентов в уравнении ЗДМ есть общее количество
возможных столкновений реагирующих частиц. Но как
уже было сказано, не все столкновения между
реагирующими частицами могут привести к
химическому взаимодействию. Только какая-то доля
столкновений от общего числа может привести к
образованию продуктов. И эта доля как раз и
характеризуется константой скорости реакции.
