
Шпаргалка - 2001 / CHEMSP01
.DOCСпектр водорода.
![]()
Серия Бальмера
(1885):
![]()
R=109678 см-1 - постоянная Ридберга;n=3,4,5....
Серия Лаймана - УФ область
Серии Пашена, Бреккета и Пфунда - ИК область
![]() ;
n2>n1
;
n2>n1
Спектры других элементов.
Ридберг - 1889:
![]()
- разность двух функций целых чисел n1 и n2. Численные значения этих функций называются спектральными термами.
для одноэлектронных частиц:
![]()
Для других элементов:
![]()
Данное уравнение наиболее точно описывает спектры щелочных металлов; для других элементов незначительно расходится с опытом;
a<1 - число, которое постоянно для линий данной серии. Для различных серий поправки a обозначаются буквами, совпадающих с первыми буквами английских названий серий: sharp-резкая, principal-главная, diffuse-диффузная, fundamental-основная.
В последних двух формулах для серий, отвечающих нейтральным атомам Z=1, для однозарядных ионов Z=2...
Квантование энергии электронов в атомах.
Планк (1900г.) - теория квантования.
![]()
Переход из одного энергетического состояния в другое:
![]() или
или
![]()
![]()
За состояние с нулевой энергией принимают такое, когда электрон с кинетической энергией, равной нулю, удален от атома на бесконечно большое расстояние.
Для атома водорода:
![]()
История развития представлений о строении атома.
Резерфорд установил наличие у атомов ядра- планетарная модель. Но из электродинамики известно, что вращающийся вокруг некоторого центра заряд является источником электромагнитных колебаний, поэтому электрон, излучая, должен был бы непрерывно терять энергию и в итоге упасть на ядро.
1913г. Бор - электрон в атоме может двигаться без излучения энергии по стационарным орбитам. Для этих орбит должно выполняться соотношение
![]()
mevr-момент импульса электрона; r- радиус орбиты; n=1,2,3...; h- постоянная Планка.
![]()
Приравнивая центростремительную силу, действующую на электрон, силе притяжения его к ядру, можно записать:
![]()
![]() ,
e0-
абсолютная диэлектрическая проницаемость
вакуума; в СГСЕ системе единиц k=1.
,
e0-
абсолютная диэлектрическая проницаемость
вакуума; в СГСЕ системе единиц k=1.
![]()
Решение системы двух последних уравнений дает выражения v и r для стационарных орбит:
![]()
![]()
![]() - радиус
первой боровской орбиты.
- радиус
первой боровской орбиты.
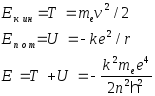
Теоретическое
выражение для постоянной Ридберга:
![]() -
дает значение, близкое к опытному. Полное
совпадение получается, если учесть, что
электрон и ядро вращаются вокруг общего
центра масс, лежащего близко к ядру.
Тогда в выражение для R вводится
приведенная масса электрона:
-
дает значение, близкое к опытному. Полное
совпадение получается, если учесть, что
электрон и ядро вращаются вокруг общего
центра масс, лежащего близко к ядру.
Тогда в выражение для R вводится
приведенная масса электрона:
![]() М- масса ядра
М- масса ядра
Закон Эйнштейна для фотоэффекта.
![]()
Уравнение волны де Бройля.
![]()
Уравнение Шредингера.
![]() U-потенциальная
энергия; E-полная энергия.
U-потенциальная
энергия; E-полная энергия.
Соотношение неопределенностей Гейзенберга.
![]() или
или
![]()
Dx- неопределенность положения частицы (значения ее координаты x в рассматриваемый момент времени), Dpx и Dvx - неопределенности составляющих импульса и скорости в направлении координаты x.
Волновые функции, орбитали.
![]() U- пот. энергия
r-расст. от ядра.
U- пот. энергия
r-расст. от ядра.
![]()
q-угол широты (между r и oz), j-угол долготы(между ox и проекцией r на пл-сть xOy).
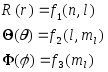
Среднее расстояние электрона от ядра в водородоподобных ионах:
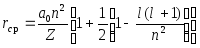
Z-заряд ядра; a0 - радиус первой боровской орбиты.
Энергия электрона в атоме водорода (решение уравнения Шредингера):
![]()
Орбитальный момент импульса электрона:
![]() ;
;
![]()
Может быть найдена лишь одна проекция вектора M - нахождение других проекций не допускается соотношением неопределенностей.
Энергия электрона в водородоподобных ионах:
![]()
Периодический закон.
Правило Пти и Дюлонга.
С=сA»26Дж/(моль×К),
c-удельная теплоемкость [Дж/(г×К)],
A-атомная масса,
С-атомная теплоемкость.
Линии в рентгеновском спектре:
![]() -формула Мозели.
-формула Мозели.
~n-волновое число определенной линии одной и той же серии рентгеновского спектра;
Z-порядковый номер элемента;
A-const, b-const.
Термы:
Введем b- постоянную экранирования:
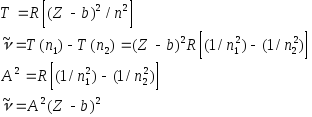
Дипольный момент молекул.
![]() ,
l - расстояние
между центрами положительных и
отрицательных зарядов;
,
l - расстояние
между центрами положительных и
отрицательных зарядов;
q-абсолютное значение этих зарядов.
Дипольные моменты обычно определяют экспериментально, измеряя диэлектрическую проницаемость e веществ при различных температурах. Если вещество поместить в электрическое поле, создаваемое конденсатором, то емкость последнего возрастает в e раз, т.е. e=с/с0 (где с0 и с - емкость конденсатора в вакууме и в среде вещества). Энергия электрического поля в конденсаторе U выражается соотношением:
![]() ,V-напряжение
на обкладках конденсатора
,V-напряжение
на обкладках конденсатора
Т.о. конденсатор в среде вещества имеет больший запас энергии, чем в вакууме. Это обусловлено тем, что под действием поля происходит ориентация диполей и деформация молекул вещества. Первый эффект зависит от температуры, второй - не зависит. Из температурной зависимости e находят m с помощью уравнения Ланжевена-Дебая:
![]()
r-плотность;
![]() - постоянная Больцмана;
- постоянная Больцмана;
a-деформационная поляризуемость.
Дипольный момент - это вектор; во всех случаях принято, что он направлен от + к -.
Энергия ионной связи.
Для процесса образования ионной молекулы из атомов одновалентных элементов: A+B=A+B- :
![]()
EAB - энергия образования газообразной молекулы AB из свободных газообразных атомов (энергия образования связи); r0 - межионное расстояние; n- величина, характеризующая отталкивание ионов, для большинства случаев можно принять n»9.
Поляризация ионов.
Электростатическое воздействие на частицу вызывает смещение в ней электрических зарядов, называемое поляризацией. Поляризация проявляется в возникновении у частиц индуцированного дипольного момента mинд вследствие смещения электронов и ядер. В первом приближении индуцированный дипольный момент можно считать пропорциональным напряженности электрического поля E:
![]() a-поляризуемость
частицы
a-поляризуемость
частицы![]()
Для ионов поляризуемость приблизительно пропорциональна кубу их радиуса.
Процесс поляризации является двусторонним, в нем сочетаются поляризуемость ионов с их поляризующим действием.
Межмолекулярное взаимодействие.
Уравнение Ван-дер-Ваальса:
![]()
Pвн - внутреннее давление - поправочный член, учитывающий взаимное притяжение молекул - в уравнении Ван-дер-Ваальса он прямо пропорционален квадрату плотности; v - мольный объем; b - поправочный член, учитывающий собственный объем молекул и взаимное отталкивание между ними при малых расстояниях.
На сравнительно больших расстояниях r между молекулами, когда их электронные оболочки не перекрываются, проявляется только действие сил притяжения.
Электростатическое взаимодействие полярных молекул друг с другом называется ориентационным. Простейшее соотношение для энергии ориентационного взаимодействия (В. Кеезом, 1912):
![]()
Это соотношение выполняется вполне точно для условий высоких температур и небольших давлений, когда расстояние между диполями значительно больше длины диполя.
Индукционное взаимодействие - возникновение индуцированного дипольного момента.
Дебай, 1920:
![]() a-поляризуемость
a-поляризуемость
Дисперсионное взаимодействие: систему ядро-электрон можно рассматривать как диполь, отрицательный полюс которого быстро перемещается; в молекулах, находящихся на небольшом расстоянии друг от друга движение электронов становится в известной мере согласованным, так что в среднем диполи ядро-электрон оказываются чаще обращены друг к другу противоположно заряженными полюсами - это вызывает притяжение молекул. Теория дисперсионного взаимодействия была разработана Лондоном в 1930г.
![]()
n0
- частота колебаний, отвечающая нулевой
энергии E0,
т.е. энергии при T=0 (нулевая энергия
колеблющейся частицы выражается
соотношением
![]() ;
приближенно величину hn0
можно считать равной энергии ионизации).
;
приближенно величину hn0
можно считать равной энергии ионизации).
Складывая энергии
ориентационного, индукционного и
дисперсионного взаимодействий и
объединяя все постоянные, получаем
энергию межмолекулярного притяжения
![]()
где
![]()
При малых расстояниях
между молекулами, когда их электронные
оболочки сильно перекрываются, т.е.
когда электростатическое отталкивание
ядер и электронов становится больше их
взаимного притяжения, проявляется
действие сил отталкивания. В первом
приближении энергия отталкивания
молекул может быть выражена уравнением
![]() ,
,
m - положительная постоянная - константа отталкивания.
Суммарная энергия межмолекулярного взаимодействия описывается соотношением
![]() -
формула Леннарда - Джонса (1924 г.)
-
формула Леннарда - Джонса (1924 г.)
Энергия кристаллической решетки.
Капустинский,1943:
![]()
Z и r - заряды и радиусы ионов (индексы “к” и “а” относятся к катиону и аниону); a и r - константы, если U выражено в кДж/моль, а r в пм, то a=-1214, r=34,5; n - суммарное число ионов в химической формуле кристалла.
Уравнение Нернста.
Потенциал металлического электрода, опущенного в раствор соли того же металла с концентрацией c.
![]()
n- число эквивалентов вещества, участвующих в реакции или число участвующих в реакции электронов; F-число Фарадея F=96493Кл.
Для T=298,15K
![]()
Скорость реакций.
Аррениус (1889 г.)
Уравнение, выражающее зависимость константы скорости от температуры:
![]() a и b - постоянные
для данного процесса. Другой вид
уравнения: введем обозначения
a и b - постоянные
для данного процесса. Другой вид
уравнения: введем обозначения
![]() и
и
![]() ,
где E - энергия активации; после
потенциирования имеем
,
где E - энергия активации; после
потенциирования имеем
![]() A-предэкспоненциальный
множитель или фактор частоты.
A-предэкспоненциальный
множитель или фактор частоты.
Разбавленные растворы неэлектролитов.
Давление пара над растворами.
Понижение давления
над раствором будет тем значительнее,
чем больше введено вещества или чем
меньше мольная доля растворителя в
растворе, т.е. давление насыщенного пара
растворителя над раствором пропорционально
мольной доле растворителя:
![]()
Первый закон Рауля (1886 г.):
Давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному на мольную долю растворителя.
![]() .
Т.к.
.
Т.к.
![]() , то
, то
![]() или
или![]()
откуда
![]()
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе.
Температуры кипения и отвердевания растворов.
Повышение температуры кипения и понижение температуры отвердевания разбавленных растворов пропорционально их концентрации:
![]()
Второй закон Рауля:
Повышение температуры кипения и понижение температуры отвердевания растворов пропорциональны числу частиц растворенного вещества и не зависят от его природы.
Осмотическое давление.
Осмос - процесс самопроизвольного перехода растворителя в раствор через полупроницаемую перегородку. Осмотическое давление - давление, которое нужно приложить к раствору, чтобы осмос прекратился.
Осмотическое давление разбавленных растворов не зависит от природы компонентов и возрастает пропорционально концентрации растворенного вещества и абсолютной температуре:
![]() или
или
![]()
Принцип Вант-Гоффа (1887 г.):
Осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор.
Растворы электролитов.
c-Удельная электропроводность - электропроводность раствора объемом 1 см3, заключенного между электродами площадью 1 см2.
![]()
С разбавлением раствора c уменьшается, т.к. уменьшается концентрация электролита.
l-эквивалентная электропроводность - электропроводность раствора, содержащего один эквивалент растворенного вещества, объем которого заключен между двумя параллельно расположенными электродами, отстоящими друг от друга на расстоянии 1 см.
![]() VЭ
- разбавление
- объем, занимаемый раствором, содержащим
эквивалент растворенного вещества
VЭ
- разбавление
- объем, занимаемый раствором, содержащим
эквивалент растворенного вещества
l растет с уменьшением концентрации, стремясь к некоторому пределу.
Вант-Гофф (1887 г.) ввел поправочный множитель, названный изотоническим коэффициентом (растворы с одинаковым осмотическим давлением называются изотоническими). Подставляя i в уравнения для разбавленных растворов неэлектролитов, получаем уравнения, пригодные для описания разбавленных растворов всех веществ (причем для растворов электролитов i>1):
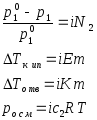
Эквивалентная электропроводность растворов электролитов пропорциональна степени электролитической диссоциации в растворах:
![]() .
При очень большом разбавлении электролиты
полностью распадаются на ионы, т.е. a=1.
Тогда
.
При очень большом разбавлении электролиты
полностью распадаются на ионы, т.е. a=1.
Тогда
![]() -
эквивалентная электропроводность при
бесконечном разбавлении.
-
эквивалентная электропроводность при
бесконечном разбавлении.
![]()
Рассмотрим раствор, содержащий 1 моль электролита, т.е. NA молекул. Если каждая из них распадается на m ионов, то при степени диссоциации a в растворе образуется NAma ионов. Число недиссоциированных молекул составит
NA-NAa=NA(1-a). Общее число частиц (молекул и ионов) после растворения будет равно NAma+ +NA(1-a). Отношение этого числа к числу растворенных молекул и даст изотонический коэффициент:
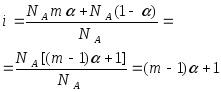
откуда
![]()
|
Спектрохимический ряд |
||||||||||||
|
CN |
NO2 |
En |
NH3 |
NCS |
H2O |
F |
COO |
OH |
Cl |
Br |
I |
|
|
сильного |
среднего поля лиганды |
слабого поля |
||||||||||
