
1 семестр / Оговорки к экзамену - 2007 - ЗОЙБЕРГ / FizXim_Ogovorki
.docВажные оговорки по физхимии
1
-
В вопросах, где газ одно- или многоатомный теплоёмкость берётся из термодинамики как CV=iR/2, где i=ч. Степеней свободы молекулы = (<кол-во атомов>*2) + 1
-
СP нельзя экстраполировать в ноль, а также нельзя рассчитывать по эмпирике вне температурного интервала, т.к. там другое более сложные зависимости.
-
При расчёте работы и теплоты замкнутого процесса, надо помнить, что изменения U и H (функций состояния!) равны 0!
-
При сравнении тепловых эффектов по дельта n R T не забывать, что учитываются только моли ГАЗОВ!!!!
-
Теплоёмкость с увеличением температуры всегда растёт!!!
2
-
Энтропия – это функция состояния термодинамической системы, изменение которой равно приведенной теплоте, взятой по обратимому процессу, соединяющему рассматриваемые состояния.
-
При фазовом переходе происходит резкий скачок энтропии.
-
При стремлении к нулю Кельвина Энтропия стремится к нулю только для идеально чистых кристаллов, т. е. W=1
-
К экстенсивным величинам, таким, как Энтропия, Энтальпия, Внетренняя Энергия, не забывать добавлять число молей!
-
Статистическое толкование 2-го закона термод.
В процах, изолированных системах, где растёт S, растёт и W – стрема стремится к наиболее вероятному состоянию.
-
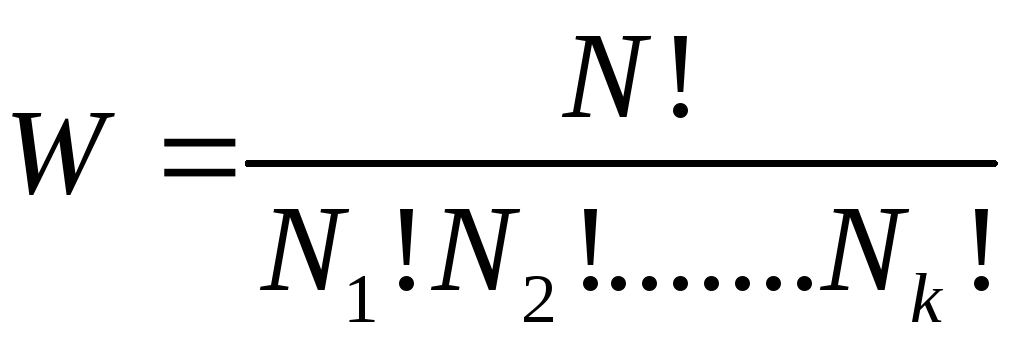 ,
где N
– число частиц во всех k
ячейках, Ni
– число частиц в итой ячейке. К – общее
число ячеек
,
где N
– число частиц во всех k
ячейках, Ni
– число частиц в итой ячейке. К – общее
число ячеек -
Для абсолютной энтропии: вместо интегрирования от нуля Кельвина, экспериментальный график экстраполируют до нуля и находят площадь. Так определяется S0298]
-
Энтропия Конденсированных фаз почти не зависит от давления!
3
-
Химическая переменная:
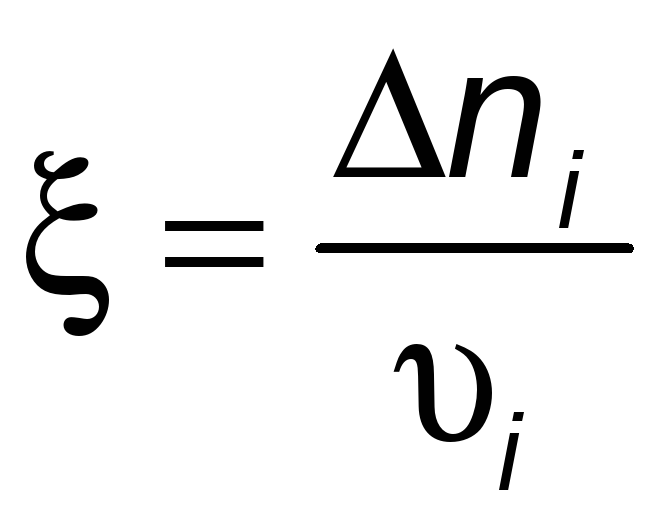 ,
где
,
где
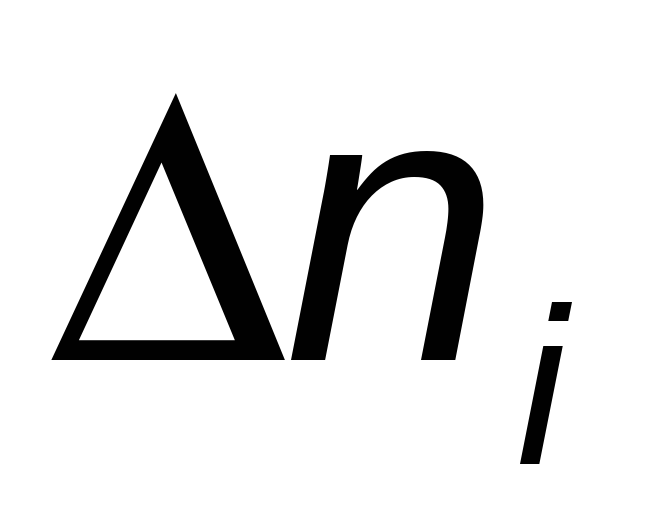 - изменение реальных молей,
- изменение реальных молей,
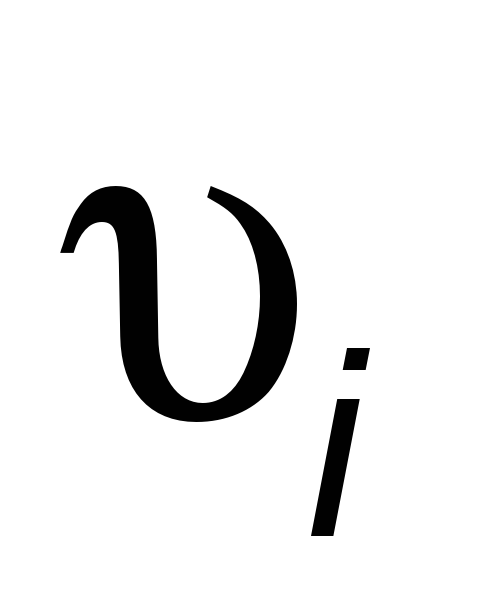 - число молей по стехиометрии.
- число молей по стехиометрии.
4
-
Для температурной зависимости энтальпии парообразования: по закону Кирхгофа. Дельта С меньше нуля для испарения, но не Сп не Св а просто С!!! Т.к., это не изохорный и не изобарный процесс.
