
1 семестр / Вопросы к письменному экзамену - 2005 / ТИПОВЫЕ_ЗАДАЧИ
.docТИПОВЫЕ ЗАДАЧИ
к экзамену по первой части курса физической химии в январе 2005 г.
Кафедра оставляет за собой право включать в экзаменационный билет задачи, являющиеся частью или комбинацией частей приведенных типовых задач.
-
Расчет теплоты, работы, изменения внутренней энергии и изменения энтальпии в обратимых изотермическом, изобарном или изохорном процессах с участием идеальных газов и в циклах, составленных из таких процессов.
-
Расчет приращения энтальпии вещества при постоянном давлении в интервале температур, в котором происходят фазовые превращения (расчет количества теплоты, необходимого для изобарного нагревания).
-
Расчет стандартных тепловых эффектов химических реакций при 298К с использованием следствий из закона Гесса.
-
Вычисление значений
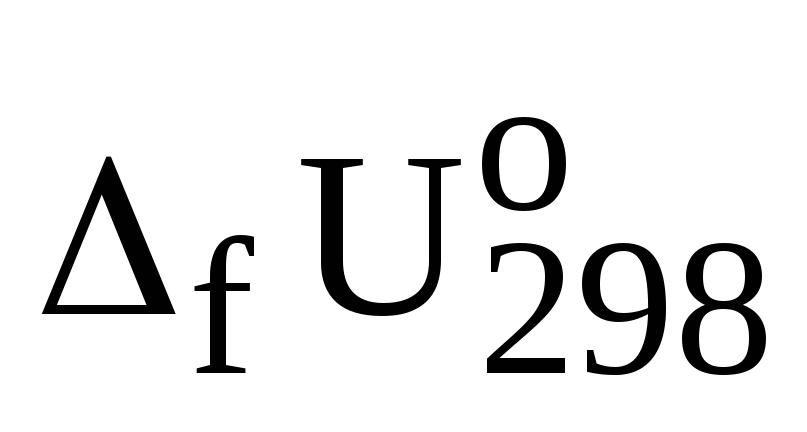 из данных о значениях
из данных о значениях
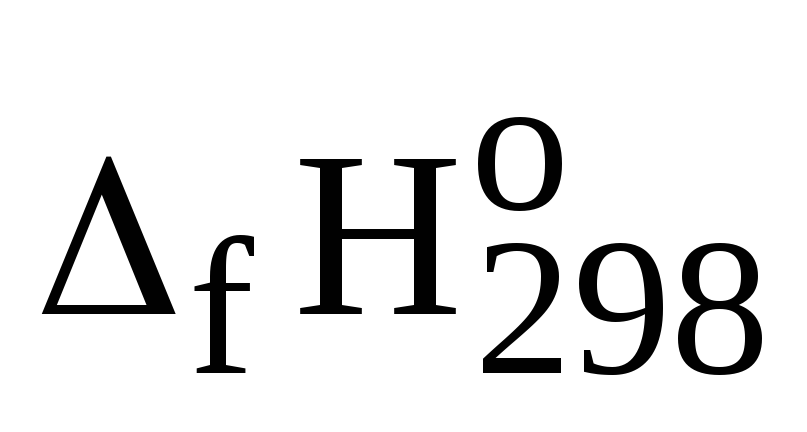 .
. -
Расчет стандартных тепловых эффектов химических реакций и фазовых превращений при заданной температуре с использованием уравнения Кирхгофа.
-
Составление (вывод) выражения температурной зависимости стандартного изменения энтальпии в химической реакции с использованием стандартных энтальпий образования и температурной зависимости теплоемкости реагентов и продуктов.
-
Вывод выражения для изменения теплоемкости в химической реакции по уравнению температурной зависимости стандартного изменения энтальпии.
-
Расчет изменения энтропии в обратимых изотермическом, изобарном или изохорном процессах с участием идеальных газов и в циклах, составленных из таких процессов.
-
Расчет изменения энтропии при смешивании двух идеальных газов.
-
Расчет абсолютного значения энтропии вещества в состоянии идеального газа при заданных температуре и давлении по известному значению стандартной энтропии при 298 К с учетом температурной зависимости теплоемкости.
-
Расчет стандартного изменения энтропии в химической реакции при заданной температуре. Оценка знака изменения энтропии в химической реакции по данным о фазовом состоянии участников реакции.
-
Определение направления самопроизвольного протекания химической реакции в изолированной системе, включающей большой тепловой резервуар.
-
Расчет изменения энергии Гиббса и изменения энергии Гельмгольца в обратимых изотермическом, изобарном или изохорном процессах с участием идеальных газов и в циклах, составленных из таких процессов.
-
Расчет изменения энергии Гиббса при смешивании двух идеальных газов.
-
Составление (вывод) выражений температурной зависимости стандартного изменения энергии Гиббса (вариант: термодинамической константы равновесия) в химической реакции с использованием стандартных термодинамических величин для веществ при 298К и температурной зависимости теплоемкости.
-
Расчет стандартного изменения энергии Гиббса (вариант: стандартного химического сродства) и стандартного изменения энергии Гельмгольца в химической реакции при заданной температуре.
-
Расчет значений констант равновесия KP и KC для реакций в идеальной газовой смеси по данным о равновесном составе смеси или о равновесной степени превращения при заданных условиях.
-
Расчет равновесной степени превращения и равновесных концентраций веществ для химической реакции в идеальной системе по заданному значению константы равновесия (для гомогенных реакций в идеальной газовой смеси и для гетерогенных реакций в системах, включающих идеальный газ и чистые вещества в конденсированной фазе).
-
Определение направления самопроизвольного протекания реакции при P=const, T=const с использованием уравнения изотермы Вант-Гоффа.
-
Расчет константы равновесия химической реакции при данной температуре по ее значению при другой температуре и среднему изменению энтальпии в данном интервале температур.
-
Расчет стандартных изменений энтальпии, энтропии, энергии Гиббса и теплоемкости для химической реакции по температурной зависимости термодинамической константы равновесия.
-
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции по справочным данным методом Темкина-Шварцмана.
-
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции по справочным данным о константах равновесия реакций образования веществ из простых веществ.
-
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции по справочным данным о стандартной приведенной энергии Гиббса веществ в состоянии идеального газа и о стандартной энтальпии образования.
-
Расчет равновесного давления газообразного продукта гетерогенной реакции, в которой участвуют практически чистые вещества в конденсированных фазах и образуется идеальный газ (расчет по справочным термодинамическим данным).
-
Расчет температуры кипения вещества при заданном внешнем давлении по температурной зависимости давления насыщенного пара. Вариант: Расчет температуры кипения вещества при заданном внешнем давлении по известным температуре кипения при другом давлении и средней энтальпии испарения в данном интервале температур.
-
Расчет среднего изменения энтальпии испарения или сублимации для индивидуального вещества по значениям давления насыщенного пара при двух температурах в приближении “пар=идеальный газ”. Вариант: Расчет давления насыщенного пара при заданной температуре по известным значению давления при другой температуре и средней энтальпии испарения в данном интервале температур.
-
Расчет координат тройной точки чистого вещества (равновесие «твердое-жидкость-пар» по данным о температурной зависимости давления насыщенного пара.
-
Оценка энтальпии плавления вещества в тройной точке по уравнениям температурной зависимости давления насыщенного пара для линий испарения и сублимации.
-
Приближенный расчет температуры плавления вещества при заданном давлении по уравнению Клапейрона-Клаузиуса.
-
Расчет числа степеней свободы системы в заданной фазовой области по уравнению правила фаз Гиббса.
-
Расчет парциальных мольных величин компонентов бинарного раствора по уравнению зависимости свойства раствора от количества (или от моляльности) одного из компонентов при фиксированных давлении, температуре и количестве второго компонента.
-
Расчет парциальных мольных величин компонентов бинарного раствора по уравнению зависимости мольного свойства раствора от мольной доли одного из компонентов при фиксированных давлении и температуре.
-
Расчет изменения объема при смешении заданных количеств компонентов при известных парциальных мольных объемах компонентов.
-
Расчет плотности раствора заданной концентрации при известных парциальных мольных объемах компонентов.
-
Расчет теплоты смешения заданных количеств двух компонентов или теплоты разбавления бинарного раствора по известным парциальным мольным энтальпиям растворения или по мольной энтальпии смешения.
-
Расчет активности компонентов раствора по равновесным парциальным давлениям пара и давлению насыщенного пара компонентов в приближении «пар = идеальный газ». Расчет рационального коэффициента активности компонентов раствора по активности и мольной доле.
-
Вывод выражений для активности компонента и относительного химического потенциала компонента раствора по известным уравнениям температурной зависимости равновесного парциального давления пара и давления насыщенного пара чистого компонента в приближении «пар = идеальный газ».
-
Расчет изменения объема, энтальпии, энтропии, энергии Гиббса при образовании бинарного идеального раствора.
-
Расчет изменения энергии Гиббса при смешении по известным активностям и концентрациям (вариант: количествам) компонентов при заданной температуре.
-
Вычисление относительного понижения давления пара растворителя (варианты: повышения температуры начала кипения, понижения температуры начала отвердевания осмотического давления) для разбавленного раствора нелетучего растворенного вещества в летучем растворителе при известных свойствах растворителя и концентрации раствора.
-
Вычисление значения одного коллигативного свойства для разбавленного раствора нелетучего растворенного вещества в летучем растворителе по значению другого коллигативного свойства.
-
Расчеты молярной массы нелетучего растворенного вещества по повышению температуры кипения (вариант: по понижению температуры отвердевания) его разбавленного раствора в летучем растворителе. Определение молекулярной массы и химической формулы растворенного вещества.
-
Расчеты изотонического коэффициента и кажущейся степени диссоциации или ассоциации растворенного вещества в разбавленном растворе по данным о коллигативных свойствах раствора.
-
Расчеты равновесных количеств вещества в двух равновесных фазах бинарной системы по правилу рычага (вариант: расчет масс двух фаз, сосуществующих в равновесии в бинарной системе).
-
Расчет количества компонента, которое требуется добавить к бинарной системе, находящейся в заданном состоянии, для перевода ее в новое состояние, указываемое по диаграмме.
-
Расчет наибольшего количества компонента, которое теоретически может быть выделено в чистом виде из заданного количества бинарной системы с известной концентрацией, путем ректификации при постоянном давлении.
-
Определение химической формулы твердого соединения по диаграмме плавкости неизоморфной бинарной системы.
-
Оценка энтальпии плавления вещества – компонента бинарной системы по уравнению Шредера.
-
Определение количества вещества (или массы вещества) в твердой фазе, закристаллизовавшейся при охлаждении расплава известной концентрации до заданной температуры.
