
Лабораторные работы / Лабораторная Работа 42 49 по ФХ (теория)
.pdfРХТУ им. Д.И. Менделеева Кафедра Физической химии. Лаборатория спектроскопии
Лабораторная работа № 42, 49
Определение константы диссоциации слабых электролитов по спектрам поглощения растворов

Теоретическая часть.
§1. Предмет и задачи спектрохимии.
Спектром называется распределение энергии электромагнитного излучения по длинам волн или частотам.
Молекулярная спектроскопия изучает спектральный состав излучения, получающегося в результате поглощения, испускания или рассеяния света1 веществом. Во всех случаях молекулярный спектр является результатом квантовых переходов между различными энергетическими состояниями молекул и содержит информацию об их строении.
Абсорбционная спектроскопия основана на способности вещества к избирательному поглощению. Чтобы определить, какие именно кванты поглощаются веществом и какова величина поглощения, через вещество пропускают электромагнитное излучение источника, имеющего непрерывный спектр испускания, а затем прошедший поток раскладывают в спектральном приборе по длинам волн и исследуют его спектральный состав. Подобным же образом изучают рассеянное веществом излучение.
Эмиссионная спектроскопия, нашедшая широкое применение в атомной спектроскопии, для изучения молекул используется реже. Для получения спектров испускания необходимо перевести достаточное число молекул в возбужденное состояние, сообщив веществу избыточную энергию извне. Нередко для этого применяют пламя горелки, дуговой или искровой разряд и т.д. Однако при этом многие химические связи в молекуле разрываются, и наблюдаемый эмиссионный спектр представляет собой спектр продуктов диссоциации - радикалов, атомов и ионов. В то же время именно это делает метод эмиссионной спектроскопии одним из плодотворных экспериментальных приемов для изучения радикалов, играющих решающую роль в протекании многих цепных реакций.
В последнее время с применением лазерной техники стал развиваться метод резонансной флуоресценции. Строго монохроматическое и интенсивное излучение лазера позволяет перевести в возбужденное состояние на определённый энергетический уровень достаточно большое
1 Здесь и далее слова "свет", "световой" и т.п. условно используются для обозначения электромагнитного излучения не только в видимой, но и в других областях спектра, применяемых в молекулярной спектроскопии.
1
число молекул, которые затем, возвращаясь на более низкие уровни, испускают спектр резонансной флуоресценции.
Термином спектрохимия обозначают обычно такой раздел современной науки, в котором спектральные измерения проводят с целью решения различных химических и физико-химических задач. Возможности спектрохимии чрезвычайно многообразны. Укажем лишь небольшую долю из огромного круга задач, решать которые позволяют методы спектрохимии.
1. Определение молекулярных постоянных, позволяющих описать систему энергетических состояний молекулы
Эти данные используют для расчета термодинамических функций веществ и констант равновесия химических реакций в газовой фазе методами статистической термодинамики.
2. Определение строения молекулы или ее составных частей Определение в молекуле функциональных групп. Установление
геометрической конфигурации молекул, их симметрии; определение внутримолекулярных расстояний и углов между связями. Количественная оценка упругих сил, действующих между атомами в молекуле, определение частот внутримолекулярных колебаний, энергии диссоциации. Установление структуры координационных соединений - определение числа и способов связывания лигандов. Доказательство наличия изомерии, идентификация геометрических изомеров.
3. Исследование межмолекулярных взаимодействий Изучение водородной и донорно-акцепторной связи, явлений гидратации и
сольватации, взаимодействия между ионами в растворах. Исследование поверхностных пленок, строения адсорбционных комплексов и природы взаимодействия адсорбированного вещества с поверхностью.
4. Исследование химических равновесий и кинетики химических реакций Исследование различных равновесий, в том числе диссоциации и ассоциации, комплексообразования, таутомерных превращений, фазовых и адсорбционных равновесий; изучение кинетики различных химических превращений, в том числе кинетики адсорбции, кинетики полимеризации и
т.п.
5. Аналитическое приложение Качественный и количественный анализ молекулярного состава
природных и синтетических веществ, многокомпонентных смесей;
2

идентификация индивидуального соединения, определение его молекулярной массы; контроль степени очистки.
Рассмотрим единицы измерения, используемые в молекулярной спектроскопии и спектрохимии.
Согласно квантовой теории изменение энергии молекулы при
поглощении (или испускании) определяется формулой: |
|
hν = E′− E′′, |
(1) |
где h-постоянная Планка, ν-частота в с- 1 , E′-энергия молекулы в верхнем, а E′′- энергия молекулы в нижнем состоянии.
Монохроматическое излучение можно характеризовать энергией кванта
hν, |
частотой ν, |
длиной волны λ или волновым числом λ~ 2: |
|
||
|
|
|
hc |
|
|
|
|
hν = |
|
= hcν~ |
(2) |
|
|
λ |
|||
где |
с-скорость |
распространения |
электромагнитного излучения |
в вакууме |
|
(скорость света); λ1 =ν~ .
Если речь идет о полихроматическом излучении, указывают диапазон этих величин.
Энергию выражают в джоулях (Дж); допускается использование электроновольта (эВ); 1 эВ = 1.602 10−19 Дж.
Для измерения длины волны в зависимости от области спектра используют единицы, являющиеся десятичными от основной единицы длины в СИ – метра: в ультрафиолетовой (УФ) и видимой областях - нанометр (1 нм = 10- 9 м), в ближней и средней инфракрасной (ИК) областях - микрометр (1 мкм = 10- 6 м), в дальней ИК и микроволновой областях - мм и см.
Частоту измеряют в "обратных секундах" (с- 1 ), или герцах (Гц). Волновое число ν~ измеряют в "обратных сантиметрах" (СМ- 1 ) или "обратных метрах" (м- 1 ). Частота ν и волновое число ν~ находятся в соотношении
ν =cν~ 3.
2 В физике под частотой понимают величину ω = 2πν ("круговая частота"), а
под волновым числом - K = 2λπ .
3 На практике волновое число ν~ нередко тоже называют частотой, хотя строго говоря, это неверно. Однако никаких недоразумений при этом не возникает, если указывать единицы измерения. Например, фраза "полоса
3

Внутримолекулярные расстояния измеряют в метрах и нанометрах4. Весь спектр электромагнитного излучения охватывает широкий диапазон
частот от длинных радиоволн до жесткого γ-излучения. Молекулярная спектроскопия пользуется лишь сравнительно небольшой его частью. Области этой части электромагнитного спектра и соответствующие им длины волн и волновые числа приведены в табл. 1.
|
|
|
|
|
Таблица 1. |
||
|
Области электромагнитного спектра |
||||||
|
Область спектра |
|
Длина волны λ, см |
|
Волновое числоν~ , см- 1 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
Радиоволны |
|
|
|
|
|
|
|
↑ |
|
10 – 10- 1 |
|
10- 1 – 10 |
|
|
|
Микроволновая |
|
|
|
|
||
|
ИК дальняя |
|
10- 1 – 5·10- 3 |
|
10 – 200 |
|
|
|
ИК средняя |
|
5·10- 3 - 2·10- 4 |
|
200 – 5000 |
|
|
|
ИК ближняя |
|
2·10- 4 – 0.76·10- 4 |
|
5000 – 13000 |
|
|
|
Видимая |
|
0.76·10- 4 – 0.4·10- 4 |
|
1.3·104 – 2.5·104 |
|
|
|
УФ ближняя |
|
0.4·10- 4 – 0.2·10- 4 |
|
3.5·104 – 5·104 |
|
|
|
УФ дальняя |
|
0.2·10- 4 – 10- 6 |
|
5·104 – 106 |
|
|
|
↓ |
|
|
|
|
|
|
|
Рентгеновское и γ- |
|
|
|
|
|
|
|
излучение |
|
|
|
|
|
|
В зависимости от того, в какой области изучается спектр, его называют ультрафиолетовым, видимым, инфракрасным или микроволновым. Спектры в первых трех областях называют оптическими. Их объединяют общие способы получения спектра (преломление света и дифракция) и экспериментальные метода, разработанные еще на заре спектроскопии для видимой области. Для получения микроволновых спектров используют методы радиоспектроскопии.
§2. Превращение энергии при поглощении Существенное различие в спектре одного и того же вещества при пе-
реходе от одной области частот к другой (рис.1) заставляет прийти к выводу о том, что большой и малый квант по-разному действуют на молекулу. С
поглощения при частоте 1600 см- 1 " не вызывает сомнений В том, что речь идет о величине ν~ .
4 В литературе можно встретить внесистемную единицу "ангстрем" (1 Å = 0.1 нм = 10- 1 0 м)
4
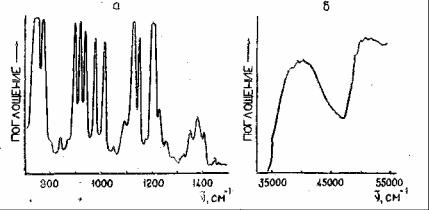
другой стороны, не найдется и двух веществ, имеющих абсолютно совпадающие спектры поглощения во всем диапазоне частот от ИК до УФ области, Очевидно причину этого нужно искать в структуре каждого вещества.
Рис.1. Инфракрасный (а) и ультрафиолетовый (б) спектры поглощения пиридина: а - жидкая пленка, б - раствор в гексане
Спектр поглощения заметно меняется и при переходе от твердого состояния вещества к жидкому, и от жидкого к газообразному. Таким образом, характер взаимодействия вещества с электромагнитным излучением определяется как энергией падающих на вещество квантов, так а структурой и состоянием самого вещества.
Если не рассматривать внутриядерную энергию, полная энергия молекулы складывается в первом приближении аз энергии электронов Ee l , энергии колебания ядер Eν , энергии вращения молекула кaк целого Еr , и энергии ее поступательного движения Et :
E = Eel + Eν + Er + Et |
(3) |
Первые три вида движения подчиняются квантовым законам, энергия же поступательного движения может меняться непрерывно. При более строгом рассмотрении полной энергии молекулы требуется учитывать взаимодействие различных видов движения.
При переходе молекулы из одного состояния в другое могут изменяться все составляющие энергии, и в общем случае энергия поглощенного кванта (без учета изменения энергии поступательного движения):
hν = E′− E′′=(Eel′ − Eel′′) + (Eν′ − Eν′′) + (Er′ − Er′′) |
(4) |
5

Взаимное расположение электронных, колебательных и вращательных квантовых уровней и переходы между ними определяют вид и структуру молекулярного спектра.
Сопоставим вклады различных видов движения в общую энергию молекулы на примере молекулы Н2 (табл.2). Из приведенных данных можно сделать важные заключения. Во-первых, каждый вид молекулярного движения в первом приближении можно рассматривать независимо друг от друга, хотя в молекуле все эти виды движения взаимосвязаны и совершаются одновременно. Основой такого разделения служит тот факт, что электронная энергия значительно больше колебательной, а последняя, в свою очередь, примерно на порядок превосходит вращательную энергию молекул:
Eel Eν Er
Во-вторых, такая разница в энергиях показывает, что для возбуждения того или иного вида молекулярного движения требуется существенно различная энергия: меньше всего для возбуждения вращательного движения, заметно больше для возбуждения колебательного несоизмеримо больше энергии необходимо затратить на возбуждение электронов, т.е.
∆Eel ∆Eν ∆Er
Таблица 2 Вклад различных видов молекулярного движения в энергию I моль водорода
при 291 К (кДж/моль)
Электронная энергия |
3095 |
Колебательная энергия |
25,9 |
Вращательная энергия |
2,5 |
Поступательная энергия |
3.8 |
|
|
Если сопоставить энергию различных видов движения для H2 с энергиями квантов в соответствующих областях спектра (табл. 3), легко заметить, что энергия электромагнитного излучения в видимой и УФ областях соизмерима с электронной энергией молекулы, в ближней и средней ИК областях она имеет тот же порядок, что и энергия колебания ядер в молекуле, а в дальней ИК и микроволновой областях – соответствует энергии вращения молекулы.
6
Хотя численные значения различных составляющих энергии для других молекул будут иными, чем для водорода, подобное сопоставление чаще всего приводит к аналогичным результатам.
Таким образом, ответ на вопрос о том, в какую форму движения преобразуется поглощаемая молекулой энергия, зависит от величины падающего на нее кванта, поскольку каждая область спектра связана с возбуждением определенного вида молекулярного движения.
Таблица 3 Энергия квантов в различных областях электромагнитного спектра
Область спектра |
Энергия Е, кДж/моль5 |
Молекулярный процесс- |
|
|
причина поглощения |
Микроволновая |
0.0012 – 0.12 |
Вращение молекул |
Дальняя ИК |
0.12 – 2.4 |
|
Средняя ИК |
2.4 – 60 |
Колебания ядер и атомов |
Ближняя ИК |
60 – 155 |
в молекуле |
Видимая |
155 – 300 |
Переходы валентных |
Ближняя УФ |
300 – 598 |
электронов |
Дальняя УФ |
598 – 12000 |
|
§3. Закон светопоглощения Ламберта-Бугера-Беера.
При исследовании спектров поглощения обычно интересует не только качество (частота, длина волны), но и количество поглощенного излучения.
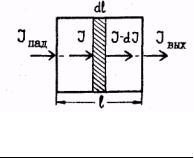
Пусть кювета (рис.2) с толщиной слоя l заполнена поглощающей средой. Это может быть газ, жидкость, твердое тело, может быть индивидуальное вещество или раствор. При прохождении параллельного монохроматического пучка света через эту среду его интенсивность уменьшается. Закон светопоглощения утверждает, что ослабление светового потока в данной поглощающей среде зависит, во-первых, от толщины поглощающего слоя l и, во-вторых, от концентрации поглощающих частиц С, а также устанавливает характер этой зависимости количественно.
Рис. 2. К математической формулировке закона светопоглощения Ламберта-Бугера-Беера.
5 Е = hνNa
7

Первую зависимость часто называют законом Ламберта-Бугера: каждый тонкий слой постоянной толщины внутри однородной среды поглощает одинаковую долю падающего на него светового потока.
Вторая зависимость носит название закона Беера: поглощение света данным тонким слоем внутри однородной среды пропорционально числу поглощающих частиц в единице объема, т.е. концентрации.
Обе эти зависимости обычно объединяют и называют законом светопоглощения Ламберта-Бугера-Беера6.
Математическая формулировка закона светопоглощения основывается на утверждении, что относительное ослабление света − dII (минус указывает на
поглощение света) в тонком слое не зависит от интенсивности падающего света и пропорционально толщине этого слоя dl и концентрации поглощающих частиц С (рис.2). Это положение, достаточно хорошо соблюдается при не слишком больших значениях I и С в отсутствии люминесценции и фосфоресценции.
Для монохроматического пучка света можно записать
− dII = kCdl , (5)
где коэффициент пропорциональности k носит название коэффициента поглощения.
После интегрирования в пределах
Iвых |
dI |
|
l |
|
||
∫ |
= −kС∫dl |
(6) |
||||
|
I |
|||||
Iпад |
|
0 |
|
|||
получаем |
|
|
|
|
|
|
ln( |
I пад |
) = kCl |
(7) |
|||
|
||||||
|
|
I вых |
|
|||
и |
|
|
|
|
|
|
I вых = I пад exp(−kCl) |
(8) |
|||||
Таким образом, при прохождении монохроматического света через поглощающую среду его интенсивность уменьшается в зависимости от l и С экспоненциально.
6 Закон светопоглощения был установлен экспериментально П.Бугером в 1729 г., математически сформулирован И. Ламбертом в 1760 г. и в отношении концентрации подтвержден А. Беером в 1852 г.
8

На практике приходится, однако, учитывать, что ослабление светового потока в кювете происходит как в результате поглощения, так и в результате рассеяния к. отражения, особенно при прохождении пучка через границу раздела фаз у стенок кюветы (рис.3).
Рис.3. Ослабление светового потока в кювете с поглощающим веществом (А) и в кювете сравнения
(Б).
Если пропустить свет через такую же кювету, но заполненную непоглощающей средой (например, прозрачным растворителем в случае исследования раствора), то в ней ослабление светового потока произойдет только из-за рассеяния и отражения от окошек кюветы. Таким образом, для учета собственной поглощающей способности вещества необходимо сравнивать световой поток I, прошедший через кювету с поглощающим веществом, и световой поток I0 , прошедший через кювету сравнения (соответственно кюветы А и Б на рис. 2):
ln( II0 ) = kCl
I = I 0 exp(−kCl)
Переходя к десятичным логарифмам и вводя обозначение
lg( II0 ) = A
получаем
(9)
(10)
|
|
|
A = |
k |
Cl |
(11) |
|||
|
|
|
|
|
|||||
|
|
|
2.3 |
|
|
|
|||
Величину А называют оптической плотностью (экстинкцией, |
|||||||||
погашением), а дробь |
k |
- |
коэффициентом |
погашения (коэффициентом |
|||||
2.3 |
|||||||||
|
|
|
|
|
|
|
|
||
экстинкции) и обозначают через ε: ε = |
k |
. |
|
||||||
|
|
||||||||
|
|
|
2.3 |
|
|||||
Окончательно закон светопоглощения обычно записывают в виде: |
|||||||||
|
|
|
A =εCl |
(12) |
|||||
На основании уравнения |
(12) можно дать |
следующую формулировку |
|||||||
9
