ЯМР - строение углеводов - 2001 / nmr_ch
.doc
Пример структурного исследования с помощью спектроскопии ЯМР: строение углеводов
Ниже представлена приблизительная схема исследования полисахарида с помощью спектроскопии ЯМР:
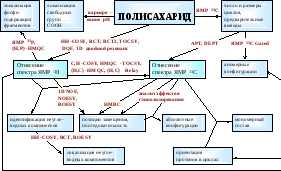
Далее приводится краткий обзор по наиболее важным экспериментам ЯМР, упомянутым на схеме.
APT (attached proton test) - одномерный эксперимент, результат которого схож с INEPT (если нет четвертичных углеродов): сигналы групп СН2 имеют фазу, отличающуюся на 180, что позволяет легко выделить их из остального спектра. Сигналы четвертичных углеродов не наблюдаются.
13С Gated - накопление спектра ЯМР 13С без развязки от протонов. Несмотря на низкую чувствительность, этот эксперимент бывает полезен, так как позволяет получить значения гетероядерных КССВ. По КССВ JC1-H1 можно судить об аномерной конфигурации пираноз.
Одномерные эксперименты по двойному резонансу часто позволяют с большей точностью, чем COSY, проанализировать форму сигналов H-2 и, иногда, некоторых других. Облучая дополнительным селективным импульсом какой-либо сигнал, мы выравниваем заселенности уровней, соответствующих его переходам, и тем самым подавляем спин-спиновое расщепление за счет взаимодействия с ядрами, давшими облучаемый сигнал. Вычитая спектр, накопленный со включенным декаплером (в первом приближении) из обычного, мы получаем сигналы только там, где произошли изменения. Для решения проблем совмещения (при исчезновении расщепления сигналы еще и сдвигаются), а также для того, чтобы форму исходного сигнала было хорошо видно, применяется импульс с мощностью, недостаточной для полной развязки, в результате чего “развязанный” сигнал выглядит, как холм неопределенной формы, на фоне которого хорошо видно то, что мы из него вычитаем.
Основными средствами отнесения протонных спектров являются эксперименты COSY, COSY RCT, COSY RCT2, DQF COSY и TOCSY. COSY RCT (Relayed Coherence Transfer) и RCT2 отличаются от COSY тем, что спин-спиновое взаимодействие переносится по CH-скелету на нужное число шагов, в результате чего можно наблюдать корреляции протонов Н-1 с Н-3 (в COSY RCT) или с Н-4 (в COSY RCT2). Ближние корреляции реально тоже наблюдаются. Дальнейшее развитие идеи переноса взаимодействия - это эксперимент TOCSY, отражающий все протон-протонные корреляции в пределах остатка. Все упомянутые эксперименты дают однозначные результаты, лишь в случае относительно больших КССВ (больше 8 Гц), т.е. при аксиально расположенных протонах. Кросс-пики, соответствующие меньшим КССВ (если один или оба из взаимодействующих протонов расположены экваториально), наблюдаются не всегда.
Эксперимент DQF COSY (Double Quantum Filter) - это тот же COSY, но без диагональной линии. Второй импульс в COSY может быть и меньше, чем /2. При величине импульса /4 спектр (он называется COSY-45) получается лучше разрешен вблизи диагонали, и, кроме того, кросс-пики имеют наклон, соответствующий знаку КССВ, но COSY-45 обладает меньшей чувствительностью, как и другие перечисленные эксперименты (кроме COSY RCT).
Добавление к COSY еще одного импульса, отделенного так называемым временем смешения, приводит к наблюдению NOE в двумерной форме (эксперимент NOESY). Этот эксперимент существует также в фазочувствительном варианте ROESY (Rotating frame Overhauser Effect SpectroscopY), применяемом для полимеров. Варьируя время смешения, можно управлять интенсивностью пиков, обусловленных переносом взаимодействия, а также наличием или отсутствием TOCSY-пиков в этих спектрах. Результат этих экспериментов, как правило, подтверждает выявленные позиции замещения и определяет последовательность соединения моносахаридных остатков.
COSY существует и в гетероядерном варианте, но сейчас практически не используется, так как заменен гетероядерной корреляцией HMQC (Heteronuclear Multiple Quantum Coherence). HMQC - это основное средство отнесения спектра ЯМР 13С, так как он показывает прямые С-Н взаимодействия. Существуют также родственные эксперименты: HMQC Relay, связывающий соседние углеродные атомы через протонные КССВ (позволяет идти по углеродному скелету) и HMQC-TOCSY, в котором сигналы углеродных атомов коррелируют с сигналами всех протонов в пределах остатка, и наоборот. HMQC-TOCSY позволяет выделить спиновые системы каждого остатка из общей массы сигналов в спектрах ПМР и ЯМР 13С. Анализ дальних углерод-протонных взаимодействий возможен при рассмотрении спектров HMBC (Heteronuclear Multiple-Bond Correlation), отражающих гетероядерные КССВ, меньшие, чем 20Гц. В ряде случаев, этот эксперимент заменяет или дополняет ROESY, так как дает представление о том, что к чему присоединено.
Для лучшего понимания вышеописанных методов схемы ниже следует пример установления строения повторяющегося звена О-антигена Proteus penneri 103:
Спектр ЯМР 13С соединения P. penneri 103 (Ðèñ. 1) содержит один сигнал углеродного атома, связанного с азотом, при 52.1 м.д., сигналы соответствующей N-ацетильной группы при 23.3 м.д. и 175.7 м.д., а также характерный для остатка фосфоэтаноламина (PEtN)1 сигнал при 41.0 м.д. По данным эксперимента DEPT2-135, шесть сигналов в области 61.7-66.3 м.д. соответствуют метиленовым группам. Один из них (62.5 м.д.) приходится на атом С-1 остатка PEtN, а из пяти оставшихся два (при 65.7 и 66.3 м.д.) соответствуют замещенным группам СН2ОН.
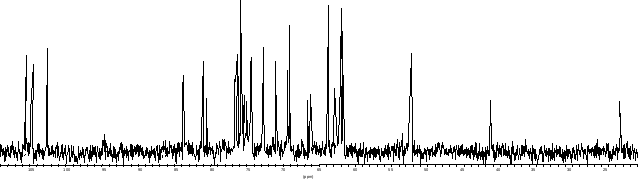
Ðèñ. 1 Спектр ЯМР 13С полисахарида P. penneri 103
Три сигнала аномерных атомов углерода при 102.1, 104.0 и 105.0 м.д. говорят о наличии трех циклических моносахаридных остатков, однако число сигналов в углеводной области спектра ЯМР 13С 60-85 м.д. превышает 14(3). С учетом наблюдения пяти сигналов групп СН2О (помимо сигнала С-1 PEtN), можно сделать предположение о присутствии еще одного остатка в форме полиола. На основании количества сигналов в спектре ЯМР 13С было сделано предположение о полиоле, содержащем пять углеродных атомов (Ara-ol, Xyl-ol или Rib-ol), доказанное впоследствии при анализе данных COSY.
Спиновые системы трех моносахаридных остатков, идентифицированные с помощью двумерных гомоядерных корреляций COSY и TOCSY, характеризовались набором протон-протонных КССВ, определяющим моносахаридный состав, как Glcp, Galp, GalpNAc. Отнесение спектра ПМР представлено в таблице на следующей стр. 4
|
Остаток |
Протон |
|||||
|
|
H1 |
H2 |
H3 |
H4 |
H5 |
H6a, H6b |
|
PEtN 6 |
4.07 J1,P 6.0 |
3.24 J1,2 5.0 |
--- |
--- |
--- |
--- |
|
-4)Glcp(1 |
4.64 J1,2 8.0 |
3.39 J2,3 9.0 |
3.66 J3,4 9.5 |
3.90 J4,5 9.5, J4,P 9 |
3.67
|
3.95, 4.20
|
|
3)Galp(1 |
4.47 J1,2 8.0 |
3.63 J2,3 10.0 |
3.73 J3,4 3.0 |
4.15 J4,5 <1.0 |
3.62 |
3.66-3.77 |
|
3)GalpNAc(1 |
4.67 J1,2 9.5 |
4.01 J2,3 11.0 |
3.84 J3,4 3.0 |
4.11 J4,5 <1.0 |
3.66
|
3.66-3.77 |
|
2)Ribol(1-P)-O- |
3.95, 4.14 J1b,2 7, J1b,P 7 |
4.09 J2,3 7 |
3.78 |
3.78 J4,5a 6.0, J4,5b 3.0 |
3.59, 3.77 J5a,5b 12.0 |
--- |
Химический сдвиг сигнала N-ацетильной группы 2.0 м.д. (СH3).
Остаток Glcp отличается величинами КССВ JН3,Н4 и JН4,Н5 порядка 10 Гц, в то время как для остатков с галакто-конфигурацией эти значения не превышали 3.0 Гц. Остаток GalpNAc был отличен от Galp по характерному химическому сдвигу его атома С-2 (52.1 м.д.), выясненному при анализе спектра 1Н,13С HMQC (Ðèñ. 2). Величины КССВ JН1,Н2, превышающие 7.5 Гц, свидетельствовали о -конфигурации всех гликозидных остатков.
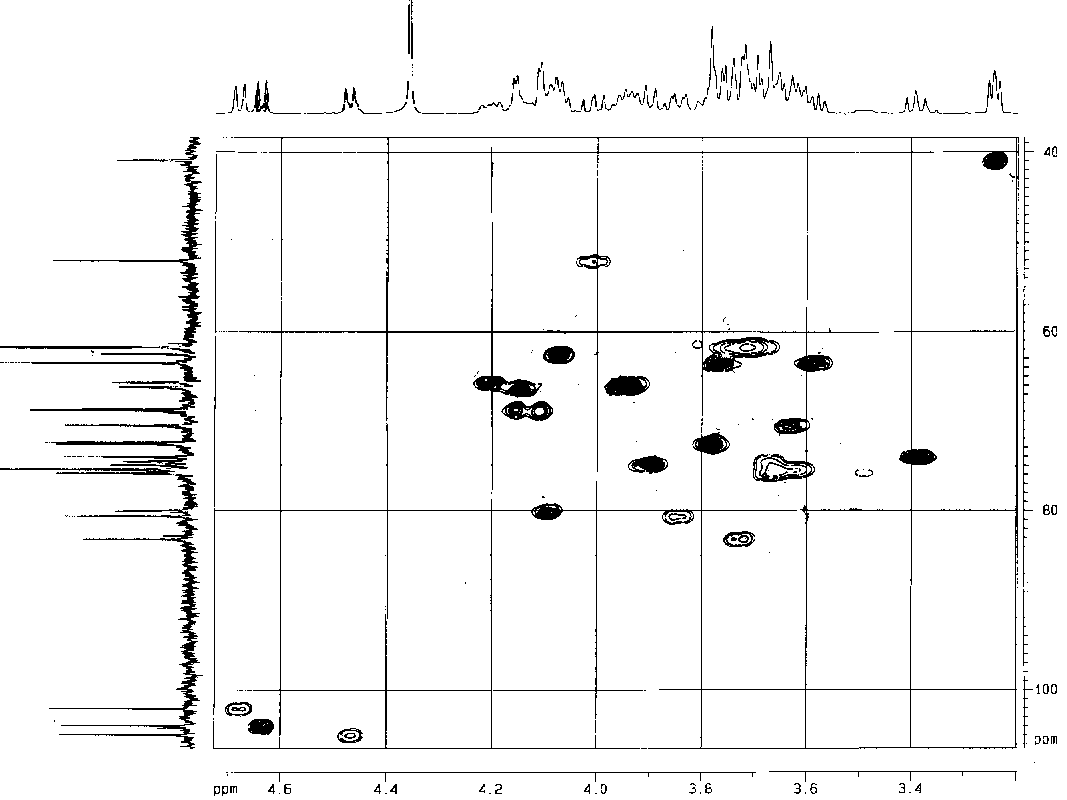
Ðèñ. 2 Часть спектра 1Í,13С HMQC полисахарида P. penneri 103
Спиновая система полиола была отнесена также при помощи экспериментов COSY и TOCSY, что позволило найти его сигналы в спектре ЯМР 13С. Эти данные, как и отнесение остальной части спектра ЯМР 13С, выполненное на основании результатов эксперимента по двумерной гетероядерной корреляции 1Н,13С HMQC (Ðèñ. 2), представлены в таблице:
|
Остаток |
Атом углерода |
|||||
|
|
С1 |
С2 |
С3 |
С4 |
С5 |
С6 |
|
PEtN 6 |
62.5, J1,P 5.0 |
41.0, J2,P 7.4 |
--- |
--- |
--- |
--- |
|
-4)Glcp(1 |
104.0 |
74.0 |
75.9 |
74.9, J4,P 6.5 |
74.6, J5,P 6.1 |
65.7, J6,P 3.5 |
|
3)Galp(1 |
105.0 |
70.6 |
83.3 |
68.7 |
75.5 |
61.8* |
|
3)GalpNAc(1 |
102.1 |
52.1 |
80.7 |
68.8 |
75.5 |
61.7* |
|
2)Ribol(1-P)-O- |
66.3, J1,P 5.3 |
80.1, J2,P 5.3 |
72.6** |
72.5** |
63.5 |
--- |
Химические сдвиги сигналов N-ацетильной группы 23.3 м.д. (СH3), 175.7 м.д. (СО).
*, ** Отнесение может быть обратным
Ðèñ.
3
Рибит-полиол
Существенные слабопольные сдвиги сигналов С-3 Galp (83.3 м.д.), С-3 GalpNAc (80.7 м.д.), С-4 (74.9 м.д.) и С-6 (65.7 м.д.) Glcp, С-1 (66.3 м.д.) и С-2 (80.1 м.д.) Ribol в сравнении с известными значениями[] определили позиции замещения.
Предположение о наличии фосфодиэфирной связи, базировавшееся на наблюдении расщепления ряда сигналов (см. таблицу) в спектре ЯМР 13С, снятом в режиме широкополосной развязки от области резонанса протонов, подтвердилось данными спектра ЯМР 31Р, который, помимо сигнала остатка PEtN при 1.7 м.д., содержал сигнал фосфатной группы при 1.3 м.д. Двумерная гетероядерная корреляция 1Н,31Р HMQC (Error: Reference source not found) позволила выявить места присоединения фосфора к повторяющемуся звену полимера. Так кросс-пики при 1.7/(3.95, 4.20) м.д., соответствующие взаимодействию фосфоэтаноламина с атомами Н-6 остатка Glcp, определяют, с учетом выясненных позиций замещения, наличие в цепи фрагмента
PEtN
6
4)Glcp(1,
а кросс-пик при 1.3/3.90 м.д., соответствующий взаимодействию фосфатной группы с атомом Н-4 остатка Glcp, локализовал фосфодиэфирную связь. Наблюдение фосфор-углеродных КССВ на атомах С-1 и С-2 остатка Ribol
Ðèñ.
4
Спектр
1Í,31Р
HMQC полисахарида P.
penneri 103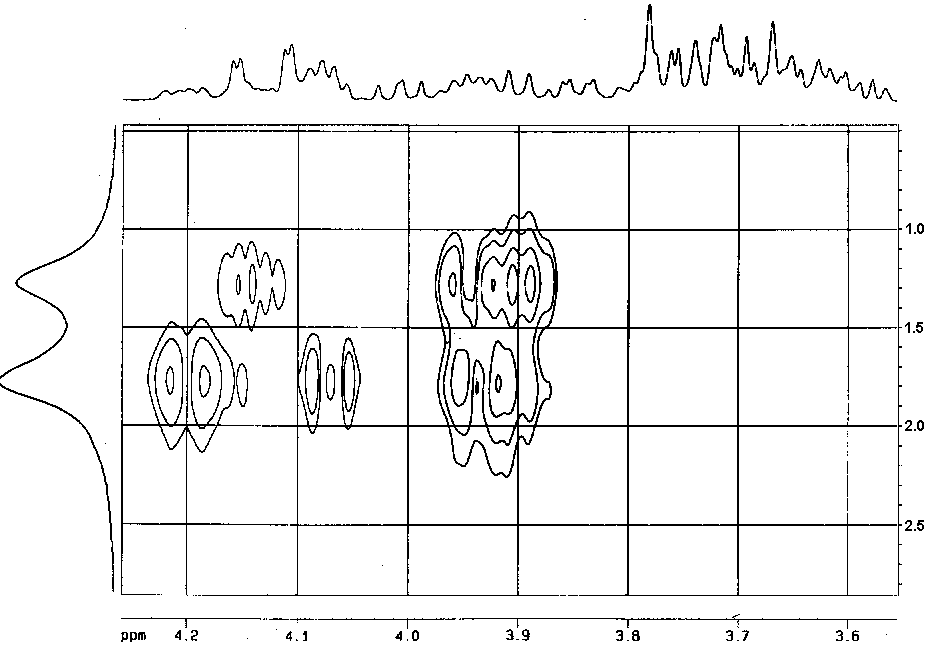
Для определения последовательности соединения остатков был проанализиован спектр ROESY, обнаруживший, кроме контактов в пределах остатков, четкие трансгликозидные контакты: Н1 Glcp / Н3 Galp при 4.64/3.73 м.д., Н1 Galp / Н3 GalpNAc при 4.47/3.84 м.д. и Н1 GalpNAc / Н2 Ribol при 4.67/4.09 м.д. Правильность определения последовательности остатков в цепи и отнесения спектров ПМР и ЯМР 13С подтвердилась данными двумерной гетероядерной корреляции 1Н,13С HMBC.
Анализ тонких различий в эффектах гликозилирования позволил сделать вывод об одинаковой абсолютной конфигурации всех остатков.
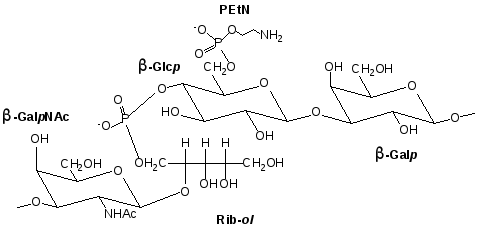
Базируясь на вышеизложенных данных, можно заключить, что соединение P. penneri 103 построено подобно тейхоевой кислоте грам-положительных бактерий и имеет повторяющееся звено следующего строения:
|
|
или, сокращенно, PEtN 6 3)DGalpNAc(12)Rib-ol(1-P-4)DGlcp(13)DGalp(1
|
________________________________________________________________________________________________________
Ф.В. Тоукач, 1999 февраль 16. ЯМР ИОХ РАН
1 Присутствие фосфоэтаноламина было доказано на более позднем этапе.
2 Distortionless Enhancement by Polarization Transfer
3 18-3(аномерные)-1(N-ацетилированный)=14.
4 Указанные позиции замещения, последовательность остатков и наличие фосфодиэфирной связи были выявлены на более позднем этапе.