
ОКЗ „Дніпропетровське медичне училище“
Навчальний посібник
з теоретичного курсу
Аналітичної хімії з тлр
для студентів медичних училищ
Укладач: Орєхова О.Ю.
Розглянуто і схвалено
на засіданні ЦМК
санітарно-гігієнічних дисциплін
„_____”_________________ 20__ р.
протокол № ____________________
Голова ЦМК ________ Р.П.Семенко
Рецензія
на посібник з теоретичного курсу
аналітичної хімії з технікою лабораторних робіт
підготовлений викладачем
"ОКЗ Дніпропетровське медичне училище"
Орєховою О.Ю.
Навчальний посібник з теоретичного курсу аналітичної хімії з технікою лабораторних робіт відповідає сучасним вимогам щодо організації навчального процесу і містить основні теми дисципліни „Аналітична хімія з ТЛР“, які вивчаються студентами медичних училищ. Зміст посібника охоплює 6 тем. До кожної теми складений план та надається перелік літератури, а також додаються питання самоконтролю, а до деяких – тренувальні вправи, які допоможуть студентам в осмисленні основних понять та законів аналітичної хімії. Посібник містить таблиці "Аналітична хімія" та "Фізико-хімічні методи в санітарно-гігієнічних дослідженнях", які нададуть суттєву допомогу студентам в засвоєнні теоретичних знань з дисципліни.
Навчальний посібник з теоретичного курсу аналітичної хімії з ТЛР складений згідно з інноваційними педагогічними технологіями на високому професійному та методичному рівнях відповідно до діючої навчальної програми з дисципліни і може бути рекомендований викладачам вищих навчальних закладів І-ІІ рівнів акредитації для впровадження у навчальний процес.
Яришкіна Л.О.
кандидат хімічних наук, доцент
завідувач кафедрою хімії та інженерної екології
Дніпропетровського національного університету
залізничного транспорту імені академіка В.Лазаряна
Укладач: Орєхова О.Ю. – викладач ОКЗ "Дніпропетровське
медичне училище"
Рецензент: Яришкіна Л.О. – кандидат хімічних наук, доцент, завідувач кафедрою хімії та інженерної екології Дніпропетровського національного університету залізничного транспорту імені академіка В.Лазаряна
Передмова
Hominis mens discendo aliter et cogitando –
Розум людини живиться навчанням і мисленням.
Теоретичні знання, які отримані студентами під час вивчення курсу аналітичної хімії з технікою лабораторних робіт, необхідні не тільки при опануванні ними спеціальних дисциплін санітарно-гігієнічного напрямку, а саме: комунальної гігієни, гігієни харчування, гігієни праці, гігієни дітей та підлітків, епідеміології та дезінфектології, а і у майбутній професійній діяльності в якості фельдшера санітарного і лаборанта.
Теоретичний курс дисципліни розрахований на 12 годин аудиторної роботи. Після закінчення вивчення теоретичного курсу аналітичної хімії з технікою лабораторних робіт, студенти повинні знати:
-
теоретичні основи та методи якісного аналізу:
-
будову і властивості комплексних солей;
-
рівновагу у гомогенних та гетерогенних системах;
-
йонний добуток води, визначення водневого показника;
-
механізми гідролізу солей різних типів;
-
буферні розчини;
-
особливості класифікації катіонів та аніонів;
-
теоретичні основи та методи кількісного аналізу:
-
теорію розчинів та способи вираження складу розчинів;
-
основні положення гравіметричних та титриметричних визначень;
-
загальну характеристику фізико-хімічних методів аналізу;
-
особливості фотоелектроколориметричних та електрохімічних визначень;
-
використання методів якісного та кількісного аналізів в професійній діяльності.
До кожної теми додаються питання самоконтролю, а до деяких і тренувальні вправи, які допоможуть студентам в засвоєнні основних понять та законів аналітичної хімії та будуть стимулом для поглибленого вивчення дисципліни. Таблиці "Аналітична хімія" та "Фізико-хімічні методи в санітарно-гігієнічних дослідженнях" нададуть суттєву допомогу в систематизуванні теоретичних знань з дисципліни.
Наявність посібника на електронних носіях дає змогу укладачу вносити зміни до тексту в оперативному режимі, а студентам – працювати з текстом посібника за допомогою персонального компьютера.
Укладач приносить щиру подяку за сприяння у підготовці збірника Заблодській Л.В за неоціненну допомогу в макетуванні збірника.
Зміст
|
№ з/п |
Зміст |
Сторінка |
|
1 |
Тема №1. Вступ. Охорона праці в галузі _____
|
5 |
|
2 |
Тема №2. Комплексні сполуки ______________ |
8 |
|
3 |
Тема №3. Добуток розчинності.Водневий показник. Гідроліз солей __________________
|
15 |
|
4 |
Тема №4. Розчини. Способи вираження складу розчинів ________________________________ |
23 |
|
5 |
Тема №5. Гравіметричний аналіз. Титриметричний аналіз ____________________ |
28 |
|
6 |
Тема №6. Фізико-хімічні методи дослідження __ |
34 |
|
7 |
Додаток ________________________________ |
40 |
|
8 |
Рекомендована література _________________ |
44 |
Teмa № 1
Вступ. Охорона праці в галузі
Основні питання теми:
-
Предмет і завдання аналітичної хімії.
-
Хімічний аналіз.
-
Охорона праці в галузі
Література:
Д.Д.Луцевич, А.С.Мороз та ін. "Аналітична хімія", К, "Здоров’я", 2003,
с.5-9, 97-100.
Полеес М.Э., Душечкина И.Н. "Аналитическая химия", М, "Медицина", 1987, с.5-11, 142-146.
Предмет і завдання аналітичної хімії.
Аналітична хімія – наука про методи визначення складу речовин. Має велике наукове і практичне значення. Аналітичні дослідження – це встановлення якісного та кількісного складу речовин, вивчення їх структури та перебігу хімічних реакцій між речовинами.
Хімічний аналіз
Хімічний аналіз – галузь знань, яка охоплює методи визначення складу речовин як якісного, так і кількісного. Це найважливіший засіб контролю за складом речовин.
На основі данних хімічного аналізу були сформульовані кількісні закони хімії, встановлено атомні маси елементів, хімічні формули речовин та їх сполук.
На основі методів хімічного аналізу проводиться клінічна і лабораторна діагностика захворювань, визначення накопичення забрудників в об’єктах навколишнього середовища.
Хімічний аналіз складається з якісного та кількісного аналізів.
За допомогою якісного аналізу визначають окремі хімічні елементи та їх сполуки в складі речовини.
За допомогою кількісного аналізу визначають кількість складових частин у досліджуваних речовинах або їх сумішах.
Розрізняють такі методи аналізу:
-
хімічні (класичні): в їх основі – проведення хімічних якісних реакцій;
-
інструментальні (фізико-хімічні): в їх основі – вивчення фізичних властивостей речовин з використанням відповідних приладів;
-
експрес-методи (швидкі аналізи-тести): в їх основі – визначення складу речовини за декілька хвилин (іноді – з невідповідною точністю).
Охорона праці в галузі
Хімічний аналіз проводять в аналітичній лабораторії, яка має бути обладнаною відповідними спеціальними меблями, витяжною шафою, контрольно-вимірювальними приладами та іншим устаткуванням, засобами протипожежної безпеки. Освітлення, вентиляція, системи водопостачання, опалення повинні відповідати санітарно-гігієнічним вимогам. Усі працюючі повинні суворо дотримуватись правил охорони праці при роботі в аналітичній лабораторії, які викладені у галузевих інструкціях з охорони праці та проходити відповідний інструктаж з реєстрацією у прошнурованому журналі.
У разі нещасних випадків кожен працюючий повинен надати першу допомогу постраждалому, а саме:
-
у разі отруєння шкідливими газами слід негайно припинити досліди та відчинити вікна й двері. Потерпілого винести на свіже повітря, розстебнути одяг, дати понюхати вату, змочену нашатирним спиртом. Коли він опритомніє, напоїти міцним чаєм;
-
у разі неглибокого отруєння хлором або випарами брому дати потерпілому понюхати суміш етілового й нашатирного спиртів;
-
у разі отруєння йодом потерпілому слід випити крохмаль з водою, молоко,міцний чай або розчин соди;
-
у разі отруєння лугами потрібно випити молоко або трохи розбовленого розчину ацетатної чи цитратної кислоти;
-
у разі отруєння кислотами потерпілому слід випити води з розтертою крейдою, вапняної води або розбавлений розчин натрій гідрогенкарбонату. Не вживати блювотних засобів і не прмивати шлунок!
-
при опіках рану слід обробити розчином калій перманганату, таніну або маззю від опіків;
-
у разі потрапляння на шкіру кислоти чи лугу уражене місце слід промити значною кількістю води, а потім відповідно розчином соди або ацетатної кислоти.
Питання самоконтролю
-
Що вивчає аналітична хімія?
-
Основна мета хімічного аналізу.
-
Які завдання мають якісний та кількісний аналізи?
-
Які Ви знаєте основні правила охорони праці при роботі в аналітичній лабораторії?
Тема № 2
Комплексні сполуки
Основні питання теми:
1. Загальні поняття про комплексні сполуки. Координаційна теорія будови комплексних солей Вернера.
2. Дисоціація комплексних солей.
3. Загальні поняття якісного аналізу: методи, аналітичні реакції, реагенти, хід аналізу.
4. Аналітична класифікація катіонів і аніонів.
Література:
Д.Д.Луцевич, А.С.Мороз та ін. "Аналітична хімія", К, "Здоров’я", 2003,
с.46-61, 88-97.
Полеес М.Э., Душечкина И.Н. "Аналитическая химия", М, "Медицина", 1987, с.57-70, 123-142.
Комплексні сполуки
Комплексні сполуки – сполуки, які містять в своєму складі комплексні іони.
Комплексні іони – утворені простими іонами або іонами і нейтральними молекулами; їх властивості відмінні від властивостей окремих іонів або молекул, з яких вони утворились; утворюються при сполученні двох різних іонів в один або приєднанні до окремих іонів нейтральних молекул.
Координаційна теорія будови комплексних сполук Вернера:
-
комплексоутворювач (К) – один з атомів (центральний атом) з позитивним ступенем окиснення (СО), який займає центральне місце: Ag+, Cu2+, Co3+, Al3+, Ni2+, Pb2+, Cr3+, Fe2+, Fe3+, Si4+, S6+, P5+ (катіони металів чи неметалів);
-
ліганди (аденди) (L) – містяться біля К; мають негативний СО або представлені молекулами і входять до складу внутрішньої координаційної сфери разом із К;
-
зовнішня координаційна сфера – її складають іони, що містяться на відстані від К;
-
координаційне число – кількість лігандів, які зв’язані з комплексоутворювачем (залежить від розміру ядра, його заряду, будови електронних шарів); частіше дорівнює 2, 4, 6, 8.
К


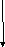 омплексоутворювач
(Men+)
омплексоутворювач
(Men+)
К


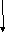 оординаційне
число
оординаційне
число
Л

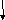
 іганди
іганди
[Ag(NH3)2] Cl K4 [Fe(CN)6]


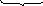
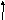
З
 овнішня
сфера
овнішня
сфера
В
 нутрішня
сфера
нутрішня
сфера
Будова комплексних сполук: комплексоутворювач має вакантне місце у зовнішньому електронному шарі, а ліганд має неподілену пару електронів, яка і займає це вакантне місце. Тобто, комплексоутворювач є акцептором електронів, а ліганд донором електронів. Таким чином, комплексні сполуки за теорією валентних зв’язків утворюються завдяки донорно-акцепторному зв’язку.
Дисоціація комплексних солей
Заряд комплексного іона дорівнює алгебраїчній сумі зарядів К та L, або заряду комплексоутворювача, якщо ліганд – електронейтральна молекула.
Комплексні солі дисоціюють на внутрішню та зовнішню координаційні сфери: гексаціано(ІІ)ферат калію:
K4[Fe(CN)6] ↔ 4K+ + [Fe(CN)6]-4 (первинна дисоціація),
але, якщо комплексні іони не стійкі, можлива дисоціація внутрішньої координаційної сфери:
[Fe(CN)6]-4 ↔ Fe+2 + 6CN- (вторинна дисоціація).
Використання комплексних сполук в аналізі
У хімічному аналізі комплексні сполуки використовують для:
-
для відкриття катіонів: Fe3+ за допомогою K4[Fe(CN)6];
-
для визначення твердості води у кількісному аналізі (комплексонометричне титрування);
-
для відокремлення катіонів різних аналітичних груп;
-
для маскування іонів, які заважають аналізу (переводять іони, які заважають аналізу, у стійкі комплексні сполуки, в яких властивості цих іонів не виявляються).
-
Загальні поняття якісного аналізу
Мета якісного аналізу – визначення якісного складу речовини, тобто ідентифікація атомів, іонів або молекул та їх сполук в складі речовин.
Методи аналізу – Фізичні – ґрунтуються на визначенні фізичних властивостей речовини;
Фізико-хімічні – ґрунтуються на визначенні певних фізичних властивостей речовин в процесі хімічних реакцій;
Хімічні – ґрунтуються на визначення хімічних властивостей досліджуваної речовини в процесі хімічних реакцій (основані на проведенні хімічних реакцій).
Класифікація методів аналізу:
а) за фізичним станом речовини, що аналізується:
"сухий аналіз" – визначення складу речовини у твердому стані (попередній аналіз, швидкий, не точний):
-
реакції забарвлення полум’я пальника:
Na+ – жовте полум’я;
К+ – фіолетове;
Са2+ – цегельно-червоне;
Ва2+ – жовто-зелене.
-
реакції утворення забарвлених перлів під час сплавлення невідомої речовини з боратом або фосфатом Натрію.
"мокрий аналіз" – аналіз у розчині, в основі – іонообмінні реакції (основний, повний аналіз):
-
крапельні реакції;
-
мікрокристалоскопічні реакції на склі (форму характерних кристалів спостерігають під мікроскопом);
б) за кількістю речовин, що беруть для аналізу:
макроаналіз – грам-метод: m>0,5 г, V>10 мл;
напівмікроаналіз – сантиграм-метод: 0,05 г<m<0,5 г; 1 мл<V<10 мл;
мікроаналіз – міліграм-метод: 10-6 г <m<10-3 г ; 10-3 мл<V<10-1 мл.
Крапельні реакції відносять до напівмікроаналізу.
Аналітичні реакції (характерні, якісні) – хімічні реакції, які супроводжуються зовнішніми змінами, а саме:
-
утворенням осаду характерної структури, кольору, розчинності;
-
зміною кольору розчину;
-
утворенням газу певного кольору, розчинності, характерних властивостей.
Вимоги до аналітичних реакцій: швидкість, простота виконання, специфічність, чутливість.
Специфічність: чим менша кількість іонів вступає до реакції з даним реактивом, тим більш специфічною є ця реакція.
Чутливість: чим менша кількість речовини може бути визначена за допомогою даного реактиву, тим реакція більш чутлива.
Умови проведення аналітичних реакцій. Проведення кожної аналітичної реакції вимагає виконання певних умов, а саме:
-
узяття до реакції певних концентрацій реагуючих речовин;
-
проведення реакції при певному значенні рН реакційної суміші;
-
проведення реакції при певній температурі.
Реактиви – речовини, за допомогою яких відкривають іони.
За ступенем чистоти розрізняють реактиви: технічні (техн.), чисті (ч.), хімічно чисті (хч.), чисті для аналізу (чда), вищих ступенів очищення.
За призначенням розрізняють реактиви:
-
специфічні – утворюють характерний осад або забарвлення тільки з певним іоном;
-
вибіркові (або селективні) – реагують з декількома іонами, які належать до різних груп;
-
групові – реагують (осаджують) з усіма іонами певної групи.
Систематичний аналіз – відкриття іонів відбувається в певній послідовності: спочатку груповим реактивом відокремлюють одну групу іонів від інших, а потім за допомогою специфічних реактивів ідентифікують окремі іони.
Дробний аналіз – в окремих порціях досліджуваного розчину за допомогою специфічних реактивів відкривають окремі іони.
Аналітична класифікація катіонів і аніонів
Класифікація катіонів
Аналітична група катіонів – така група, катіони якої при взаємодії з певним реактивом і за певних умов вступають у характерні аналітичні реакції. За допомогою цих реакцій можна відокремити одну групу катіонів від іншої.
Кислотно-лужний метод аналізу катіонів заснований на різній розчинності у воді хлоридів і сульфатів та на різній розчинності гідроксидів у воді, надлишку лугу та водному розчині амоніаку.
В основу поділу катіонів на групи покладено їх реакції з мінеральними кислотами (сульфатною та хлоридною) і реакції з їдкими лугами й амоніаком.
Відповідно до цього катіони поділяються на шість аналітичних груп.
|
№ групи |
Назва катіонів |
Груповий реактив |
Характер сполук з груповим реактивом |
|
І |
Na+, K+, NH4+ |
- |
- |
|
ІІ |
Ag+, Pb2+, Hg22+ |
HCl |
AgCl – білий сирнистий осад, розчиняється у NH4OH; PbCl2 – білий пластівчастий осад, розчиняється у гарячій воді; Hg2Cl2 – білий осад, від NH4ОН чорніє |
|
ІІІ
|
Ba2+, Ca2+ |
H2SO4 |
BaSO4 – білий дрібнокристалічний осад, не розчиняється у кислотах та лугах; CaSO4 – білий кристалічний осад, осаджується із концентрованого спиртового розчину |
|
IV
|
Al3+, Cr3+, Zn2+ |
NaOH
|
Al(OH)3 – білий аморфний осад; Cr(OH)3 – сіро-зелений аморфний осад; Zn(OH)2 – білий драглистий осад Всі осади розчиняються у розбавлених кислотах та надлишку групового реактиву, бо є амфотерними |
|
V |
Fe2+, Fe3+, Mg2+, Mn2+ |
NaOH, NH4OH |
Fe(OH)2 – білий→зелений→бурий осад; Fe(OH)3 – бурий драглистий осад; обидва розчиняються у кислотах; Mg(OH)2 – білий драглистий осад, розчиняється у надлишку солей NH4+ Mn(OH)2 – білий→бурий осад |
|
VI |
Cu2+, Hg2+ |
NH4OH |
[Cu(NH3)4](OH)2 – волошково-синій осад, розчиняється у надлишку NH4OH →фіолетовий розчин; HgNH2Cl – білий осад, розчиняється у надлишку NH4OH |
План характеристики катіонів певної групи
-
Номер групи.
-
Назва та символи катіонів.
-
Груповий реактив: назва, рівняння реакцій катіонів з груповим реактивом, характер осадів (структура, колір, розчинність).
-
Характеристика сполук катіонів (за допомогою таблиці розчинності).
-
Використання катіонів та їх сполук у медичній практиці та санітарно-гігієнічних дослідженнях, вплив катіонів та їх сполук на здоров’я людини та навколишнє середовище.
-
Хід аналізу суміші катіонів певної групи.
Класифікація аніонів
В основу поділу аніонів на аналітичні групи покладено різну розчинність у воді солей Барію та Аргентуму, які утворені цими аніонами.
|
№ групи |
Назва аніонів |
Груповий реактив |
|
І |
PO43-, CO32-, SO32-, SO42- |
BaCl2 |
|
ІІ |
S2-, Cl-, Br-, I- |
AgNO3 |
|
ІІІ |
NO2-, NO3- |
- |
Характеристика аніонів певної групи надається за планом характеристики катіонів певної групи.
Питання самоконтролю
1. За яким механізмом відбувається реакція комплексоутворення?
2. Як дисоціюють комплексні солі?
3. Які методи якісного аналізу Ви знаєте?
4. Класифікуйте методи якісного аналізу.
5. Які ознаки характерні для аналітичних реакцій?
6. Назвіть умови перебігу аналітичних реакцій.
7. Класифікуйте реактиви за їх призначенням.
8. Дайте визначення систематичному та дробному аналізам.
9. На чому базується кислотно-лужна класифікація катіонів?
10. На чому базується класифікації аніонів?
Тренувальні вправи
-
Визначити K, L, координаційне число, зовнішню та внутрішню координаційні сфери, заряд комплексного іона у комплексних солях: K2[HgI4]; [Ag(NH3)2]Cl; Na[Co(NH3)2(NO2)4].
-
Як дисоціює: Na3[Cо(NО2)6]?
-
Визначити заряд комплексоутворювача, якщо [Cu(NH3)4]2+.
Тема № 3
Добуток розчинності. Водневий показник.
Гідроліз солей.
1. Хімічна рівновага, рівновага в гомогенних системах:
-
швидкість хімічної реакції;
-
закон діючих мас;
-
оборотні і необоротні хімічні реакції;
-
хімічна рівновага;
-
зміщення (зсув) хімічної рівноваги; принцип Ле-Шател’є.
2. Рівновага в гетерогенних системах:
-
добуток розчинності важкорозчинних речовин;
-
умови утворення і розчинення осадів.
3. Константа дисоціації. Йонний добуток води. Водневий показник.
4. Гідроліз солей. Поняття про буферні розчини.
Література:
Д.Д.Луцевич, А.С.Мороз та ін. "Аналітична хімія", К, "Здоров’я", 2003,
с.9-46.
Полеес М.Э., Душечкина И.Н. "Аналитическая химия", М, "Медицина", 1987, с.11-20, 70-101.
Хімічна рівновага, рівновага в гомогенних системах
Швидкість хімічної реакції
Швидкість хімічної реакції вимірюється зміною концентрації речовин, що реагують, за одиницю часу. Одиницями швидкості реакції є: [кмоль/(м3·с)], [моль/(дм3·с)]. Швидкість хімічної реакції залежить від температури, рН, наявності каталізатора, інгібітору, природи реагуючих речовин, концентрацій вихідних речовин (реагентів).
Швидкість та механізм перебігу хімічних реакцій вивчає хімічна кінетика.
Закон діючих мас
Хімічні реакції можуть відбуватися в однорідних (гомогенних) та неоднорідних (гетерогенних) системах.
Гомогенна система – складається з однієї фази (з двох і більше газів або рідин).
Гетерогенна система – складається з речовин, які перебувають у різних агрегатних станах (газ і рідина, кристали й рідина).
Швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, узятих у ступенях, які дорівнюють стехіометричним коефіцієнтам у рівнянні реакції.
Закон застосовується для реакцій, які відбуваються в гомогенних системах (розчинах, газових сумішах). Якщо, крім газу або рідини, реагуватиме й тверда речовина, то швидкість реакції (при даному ступені дроблення твердої речовини) змінюватиметься тільки залежно від концентрації газоподібних та розчинених речовин. Закон експериментально встановлено у 1867 році К.Гульбергом та П.Вааге.
