Otvety_na_ekzamenatsionnye_voprosy
.docxОтветы на экзаменационные вопросы.
|
№ 1. Современная формулировка периодического закона заключается в том, что в свойства химических элементов, а также формы и свойства их соединений, находятся в периодической зависимости от зарядов атомных ядер. Именно заряд ядра определяет электронное строение и все вытекающие из этого свойства атома. Все химические элементы делят на 4 электронных семейства: s-,р-,d- и f-элементы. s-элементы располагаются в начале каждого периода, их по 2 в каждом периоде. Это объясняется тем, что на s-орбитале может расположиться всего 2 электрона. Для s-элементов возможны следующие степени окисления: +1 (для элементов первой группы главной подгруппы) и +2 (для элементов второй группы главной подгруппы), для водорода - +1 и -1. Главные подгруппы III, IV, V, VI и VII групп составляют р-элементы. На внешнем энергетическом уровне этих элементов находится от 3-х до 7-ми электронов. Так как в периодах с увеличением зарядов ядер атомов растет число электронов на внешнем уровне от 1-го до 7-ми, то растет и высшая степень окисления элементов в соединениях от +1 до +7. К s- и р-элементам относятся инертные элементы (элементы VIII группы главной подгруппы), но у этих элементов внешние слои завершены, и они не вступают в химические реакции и соединений не образуют. Окислительные свойства элементов в периодах усиливаются, а восстановительные – ослабевают. Это связано с увеличением числа валентных электронов и уменьшением атомного радиуса. В подгруппах с увеличением порядкового номера элемента увеличиваются атомные радиусы, поэтому окислительные свойства ослабевают, а восстановительные – усиливаются. |
||||||||||||||||||||||
|
№ 2. Формулы высших оксидов элементов III периода: Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7 оксид оксид оксид оксид оксид оксид оксид натрия магния алюминия кремния фосфора серы хлора (IV) (V) (VI) (VII) Формулы высших гидроксидов NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO5 H2SO4 HClO4 гидроксид гидроксид гидроксид гидроксид гидроксид гидроксид идроксид натрия магния алюминия кремния фосфора серы хлора (IV) (V) (VI) (VII) кремниевая фосфорная серная хлорная кислота кислота кислота кислота
кислотный характер оксидов и гидроксидов усиливается основный характер оксидов и гидроксидов ослабевает Это связано с увеличением степени окисления элементов, образующих оксиды и гидроксиды, и уменьшением их радиусов. Схема электронного строения атома Cl в невозбужденном и возбужденном состояниях Cl 1s22s22p63s23p5 Cl 1s22s22p63s23p43d1 Cl 1s22s22p63s23p3 3d2
Cl
1s22s22p63s13p3
3d3
Высшая степень окисления хлора +7. Это связано с тем, что на внешнем уровне атома хлора находится 7 электронов: 2 спаренных s-электрона, 4 спаренных р-электрона и один неспаренный р-электрон. Так как в атоме хлора имеется d-подуровень, незаполненный электронами, то существует возможность для распаривания всех спаренных электронов. |
||||||||||||||||||||||
|
№3. Порядок заполнения электронами атомных орбиталей подчиняется трём основным принципам: Принцип Паули: в атоме не может быть двух электронов, у которых все 4 квантовых числа одинаковые. Принцип наименьшей энергии: сначала электронами заполняются те подуровни, которые обладают уменьшим запасом энергии. Согласно этому принципу формирование электронных оболочек атомов происходит в такой последовательности: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s … Правило Хунда: заполнение электронами атомных орбиталей одного подуровня происходит таким образом, Чтобы их суммарное спиновое число было минимальным. Схема электронного строения атома ванадия схема электронного строения атома мышьяка
V 1s22s22p63s23p63d3 4s2 As 1s22s22p63s23p63d10 4s24p3 Ванадий – элементы побочной подгруппы Мышьяк – элемент главной подгруппы V группы, d - элемент V группы, p – элемент Наиболее выраженными металлическими свойствами обладает ванадий, он относится к металлам, а мышьяк к неметаллам У обоих атомов есть возможность для перехода в возбужденное состояние. Поэтому они имеют несколько возможных степеней окисления. Они не являются электронными аналогами, но их высшая степень окисления равна +5 (в атоме мышьяка на внешнем уровне 5 валентных электронов, для ванадия валентными являются не только 2 электрона на внешнем уровне, но и добавочные d-электроны предпоследнего третьего уровня.) Другой возможной степенью окисления у обоих элементов может быть +3. В отличие от ванадия, мышьяк может иметь и отрицательную степень окисления в соединениях с металлами. Низшая степень окисления мышьяка -3 (ему не хватает 3 электронов до завершения внешнего слоя). |
||||||||||||||||||||||
|
№ 4. Олово и свинец – элементы IV главной подгруппы ПСХЭ Д.И. Менделеева. На внешнем уровне обоих атомов содержится по 4 электрона: 2 спаренных s-электрона и 2 неспаренных р-электрона. Их возможные степени окисления +2 и +4. Оксиды SnO и PbO –амфотерные оксиды с преобладанием основных свойств, причем, основные свойства PbO выражены сильнее, чем у SnO. Оксиды SnO2 и PbO2 обладают кислотными свойствами, причем кислотные свойства SnO2 выражены сильнее, чем у PbO2. Вывод: с увеличением радиуса атома основные свойства оксидов элементов одной подгруппы усиливаются, а кислотные ослабевают. Основный характер SnO и PbO можно подтвердить уравнениями реакций: SnO + 2HCl = SnCl2 + 2 H2O в сокращенном ионном виде: SnO + 2H+ = Sn 2+ + 2H2O PbO + 2 HCl = PbCl2 + 2 H2O в сокращенном ионном виде: PbO + 2H+ = Pb 2+ + 2H2O PbO2 - сильный окислитель. При растирании PbO2 с серой, последняя воспламеняется: PbO2 + S = PbS + SO2 |
||||||||||||||||||||||
|
№ 5. Энергия ионизации атома – это та энергия, которую необходимо затратить для отрыва электрона от атома. Энергия ионизации обуславливает химические свойства элемента. Её величина характеризует прочность связи электрона с ядром и служит м е р о й м е т а л л и ч н о с т и элемента. Чем меньше значение энергии ионизации, тем активнее металл. Энергия, которая выделяется при присоединении одного электрона к атому, называется сродством к электрону. Наибольшим сродством к электрону обладают галогены (им до завершения внешнего слоя не хватает 1 электрона). Согласно Полингу электроотрицательность (ЭО) – способность атомов присоединять к себе электроны от других атомов или ионов. ЭО зависит от электронного строения атомов: чем меньше атомный радиус атома и чем больше электронов на внешнем уровне, тем более электроотрицательным будет элемент. Самым электроотрицательным элементом является фтор F. H2S, H2Se и H2Te – халькогеноводороды (летучие водородные соединения халькогенов). Все они обладают кислотными свойствами, при растворении в воде они диссоциируют на ионы водорода и анионы кислотных остатков. Например: H2S H+ + HS-. Все эти кислоты слабые и летучие. От сероводорода (H2S) к теллуроводороду (H2Te) кислотный характер усиливается, так как увеличивается радиус атома халькогена и степень диссоциации возрастает. В таком же порядке возрастают и восстановительные свойства. Сульфид-ион S-2 прочнее удерживает электроны, чем теллурид-ион Te-2 (у первого радиус меньше). |
||||||||||||||||||||||
|
№ 6. Электроотрицательность (ЭО) – способность атомов присоединять к себе электроны от других атомов или ионов. ЭО зависит от электронного строения атомов: чем меньше атомный радиус атома и чем больше электронов на внешнем уровне, тем более электроотрицательным будет элемент. Самым электроотрицательным элементом является фтор F. В периодах слева направо ЭО увеличивается, так уменьшается атомный радиус элементов и увеличивается число электронов на внешнем слое. В подгруппах ЭО наоборот уменьшается, так как растут атомные радиусы элементов. Чем больше разница в значениях ЭО, тем полярнее связь между атомами, поэтому самой полярной молекулой среди HCl, HBr и HI является молекула хлороводорода HCl, а наименее полярной – молекула HI. |
||||||||||||||||||||||
|
№ 7. Связь за счет общих электронных пар называется ковалентной связью (КС). Она обладает рядом свойств: длиной, энергией, поляризуемостью, насыщаемостью, направленностью. Направленность КС обуславливает пространственное строение молекул и зависит от типа гибридизации атомных орбиталей. Под насыщаемостью понимают способность атомов образовывать определенное число химических связей, что валентных возможностей атомов. В молекуле метана СН4 все связи атома углерода насыщены до предела: у атома углерода на внешнем уровне 4 электрона. При образовании связи с атомами водорода все 4 электроны атома углерода участвуют в образовании
общих электронных
пар с атомами водорода. Атом
В в молекуле ВF3
находится в состоянии sp2
- гибридизации.
Здесь вместо исходных одной s- и двух р-орбиталей атома бора образуются три равноценные sр2-орбитали. Поэтому молекула ВF3 построена в форме правильного треугольника, в центре которого расположен атом бора, а в вершинах - атомы фтора. Все три связи В - F в молекуле ВF3 равноценны. Но не все валентные возможности атома бора использованы. Одна р-орбиталь атома бора выкантнаи может быть использована для образования ковалентной связи с другими атомами других молекул по донорно-акцепторному механизму, выступая в качестве акцептора.
|
||||||||||||||||||||||
|
№ 8. Химическая связь, которая возникает за счет общих электронных пар, называется ковалентной. Она обладает рядом свойств: длиной, энергией, поляризуемостью, насыщаемостью, направленностью. Длиной связи называется расстояние между ядрами атомов, соединенных ковалентной связью. Выражается в нм. Энергией связи называется та энергия, которую нужно затратить для разрыва ковалентной связи. Выражается в Дж/моль (кДж/моль). Направленность КС обуславливает пространственное строение молекул и зависит от типа гибридизации атомных орбиталей. Под насыщаемостью понимают способность атомов образовывать определенное число химических связей, что валентных возможностей атомов. Из четырёх фторидов: LiF, ВеF2, ВF3 CF4 больше всего приближается к ковалентной связь между углеродом и фтором в молекуле CF4 фторида углерода. В соединениях LiF, ВеF2 связь ионная. Эти соединения относятся к классу солей. Соли, а также кислоты и щелочи, относятся к электролитам. |
||||||||||||||||||||||
|
№ 9. Смешение электронных облаков и выравнивание их по форме и энергии называется гибридизацией. В результате гибридизации орбиталей происходит изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Существует несколько типов гибридизации электронных облаков. sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109028'.
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (метана CH4, аммиака NH3). sp2- Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 1200.
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется - связь. Три sp2- орбитали могут образовывать три - связи (BF3, AlCl3). Еще одна связь ( - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4). Молекулы, в которых осуществляется sp2- гибридизация, имеют плоскую геометрию. sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 1800.
Две sp- орбитали могут образовывать две - связи (BeH2, ZnCl2). Еще две - связи могут образоваться, если на двух p- орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2). Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
|
||||||||||||||||||||||
|
№ 10. Ковалентная связь может быть образована несколькими механизмами: обменным, донорно-акцепторным и дативным. В каждом случае образуются общие электронные пары между атомами. Донорно-акцепторный механизм заключается в том, что при образовании общей электронной пары один элемент отдаёт в общее пользование свою неподелённую электронную пару (донор), другой элемент предоставляет свободную атомную орбиталь для размещения этой электронной пары (акцептор). По донорно-акцепторному механизму образованы ион аммония NH4+, ион гидроксония Н3О+, многие комплексные соединения. В соединении Zn(NH3)4Cl2 (хлорид тетрааммин цинка) центральным ионом является ион цинка Zn+2, лигандами – полярные молекулы аммиака NH3. Связь между ионом цинка и лигандами образуется по донорно-акцепторному механизму: у иона цинка свободны атомные орбитали внешнего 4 уровня (акцептор), в молекуле аммиака у атома азота в наличии неподелённая электронная пара, и он выступает в качестве донора.
NH3 NH3 Zn +2 NH3 NH3 Cl2 Все комплексные соли при растворении в воде диссоциируют на внутреннюю и внешнюю сферы: Zn(NH3)4Cl2 Zn(NH3)4+2 + 2Cl- |
||||||||||||||||||||||
|
№ 11. В молекулах азота N2 и аммиака NH3 связь образуется за счет общих электронных пар, т.е. является ковалентной. В молекуле азота N2 связь ковалентная неполярная, так как образована атомами одного химического элемента с одинаковыми значениями электроотрицательности, а в молекуле аммиака NH3 связь ковалентная полярная, общие электронные пары смещены в сторону более электроотрицательно атома азота. Схема образования молекула азота :N· + ·N: ® :N:::N: Схема
образования молекулы аммиака :N·
+ 3 H·
|
||||||||||||||||||||||
|
№ 12. Упорядоченное расположение частиц в кристаллах называется кристаллической решеткой. Существует 4 типа кристаллических решеток: атомные, молекулярные, ионные и металлические. Если в узлах кристаллических решеток находятся атомы, то образуется атомная решетка. В таких решетках кристаллизуются алмаз, графит, кремнезем SiO2. Эти вещества очень прочные, нелетучие и тугоплавкие. Вещества, которые кристаллизуются в молекулярных решетках, наоборот, обладают легкоплавкостью и (или) летучестью. В молекулярных решетках кристаллизуются все газы (водород, кислород, углекислый газ), жидкости (вода) и твердые легкоплавкие вещества (сахар, парафин). В ионных решетках кристаллизуются вещества с ионной связью – соли, основания, основные оксиды. Прочность таких кристаллических решеток зависит от зарядов ионов и их радиусов: чем больше заряд иона, и чем меньше его радиус, тем прочнее ионная связь , а значит и кристаллическая решетка. В металлических решетках кристаллизуются все металлы. Особенность таких решеток в том, что в узл ах находятся не только атомы металлов, но в большинстве положительно-заряженные ионы металлов. Между узлами решетки свободно перемещаются валентные электроны всех атомов. Этим объясняются все общие физические свойства металлов: металлический блеск, тепло- и электропроводность, пластичность, ковкость.
Кристаллическая решетка SiO2 |
||||||||||||||||||||||
|
№ 13. Химическая связь между разноименно заряженными ионами за счет электростатического притяжения называется ионной. Ионы – заряженные частицы, которые образуются из атомов в результате отдачи или присоединения электронов. Атомы металлов при образовании ионной связи превращаются в положительно заряженные ионы ( отдают валентные электроны) - катионы, а атомы неметаллов присоединяют электроны и превращаются в отрицательно заряженные ионы (анионы). 1ē 2 ē Nao + Clo ® Na+ + Cl- ® Na+Cl- Mg0 + O0 Mg+2 O -2 Свойства ионной связи – длина и энергия. Длиной связи называется расстояние между ядрами ионов, соединенных ионной связью. Длина ионной связи определяется радиусами ионов. Измеряется в нм. Энергией связи называется та энергия, которую нужно затратить для разрыва ионной. Выражается в Дж/моль (кДж/моль). Ионной связь не обладает направленностью и насыщаемостью. Эти свойства присущи только ковалентной связи. Среди указанных фторидов NaF, CF4, SiF4,BF3 ионных характер в большей степени выражен во фториде натрия NaF. В этом случае мы видим самую большую разницу в значениях электроотрицательности элементов – у фтора ЭО равна 4,1, а у натрия 1,01. Во всех остальных случаях образуется ковалентная связь (разница в значениях ЭО меньше 1,7). |
||||||||||||||||||||||
|
№ 14. Валентность – это свойство атомов образовывать определенное число химических связей. Зависит от числа неспаренных электронов, наличия неподеленных электронных пар и наличием свободных атомных орбиталей. Степень окисления – условный заряд, вычисленный из предположения, что молекула состоит из ионов. В соединениях СН4 (метан), С2Н6 (этан), С2Н4 (этилен) валентность углерода равна IV, а степень окисления разная – в метане -4, в этане -3, в этилене -2. Валентность и степень окисления водорода соответственно равны I и +1. В молекулах метана и этана образуются одинарные -связи. В молекуле этилена между атомами углерода возникает двойная связь: одна из которых (сигма), а другая (пи).
|
||||||||||||||||||||||
|
№
15. Метод валентных
связей, или
локализованных пар электронов,
достаточно хорошо объясняет образование
и структуру очень многих молекул.
Метод валентных схем (В.с.м.),является
методом приближенного решения
электронного уравнения Шрёдингера
для многоэлектронных молекулярных
систем. Основан на представлениях о
двухцентровых хим. связях между атомами
в молекуле, образуемых двумя электронами.
Эти представления являются обобщением
на многоатомные молекулы приближения
Гайтлера - Лондона, позволившего
впервые с помощью квантовомеханич-еских
методов объяснить хим. связь в молекуле
Н2.
Основная физическая идея В. с. м.
состоит в том, что волновая функция
молекулы выражается через волновые
функции составляющих ее атомов.
Образование хим. связи рассматривается
как результат спаривания спинов
свободных электронов атомов. Тем самым
В. с. м. дает обоснование одному из
основных положений теории валентности:
валентность нейтрального атома равна
числу свободных электронов в его
валентной оболочке. Каждому валентному
штриху, соединяющему атомы А и В в
структурной формуле молекулы, отвечает
двухэлектронная функция валентной
связи ХАВ(1,2),
которая представляется в виде
произведения двух волновых функций:
пространственной Ф(1,2), симметричной
относительно перестановки координат
электронов, и спиновой Энергия
молекулы
где
ЕH-энергия
атома Н,
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о. В молекуле CH4 имеется 4 связи C—H. Атомы углерода находятся в состоянии sp3- гибридизации. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
|
||||||||||||||||||||||
|
№ 16. Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи. Натрий металлический кристаллизуется в металлической решетки. В узлах находятся в основном положительно заряженные ионы натрия Na+ . Между узлами свободно перемещаются валентные электроны всех атомов. Этим объясняются все общие физические свойства металлов: металлический блеск, тепло- и электропроводность, пластичность, ковкость.
Кристаллическая
решетка хлорида натрия (поваренной
соли) ионная. В узлах кристаллической
решетки хлорида натрия находятся
положительно заряженные ионы натрия
Na+
и отрицательно заряженные ионы хлора
Cl-.
|
||||||||||||||||||||||
|
№ 17. Мерой полярности связи и молекулы является дипольный момент р определяется произведением: р = l, где - эффективный заряд, l – длина диполя ( не смешивать с длиной связи). Для отдельной молекулы длина диполя всегда меньше длины связи из-за несовпадения центров тяжести зарядов с центрами ядер атомов. Электрический момент диполя – векторная величина. Направление его условно принимают от положительного заряда к отрицательному – в сторону смещения связующего электронного облака. Электрические моменты диполя экспериментально определены для различных связей и большого числа молекул. Электрический дипольный момент, физическая величина, характеризующая электрические свойства системы заряженных частиц. Д. м. системы из N заряженных частиц равен
|
||||||||||||||||||||||
|
№ 18. Хотя молекулы в целом нейтральны, между ними проявляется межмолекулярное взаимодействие. Как и силы связи между атомами, межмолекулярные силы имеют электрическую природу. Они обусловлены полярностью и поляризуемостью молекул. Различают 3 типа межмолекулярного взаимодействия. 1. Ориентационное взаимодействие двух полярных молекул. При сближении полярные молекулы ориентируются относительно друг друга противоположно заряженными концами диполей. Чем более полярными являются молекулы, тем прочнее между ними взаимодействие. С повышением температуры ориентационное взаимодействие ослабляется за счет усиления теплового движения молекул. 2. Индукционное взаимодействие между полярной и неполярной молекулой: первая деформирует электронное облако второй. В результате у неполярной молекулы возникает временный электрический момент диполя, а затем обе молекулы взаимодействуют как диполи. Этот вид взаимодействия не зависит от температуры, а зависит от напряженности электрического поля полярной молекулы. 3. Дисперсионное взаимодействие между двумя неполярными молекулами. Вследствие движения электронов внутри молекулы в одной из них происходит небольшая мгновенная деформация электронного облака, создающая асимметрию в распределении зарядов. Возникает также диполь, который существует очень короткое время. Но тем самым устанавливается связь между молекулами. Все названные 3 типа межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми силами (в честь голландского физика Ван-дер-Ваальса). Все эти силы невелики и очень быстро уменьшаются при увеличении расстояния между молекулами. Особое значение имеет водородная связь. Это физико-химическая связь, которая возникает между протонизированным атомом водорода одной молекулы и атомом сильно электроотрицательным элементом (F, O, N) другой молекулы. Она бывает межмолекулярной и внутримолекулярной (в белках). На образование водородной связи оказывают влияние не только силы электростатического взаимодействия между атомами водорода и атомами фтора, кислорода или азота, но донорно-акцепторное взаимодействие. Для этой связи характерны направленность в пространстве и насыщаемость. Водородная связь намного слабее ковалентной, но она оказывает сильное влияние на свойства многих веществ: благодаря ей вода и фтороводород при обычных условиях - не газы, а жидкости.
Вода уксусная кислота Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединениях. |
||||||||||||||||||||||
|
№ 19. Термодинамическая система - совокупность физических тел, которые могут: - энергетически взаимодействовать между собой и с другими телами; а также - обмениваться с ними веществом. Термодинамическая система: - состоит из большого количества частиц; и - подчиняется в своем поведении статистическим закономерностям, проявляющимся на всей совокупности частиц. Для термодинамических систем выполняются законы термодинамики. Термодинамические функции (термодинамические потенциалы) — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе. Выделяют следующие термодинамические потенциалы: 1) внутренняя энергия; 2) энтропия; 3) энтальпия; 4) свободная энергия Гельмгольца; 5) потенциал Гиббса; 6) большой термодинамический потенциал Термодинамическими величинами называют физические величины, применяемые при описании состояний и процессов в термодинамических системах. Термодинамика рассматривает эти величины как некоторые макроскопические параметры и функции, присущие системе, но не связанные с её микроскопическим устройством. Вопросы микроскопического устройства изучает статистическая физика. Функции состояния зависят только от текущего состояния системы и не зависят от пути, по которому система пришла в это состояние. Функции состояния в термодинамике включают: 1) температуру; 2) давление; 3) объём; 4) энтропию; 5) термодинамические потенциалы. Функции процесса зависят не только от текущего состояния системы, но также и от пути, по которому система пришла в данное состояние. Функции процесса в термодинамике включают: 1) количество теплоты; 2)термодинамическую работу. Эти величины, однако, могут быть «превращены» в функции состояния с помощью интегрирующего множителя:
PdV = δA, где P (давление) и V (объём) — функции состояния. Первый закон термодинамики Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему. Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Следствия из закона Гесса
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т.н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры. Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю. |
||||||||||||||||||||||
|
№ 20. Во многих случаях самопроизвольные процессы (процессы, происходящие без подвода энергии от внешнего источника) в природе протекают при наличии разности потенциалов, например, разность электрических потенциалов, обусловливает перенос заряда, а разность гравитационных потенциалов – падение тела. Эти процессы заканчиваются при достижении минимума потенциала. Движущей силой химических процессов, протекающих при постоянных давлении и температуре является изобарно-изотермический потенциал, называемый в настоящее время энергией Гиббса и обозначаемый G. Изменение энергии Гиббса в химическом процессе определяется соотношением ΔG = ΔH –TΔS где ΔG – изменение энергии Гиббса химического процесса; ΔH – изменение энтальпии химического процесса; ΔS – изменение энтропии химического процесса; Т – температура в Кельвинах. Энергия Гиббса является критерием принципиальной возможности самопроизвольного протекания реакции. Если в ходе реакции энергия Гиббса уменьшается, то процесс может протекать в данных условиях самопроизвольно ΔG < 0. Процесс в данных условиях неосуществим, если ΔG > 0. Реакция является обратимой, т.е. может протекать и в прямом и в обратном направлении, если ΔG = 0 (термодинамическое условие химического равновесия). Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами. Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
Отсюда дифференциал свободной энергии равен:
Видно,
что это выражение является полным
дифференциалом относительно независимых
переменных T
и V.
Поэтому часто свободную энергию
Гельмгольца для равновесного состояния
выражают как функцию
Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так:
где
μ
— химический потенциал, а N
— число частиц в системе. При этом
свободная энергия Гельмгольца для
равновесного состояния записывается
как функция
|
||||||||||||||||||||||
|
№ 21. Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению СН4 (г) + СО2 (г) = 2СО (г) + 2Н2 (г); Н = + 247,37 кДж. При какой температуре начнется - эта реакция? ∆Sх.р. = 2·197,94 + 2·130,59 - 186,19 - 213,65 = 0,2572 кДж/моль·К T = ∆H/∆S = 247,37/0,2572 = 961,78 К Ответ:961,9 К.
|
||||||||||||||||||||||
|
№ 22. Стандартные условия — значения температуры и давления, при которых определяются (или к которым приводятся) значения различных количественных характеристик веществ, зависящих от давления и температуры (например, электродные потенциалы, скорости звука и т.д.). Для обеспечения единообразия представления характеристик в научной и справочной литературе ИЮПАК в 1982 установила следующие стандартные условия:
Реакция 2NO (г) + O2 (г) = 2NO2 (г) протекает мгновенно при обычных условиях. Почему это происходит. 2NO(г) + O2(г) = 2NO2(г) ∆Gх.р. = 2·51,84 - 2·86,69 = - 69,7 кДж При стандартных условиях в системе будет протекать прямая реакция, т.к. ∆Gх.р. < 0.
|
||||||||||||||||||||||
|
№ 23. 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж), ∆H = –1530,28 кДж –1530,28 = 6·(-285,84) - 4·∆H(NH3(г)) Ответ: ∆H(NH3(г)) = -46,19 кДж |
||||||||||||||||||||||
|
№ 24. Для ответа на поставленный вопрос следует вычислить прямой реакции. Значения соответствующих веществ даны в табл. 2. Зная, что G есть функция состояния и что G для простых веществ, находящихся в агрегатных состояниях, устойчивых при стандартных условиях, равны нулю, находим процесса: G = 2( -137,27) + 2(0) - (-50,79 - 394,38) = + 170,63 кДж. То, что > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 1 атм.
|
||||||||||||||||||||||
|
№ 25. Возможна ли реакция СН4 + 1/2О2 → СН3ОН при стандартных условиях? Для ответа на вопрос следует вычислить G0298 прямой реакции. Значения G0298 соответствующих веществ: G0298 (СН4) = - 50,79 кДж/моль; G0298 (СН3ОН) = - 163,3 кДж/моль. Зная, что G есть функция состояния и что G для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим G0298 процесса: G0298 = -163,3) - (-50,79 - 0) = - 112,51 кДж. То что G0298<0, указывает на возможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 1,013105 Па (760 мм рт. ст. = 1 атм). |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
№ 27. Скорость химической реакции (v) характеризуется изменением концентрации реагирующих веществ (моль/л или моль/см3) в единицу времени (сек., мин., ч.). Для гомогенной (однородной) системы скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образовавшихся в результате реакции за единицу времени в единице объема системы. Для гетерогенной системы скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образовавшихся в результате реакции за единицу времени на единице поверхности раздела фаз. Факторы, влияющие на скорость химической реакции 1) Природа реагирующих веществ (характер связи в молекулах реагентов); 2) Концентрация реагентов; 3) Температура; 4) Катализатор; 5) Давление (для газов); 6) Излучение (ИК-, УФ-, рентгеновское, радиоактивное и др.); 7) Площадь поверхности раздела фаз (для гетерогенных реакций). Влияние концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции, протекающей в однородной среде, пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
Например, для
обратимой гомогенной реакции,
выражающейся уравнением aA +
bB ↔ cC + dD, в соответствии
с законом действия масс, можно записать
выражение скорости прямой и обратной
реакций:
где k1 и k2 – константы скоростей прямой и обратной реакций. Физический смысл константы скорости заключается в том, что она показывает численное значение скорости химической реакции, с которой реагируют вещества при их концентрации (или произведении концентраций), равной единице. Константа скорости реакции зависит от природы реагентов, температуры, наличия катализатора, но не зависит от концентрации реагентов. Зависимость скорости от температуры определяется правилом Вант-Гоффа: При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза. При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:
(где Vt2 и Vt1 - скорости реакции при температурах t2 и t1 соответственно; - температурный коэффициент данной реакции). Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса: k = A • e –Ea/RT где A - постоянная, зависящая от природы реагирующих веществ; R - универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л • атм/(моль • К)]; Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению. |
||||||||||||||||||||||
|
№ 28. Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций. Для реакции mA + nB = pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n) К1 и К2 - константы скорости прямой и обратной реакции A и B - равновесные концентрации исходных веществ C и D - равновесные концентрации продуктов реакции m, n, p, d – коэффициенты в уравнении реакции Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции. Способы смещения равновесия. Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие.
ПОТЕНЦИАЛ ТЕРМОДИНАМИЧЕСКИЙ — термодинамическая функция состояния, имеющая размерность энергии и являющаяся в определенных условиях критерием равновесности и направления процесса в системе. Возможные неравновесные процессы в данных условиях сопровождаются уменьшением П. т.; состояние равновесия характеризуется минимумом П. т. системы. Наибольшее практическое значение имеют изобарно-изотермический и изохорно-изотермический П. т. Первый потенциал, или Z (синоним: изобарный потенциал, потенциал Гиббса, энтальпия свободная), равен энтальпии — H, уменьшенной на величину произведения энтропии — S на абс. температуру — Т. Изобарно-изотермический потенциал является критерием равновесности и направленности процессов при постоянных температуре и давлении. Приращение изобарно-изотермического потенциала Z в этих условиях для равновесных процессов равно 0, для неравновесных — < 0. Приращение изобарно-изотермического потенциала ΔZ при реакции (и тесно связанную с ним константу равновесия) можно вычислить, если известны термические константы (стандартная энтальпия образования и энтропия) всех участвующих в реакции веществ. Критерием равновесности и направленности процессов, протекающих при постоянных температуре и объме, является изохорно-изотермический потенциал — F (синоним: изохорный потенциал, свободная энергия), равный внутренней энергии — U, уменьшенной на величину произведения энтропии —S на абсолютную температуру. |
||||||||||||||||||||||
|
№ 29. Для уравнения гомогенной реакции 2SO2 + O2 = 2SO3 выражение константы равновесия выглядит так К = SO3 2 / SO2 2O2 . 1 = К1 ·С2 (SO2)· С (O2) 2 = К1 ·4С(SO2) 2 ·4 С (O2) = К1 ·16 С2 (SO2)· 4С (O2) = К1 ·64 С2 (SO2)· С (O2) Т.е., при увеличении давления в газовой смеси скорость реакции образования серного ангидрида увеличится в 64 раза. |
||||||||||||||||||||||
|
№ 30. Для реакции 2NO + O2 = 2NO2 константа равновесия равна К = NO2 2 / NO 2O2 . Так как обратная реакция идет с увеличением объема, то для увеличения выхода NO, т.е. для смещения равновесия в сторону образования исходных веществ, надо понизить давление (согласно принципу Ле Шателье). Концентрацию исходных веществ (NO и O2 ) также надо понижать, и повышать концентрацию продукта реакции NO2. |
||||||||||||||||||||||
|
№ 31. По уравнению реакции CO + Cl2 = COCl2 видно, что количественные отношения газов в реакции 1: 1 : 1, т.е., если в ходе реакции образовалось 0,45 моль COCl2 , значит в реакцию вступили по 0,45 моль СО и Cl2. Каждого из исходных веществ осталось в момент равновесия по (2 – 0,45) моль = 1,55 моль. Тогда константа равновесия равна К = 0,45/1,55 · 1,55 = 0,1875 |
||||||||||||||||||||||
|
№ 32. N2 + О2 = 2NО [N2] = 0,049 - 0,005/2 = 0,0465 моль/л [O2] = 0,01 - 0,005/2 = 0,0075 моль/л |
||||||||||||||||||||||
|
№ 33. Для реакции N2 + 3H2 = 2NH3 H 298 = - 92,4 кДж скорость реакции рассчитывается по уравнению 1 = К1 ·С (N2)· С3 (H2). При увеличении давления в 3 раза концентрации обоих газов увеличится в 3 раза, тогда 2 = К1 ·3С (N2)· 3С (H2) 3 = 27 К1 ·С (N2)· С3 (H2), т.е. скорость реакции синтеза аммиак увеличится в 27 раз. Для смещения равновесия этой реакции в сторону продуктов реакции (вправо) надо: 1) постоянно добавлять исходные вещества азот и водород в реакционную смесь, а продукт реакции аммиак постоянно выводить из сферы взаимодействия; 2) т.к. реакция идет с уменьшением объема надо повысить давление; 3) т.к. прямая реакция экзотермическая (идет с выделением тепла), надо понизить температуру до оптимального значения и не допускать её превышения.
|
||||||||||||||||||||||
|
№ 34. При повышении температуры равновесие реакции 2NO + O2 = 2NO2 H 0 (реакция идет с поглощением тепла – эндотермическая), равновесие смещается вправо в сторону образования продуктов реакции. При повышении давления равновесие этой реакции также будет смещать вправо, т. к. прямая реакция идет с уменьшением объема. При повышении температуры равновесие реакции 2SO2 + O2 = 2SO3 H 0 (реакция идет с выделением тепла – экзотермическая), равновесие смещается влево в сторону образования исходных веществ. При повышении давления равновесие этой реакции будет смещать вправо, т. к. прямая реакция идет с уменьшением объема. |
||||||||||||||||||||||
|
|
||||||||||||||||||||||
|
№ 35. Реакция синтеза аммиака идет с уменьшением объёма N2 + 3H2 = 2NH3 (1), поэтому понижение давления сместит равновесие в сторону образования исходных веществ (они занимают больший объём) согласно принципу Ле Шателье Реакция окисления азота N2 + O2 = 2NO (2) идет без изменения объёма, поэтому изменение давления не повлияет на состояние равновесия. Для реакции (1) уменьшение давления в 2 раза приведет к уменьшению концентрации газов в 2 раза. Тогда: 1пр = k CN2 CH23 , а 2пр = k 1/2CN2 1/2CH2 3 = 1/16 k CN2 CH23 1обр = k1 CNН32 , а 2обр = k1 1/2CNН3 2 = 1/4 k1 CNН32 т.е., при уменьшении давления в 2 раза скорость прямой реакции (1) уменьшится в 16 раз, а скорость обратной уменьшится в 4 раза. Для реакции (1) константа равновесия: К = NH3 2/ N2 H23 Для реакции (2) константа равновесия: К = NО 2/ N2 О2
|
||||||||||||||||||||||
|
№ 36. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы: vпрК1 [СО][Н2О]; vобр = К2[СО2][Н2];
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ: [СО2]р = [Н2]р = х моль/л; [СО]р = (3 – х) моль/л; [Н2О]р = (2 – х) моль/л. Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
Таким образом, искомые равновесные концентрации: [СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л; [СО]р = 3 – 1,2 = 1,8 моль/л; [Н2О]р = 2 – 1,2 = 0,8 моль/л. |
||||||||||||||||||||||
|
№ 39. Реакция идет согласно уравнению: А2 (г) + В2 (г) 2АВ (г). Если в системе увеличить давление, то концентрации газов увеличатся в 2 раза. Тогда: 1пр = k CА CВ , а 2пр = k 2CА 2CВ = 4k CА CВ, т.е скорость прямой реакции увеличится в 4 раза 1обр= k CАВ2 , а 2обр = k 2CАВ 2 = 4k CАВ Скорость обратной реакции также возрастет в 4 раза. При увеличении температуры на 500 С скорость прямой реакции возрастет в 32 раза, а скорость обратной – в 128 раз: 2пр/1пр = 25 = 32 2обр/1обр = 35 = 128 Равновесие будет смещено в сторону обратной реакции. |
||||||||||||||||||||||
|
№ 40. Характеристика растворов. Растворами называются гомогенные системы переменного состава, в которых растворенное вещество находится в виде атомов, ионов или молекул, равномерно окруженных атомами, ионами или молекулами растворителя. Любой раствор состоит по меньшей мере из двух веществ, одно из которых считается растворителем, а другое - растворенным веществом. Растворителем считается компонент, агрегатное состояние которого такое же, как и агрегатное состояние раствора. Деление это довольно условно. В этом случае растворителем считается компонент, находящийся в растворе в большем количестве. Состав растворов может меняться в довольно широких пределах, в этом растворы сходны с механическими смесями. По другим признакам, таким как однородность, наличие теплового эффекта и окраски растворы сходны с химическими соединениями. Растворы могут существовать в газообразном, жидком или твердом агрегатном состоянии. Воздух, например, можно рассматривать как раствор кислорода и других газов в азоте; морская вода - это водный раствор различных солей в воде. Металлические сплавы относятся к твердым растворам одних металлов в других. Растворение веществ является следствием взаимодействия частиц растворяемого вещества и растворителя. В начальный момент времени растворение идет с большой скоростью, однако по мере увеличения количества растворенного вещества возрастает скорость обратного процесса - кристаллизации. Кристаллизацией называется выделение вещества из раствора и его осаждение. В какой-то момент скорости растворения и осаждения сравняются и наступит состояние динамического равновесия. Раствор, в котором вещество при данной температуре уже больше не растворяется, или иначе, раствор, находящийся в равновесии с растворяемым веществом, называется насыщенным. Для большинства твердых веществ растворимость в воде увеличивается с повышением температуры. Если раствор, насыщенный при нагревании, осторожно охладить так, чтобы не выделялись кристаллы, то образуется пересыщенный раствор. Пересыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор крайне нестабилен и при изменении условий (энергичное встряхивание или внесение активных центров кристаллизации - кристалликов соли, пылинок) образуется насыщенный раствор и кристаллы соли. Раствор, содержащий меньше растворенного вещества, чем насыщенный, называется ненасыщенным раствором. В создании современной физико-химической теории растворов большую роль сыграли работы русских ученых Д.И. Менделеева, И.А. Каблукова, Д.П. Коновалова и др. В конце 19 в. все растворы считались физическими смесями веществ, в которых отсутствуют взаимодействия между растворенным веществом и растворителем. Химические явления при растворении были отмечены Д.И. Менделеевым. Взаимодействие молекул растворителя с растворенным веществом называется сольватацией, а образующиеся соединения – сольватами. Если растворителем является вода, то процесс называется гидратацией, а образующиеся соединения – гидратами. Образованием гидратов можно объяснить выделение теплоты при растворении. Образованием гидратов можно объяснить скачкообразное изменение свойств растворов при непрерывном изменении содержания растворенного вещества, что соответствует изменению состава продукта взаимодействия растворителя с растворенным веществом при увеличении содержания вещества в растворе. |
||||||||||||||||||||||
|
|
||||||||||||||||||||||
|
№ 41. Понятие «растворимость» имеет качественный смысл. В качественном смысле растворимостью вещества называется его способность образовывать однородную систему с другим веществом, выполняющим функцию растворителя. Эта способность определяется характером взаимодействия между молекулами растворитель – растворитель, растворенное вещество – растворенное вещество, растворитель – растворенное вещество. Наибольшая взаимная растворимость достигается тогда, когда все эти силы имеют подобный характер. Зависимость растворимости твердых тел от температуры выражают в виде кривых (таблицы растворимости). Некоторые вещества при повышении температуры резко повышают растворимость, у других она падает. Растворимость газов падает. Неполярные или малополярные соединения хорошо растворимы в неполярных или малополярных растворителях и менее растворимы в высокополярных растворителях.. Так оксид углерода СО – малополярное соединение (дипольный момент 0,4×10-30Кл×м) – хорошо растворим в бензоле, молекулы которого неполярны, и ограниченно растворим в воде – соединении с сильно выраженным дипольным характером (дипольный момент 6,11×10-30Кл×м). Вода является хорошим растворителем полярных соединений, например аммиака или этилового спирта, не только потому, что их молекулы обладают значительной полярностью (соответственно 4,94×10-30Кл×м и 5,66×10-30Кл×м), но и потому, что при этом сохраняется характер связей, существовавших в исходных компонентах. Вместо водородных связей между молекулами каждого компонента – воды, аммиака и спирта возникают подобные вязи между растворителем и растворенным веществом. Растворимость газов в жидкостях определяется не только природой компонентов, но и изменяется в широких пределах в зависимости от давления и температуры. С увеличением давления растворимость газов в жидкостях увеличивается. Эта закономерность выражается законом Генри: рi = Кi Хi где Хi – молярная доля i –го газа в растворе; рi – парциальное давление газа над раствором; Кi – постоянная Генри для i –го компонента. Закон Генри не выполняется, если растворение газа в жидкости сопровождается образованием новых химических веществ. Закон распределения: если в системе, состоящей из 2-ух несмешиваемых растворителей ввести 3-ее вещество, которое способно раствориться в обоих растворителях, то оно распределится м/у этими растворителями, т.о. чтобы отношение его концентрации в этих растворителях при постоянной температуре оставалось величиной постоянной независящей от количества введённого 3 -го компонента. |
||||||||||||||||||||||
|
№ 42. Растворы, в которых данное вещество при данной температуре больше не растворяется, называются насыщенными. Содержание растворенного вещества в растворе зависит от его растворимости. Такой раствор может концентрированным, а может быть и разбавленным. Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные. К безразмерным концентрациям (долям) относятся следующие концентрации:
где m (B) и m (A) – масса растворенного вещества B и масса растворителя A.
Сумма мольных
долей k
компонентов раствора χi
равна единице
К размерным концентрациям относятся следующие концентрации:
где μ (B) – молярная масса B, V – объем раствора.
где nЭ (B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
Дано: m(H2O) = 50 г Решение m(HNO3) = 50 г mр-ра(HNO3) = m(H2O) + m(HNO3) = 100 г р-ра (HNO3) = 1,52 г/см3 (HNO3) = 50 г/ 100 г = 0,5 или 50 % (массовая доля) Найти: Vр-ра (HNO3) = mр-ра(HNO3)/ р-ра (HNO3) = 100 г : 1,52 г/мл = (HNO3) = ? 65,79 мл = 0,066 л C(HNO3) = ? n (HNO3) = 50 г : 63 г/моль = 0,79 моль Cm(HNO3) = ? С (HNO3) = 0,79 моль : 0,066 л = 12 моль/л (молярность) СH(HNO3) = ? Cm(HNO3) = 0,79 моль : 0,05 кг = 15,8 моль/кг (моляльность) T(HNO3) = ? СH(HNO3) = 50 г/ 63 г/моль 0,066 л = 12 моль/л (нормальность) T(HNO3) = 50 г : 66 мл = 0,75 г/мл (титр) |
||||||||||||||||||||||
|
№ 43. Дано: Решение р-ра (HNO3) = 1,246 г/мл Пусть объем раствора равен 1000 мл, тогда C(HNO3) = 8 моль/л mр-ра(HNO3) = 1000мл 1,246 г/мл = 1246 г (HNO3) = ? Т.к. количество вещества азотной кислоты 8 моль, то Cm(HNO3) = ? её масса m(HNO3) = 8 моль 63 /моль = 504 г СH(HNO3) = ? (HNO3) = 504 г : 1246 г = 0,4 или 40 % T(HNO3) = ? Так как азотная кислота одноосновная, то Cm(HNO3) = СH(HNO3) = 8моль/л Масса воды в растворе = 1246 г – 504 г = 742 г = 0, 742 кг Cm(HNO3) = 8 моль : 0,742 кг = 10,78 моль/кг T(HNO3) = 504 г : 1000 мл = 0,504 г/мл |
||||||||||||||||||||||
|
№ 44. Осмос - явление массопереноса растворителя через полупроницаемую мембрану из разбавленного раствора в раствор с более высокой концентрацией вещества. Таким образом, в результате осмоса - односторонней диффузии молекул воды в раствор, концентрация сахарозы в нëм уменьшается, а объëм раствора постепенно увеличивается и уровень жидкости в вертикальной трубке повышается. Создаëтся избыточное давление водяного столба (гидростатическое давление), измеряемое разностью уровней жидкости и противодействующее проникновению молекул воды в раствор. Осмос прекратится, когда наступит равновесие между растворителем и раствором, при этом гидростатическое давление станет равным осмотическому давлению, которое служит количественной характеристикой осмоса. Осмотическим называется давление, которое необходимо приложить к раствору, чтобы прекратить осмос, то есть задержать молекулы растворителя от их проникновения в раствор через полупроницаемую мембрану. Осмотического давления в растворе не существует, оно появляется только тогда, когда раствор отделëн от растворителя полупроницаемой перегородкой. Величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит ни от природы растворëнного вещества, ни от природы растворителя. Растворы с одинаковым значением осмотического давления называются изотоническими. Для разбавленных растворов неэлектролитов зависимость осмотического давления от концентрации и температуры раствора выражается уравнением Вант-Гоффа: π = СВRT, где π - осмотическое давление раствора, кПа; СВ - его молярная концентрация, моль/л; R - универсальная газовая постоянная, 8,314 Дж/(моль·К); Т - абсолютная температура раствора. Осмотическое давление 0,5 М раствора глюкозы при 250С (2980 К) рассчитаем по формуле nRT/V, где n количество вещества глюкозы; R – газовая постоянная; T –температура; V - объем раствора. Р осм = 0,5· 8,314 ·298/1000 = 1,238 Па |
||||||||||||||||||||||
|
№ 45.
Между
жидкостью и ее насыщенным паром
существует динамическое равновесие
жидкость↔ насыщенный пар, т.е. число
молекул жидкости, испаряющихся с
поверхности, равно числу конденсирующихся
молекул. Этому равновесию соответствует
давление насыщенного пара растворителя
над чистым растворителем
Выражение для молярной массы растворенного вещества
Следовательно, измеряя экспериментально давление насыщенного пара растворителя над раствором можно определить молярную массу растворенного вещества. Температура замерзания и кипения растворов. Эбулиоскопия. Криоскопия. Понижение давления насыщенного пара растворителя над раствором приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем. Согласно первому следствию из закона Рауля повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльной концентрации растворенного вещества: ΔТкип.=ЕСm(2) (7.6) ΔТзам..=KСm(2) (7.7), где Сm(2) – моляльная концентрация раствора; Е - эбулиоскопическая и К – криоскопическая постоянные, соответствующие повышению температуры кипения и понижению температуры замерзания раствора с Сm(2)=1 моль/1000 г растворителя. Значения Е и К зависят только от природы растворителя. Рассчитайте, при какой температуре должен кристаллизоваться раствор, содержащий в 250 г воды 54 г глюкозы С6Н1206. Решение: М(С6Н12О6) = 180 г/моль. По формуле определим моляльность раствора: С = 54-1000/180-250 = 1,2 моль /1000 г воды. По формуле: Дкрист = 1,86-1,20 = 2,23°. Следовательно, раствор будет кристаллизоваться при - 2,23 °С.
|
||||||||||||||||||||||
|
№ 46. Электролитическая диссоциация - полный или частичный распад молекул растворенного вещества на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическая диссоциация, как правило, происходит в полярных растворителях. При электролитической диссоциации разрываются обычно лишь наиболее полярные связи молекул, например карбоновые кислоты RCOOH диссоциируют на RCOO- и Н+, электролитической диссоциации могут подвергаться молекулы некоторых растворителей, например воды. Основными причинами электролитической диссоциации являются, с одной стороны, взаимодействие растворенного вещества с растворителем, которое приводит к сольватации ионов, а с другой стороны - значительное ослабление электростатических взаимодействий между сольватированными ионами в среде, обусловленное ее электростатическим полем (диэлектрической проницаемостью растворителя). При этом работа, необходимая для разрушения молекул (кристаллической решетки), обеспечивается за счет энергии сольватации. Электролитическая диссоциация лежит в основе деления растворов на два класса - растворы неэлектролитов и растворы электролитов. Наблюдаемое различие в коллигативных свойствах разбавленных растворов электролитов и неэлектролитов объясняется тем, что из-за электролитической диссоциации увеличивается общее число частиц в растворе. Это, в частности, приводит к увеличению осмотического давления раствора сравнительно с растворами неэлектролитов, понижению давления пара растворителя над раствором, увеличению изменения температуры кипения и замерзания раствора относительно чистого растворителя. Электролитической диссоциацией объясняется также ионная электропроводность электролитов.
Мерой
электролитической диссоциации является
степень диссоциации
|
||||||||||||||||||||||
|
№ 47. Дано Решение (AlCl3) = 16 % Пусть масса раствора 100 г, тогда масса соли равна 16 г р-ра (AlCl3 ) = 1,149 Vр-ра = 100 г : 1,149 г/мл = 87 мл = 0,087 л C (AlCl3) = ? n (AlCl3) = 16 г: 133,5 г/моль = 0,12 моль CH (AlCl3) = ? C (AlCl3) = 0,12 моль : 0,087 л = 1,38 моль/л m экв ((AlCl3) = М (AlCl3) : 3 = 133,5 : 3 = 44,5 CH (AlCl3) = 16 / 44,5 0,087 = 4,13 моль/л |
||||||||||||||||||||||
|
|
||||||||||||||||||||||
|
№ 48. Качественная теория сильных электролитов была разработана П. Дебаем и Г. Хюккелем (1923). Для сильных электролитов, полностью диссоциирующих на ионы, даже при малых концентрациях растворов энергия электростатического взаимодействия между ионами достаточно велика, и пренебречь этим взаимодействием нельзя. Взаимодействие противоположно и одноименно заряженных ионов (соответственно притяжение и отталкивание) приводит к тому, что вблизи каждого иона находятся преимущественно ионы с противоположным зарядом, образующие т.н. ионную атмосферу. Радиус ионной атмосферы сравнительно велик, поэтому ионные атмосферы соседних ионов пересекаются; кроме того, каждый ион окружен дипольными молекулами растворителя – сольватной оболочкой. Т.о., в растворе сильного электролита возникает подобие пространственной структуры, что ограничивает свободу перемещения ионов и приводит к изменению свойств раствора в том же направлении, как действовало бы уменьшение степени диссоциации. Поэтому, определяя степень диссоциации раствора сильного электролита, получают т.н. кажущуюся степень диссоциации, т.е. величину α с поправкой на межионное взаимодействие. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита. З а д а ч а. Вычислить кажущуюся степень диссоциации хлорида магния в водном растворе с массовой долей 0,5% и плотность 1000 г/л, если при температуре 180С осмотическое давление этого раствора равно 3,2 105 Па. Р е ш е н и е: Путь масса раствора равна 100 г, тогда масса хлорида магния 0,5 г, а масса воды – 99,5 г. Количество вещества хлорида магния: n (MgCl2) = 0,5 г : 95 г/моль = 0,0053 моль. Хлорид магния диссоциирует на ионы в растворе: MgCl2 = Mg2+ + 2Cl-, т.е. в растворе из одного моля соли получается 3 моль-ионов. Объем раствора при плотности 1000г/л равен 0,1 л, отсюда CM = 0,0053 : 0,1 = 0,053 моль/л или 53 моль/м3 Найдем изотонический коэффициент по формуле Pосм = CM ·R· T· i i = Pосм/ CM ·R· T = 3,2/ 53· 8,314 ·291 = 2,5 = 2,5 -1/ 3 – 1 = 0,75 или 75 % |
||||||||||||||||||||||
|
№ 49. Чтобы вычислить массовые отношения этиленгликоля и воды в антифризе, определим Сm в соответствии с законом Рауля t = Kкр · Сm Отсюда, так как t = 200, Kкр (Н2О) = 1,86, тогда Сm = 20/1,86 = 10,75 моль/кг, массовая доля этиленгликоля (С2Н4(ОН)2) = 10,75 · 62 ·100/= 1000 + 10,75 · 62 = 40 %. Таким образом отношение масс этиленгликоля и воды = 2:3 |
||||||||||||||||||||||
|
№ 50. Определим Сm в соответствии с законом Рауля t = Kкр · Сm Сm Отсюда, так как t = 250, Kкр (Н2О) = 1,86, тогда Сm = 25/1,86 = 13,44 моль/кг, m (С2Н4(ОН)2) = 13,44 · 62 = 833 г , при плотности 1116 кг/м3 V(С2Н4(ОН)2) = 746 мл. Тогда соотношение воды и этиленгликоля по объёму 1000: 746 = 4 : 3 |
||||||||||||||||||||||
|
№ 51. Вычислите массовую долю сахара С12Н22О11 в водном растворе, зная температуру кристаллизации раствора (–0,93°С). Криоскопическая константа воды 1,86°С. Решение. Δt = Cm(C12H22O11)·Kк Тзам. = 0 – Δt -0,93 = 0 – Δt Δt = 0,93°C 0,93 = Cm(C12H22O11)·1,86 Cm(C12H22O11) = 0,5 моль/кг ω(C12H22O11) = 342·0,5·100/(1000 + 342·0,5) = 14,6%
|
||||||||||||||||||||||
|
№ 52. Имеется 15% водный раствор пропилового спирта. Кэ (Н2О) = 0,53. Пусть масса раствора равна 1000 г, тогда масса спирта = 150 г, молярная масса спирта = 60 г/моль n(C3H7OH) = 150 / 60 = 2,5 моль Сm = 2,5 моль/кг. Тогда t = 2,5 0,53 = 1,325 T кип = 100 + 1,325 = 101,325 0С |
||||||||||||||||||||||
|
|
||||||||||||||||||||||
|
№ 53. Так как в 1 литре растворе неэлетролита содержится 2,01 ·1023 молекул, то можно рассчитать:
n = N/NA = 2,01 ·1023 : 6,02 ·1023 = 0,33 моль, отсюда Сm = 0,33 моль/л, Ккр (Н2О) = 1,86 t = Ккр (Н2О) Сm = 1,86 0,33 = 0,6 tзам = 0 – 0,6 = - 0,60С
|
||||||||||||||||||||||
|
№ 54. Вещества, распадающиеся в растворах или расплавах на ионы, называют электролитами. Электролитами являются соли, кислоты и основания. При растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами; например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков, гидроксид-ионы. Диссоциация НС1 и NaCl выразится уравнением: HCl = H+ + Cl- NaCl =Na++ Cl- В зависимости от структуры растворяющегося вещества в безводном состоянии (ионная или полярная связь) его диссоциация протекает по-разному. Когда кристалл соли, например, хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными.
Рис. 1. Схема диссоциации полярных молекул в растворе Иначе протекает диссоциация полярных молекул (рис. 1). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов — поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в молекуле, а также с тепловым движением окружающих ее молекул воды приводит к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются. Ион водорода Н+ (протон) оказывается прочно связанным с молекулой воды в ион гидроксония Н3О+. Так, при растворении в воде хлороводорода и азотной кислоты происходят процессы, которые можно выразить уравнениями Н2О + НСl = Н3О+ + Сl ˉ Н2О + HNO3 = Н3О+ + NO3ˉ В результате этого процесса молекула НСl расщепляется таким образом, что общая пара электронов остается у атома хлора, который превращается в ион Сlˉ, а протон, внедряясь в электронную оболочку атома кислорода в молекуле воды, образует ион гидроксония Н3О+ . Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В результате диссоциации образуются не свободные ионы, а соединения ионов с молекулами растворителя. В общем случае любого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов, тем более, что число молекул растворителя, связанных с ионами, изменяется в зависимости от концентрации раствора и других условий. Степень диссоциации. Сила электролитов. Чаще всего в растворе лишь часть электролита диссоциирует на ионы, поэтому существует понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе. В связи с этим электролиты можно разделить на две группы - сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически полностью. Понятие степени диссоциации к ним не применимо. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. К сильным электролитам принадлежат почти все соли; из кислот и оснований к ним относятся HNO3, HCIO4, НСI, HBr, HI, КОН, NaOH, Ba(OH)2 и Са(ОН)2. К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат Н2СО3, H2S, HCN, H2SiО3и NH4OH. Степень диссоциации принято обозначать греческой буквой ά и выражать либо в долях единицы, либо в процентах. Так, для 0,1 н. раствора СН3СООН ά = 0,013 (или 1,3%), а для 0,1 н. раствора HCN ά = 10ˉ4 (или 0,01%). Константа диссоциации. К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты СН3СООН → Н+ + СН3СООˉ константа равновесия имеет вид: К = ([Н+] [СНзСООˉ])/[СНзСООН] Здесь в числителе дроби стоят концентрации ионов — продуктов диссоциации, а в знаменателе — концентрация недиссоциированных молекул. Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Она характеризует способность данного вещества распадаться на ионы: чем выше К, тем легче электролит диссоциирует.
|
||||||||||||||||||||||
|
№ 55. Соли – электролиты, которые диссоциируют на катионы металлов и анионы кислотных остатков Na2CO3 Û 2 Na+ + CO32- AlCl3 Û Al3+ + 3 Cl- Cr2(SO4)3 Û 2 Cr3+ + 3 SO42- Основания- электролиты, которые диссоциируют на катионы металлов и гидроксид-анионы Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2 = Сa2+ + 2OH- Кислоты – электролиты, которые дисоциируют на катионы водорода (гидроксония) и анионы кислотных остатков. H Cl = H+ + Cl - Многоосновные кислоты диссоциируют ступенчато. На каждой ступени отщепляется один ион водорода. H2SO4 = H+ + HSO4- (I ступень) HSO4- = H+ + SO42- (II ступень) Химические свойства солей. 1. Взаимодействие с кислотами MgCO3 + 2HCl = MgCl2+ H2О +CO2 MgCO3 + 2H+ = Mg2+ + H2О +CO2 2. Взаимодействие со щелочами Na2SO4 + Ba(OH)2 = 2NaOH + BaSO4¯ 3. Взаимодействуют с металлами Cu + 2 Ag+ = Cu2+ + 2 Ag ¯ 4. Обменные реакции с другими солями. CaCl2 + Na2SiO3 = CaSiO3¯ + 2NaCl Ca2+ + SiO32- = CaSiO3¯ Химические свойства оснований: 1. Основания реагируют с кислотами с образованием соли и воды: 2NaOH + H2SO4 = Na2SO4 + 2H2O 2. Основания реагируют с оксидами неметаллов с образованием соли и воды. CO2 + 2 NaOH = Na2CO3 + H2O 3. Растворимые в воде основания реагируют с солями. CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4 4. Нерастворимые в воде основания разлагаются при нагревании на оксид металла и воду: t0 Cu(OH)2 = CuO + H2O Химические свойства кислот: 1. Кислоты реагируют с основаниями с образованием соли и воды. NaOH + HCl = NaCl + H2O Н+ + ОН- = Н2О 2. Кислоты реагируют с оксидами металлов с образованием соли и воды. CuO + H2SO4 = CuSO4 + H2O CuO + 2 H+ = Cu2+ + H2O 3. Кислоты взаимодействуют с металлами, образуя соль и водород. Zn + 2 H+ = Zn2+ + H2 4. Кислоты взаимодействуют с солями. 2 H+ + CO32- = H2O + CO2 Амфотерные гидроксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей. Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + NaOH = NaAl(OH)4 Al(OH)3 + OH- = Al(OH)4- Кислые соли – продукты неполной нейтрализации многоосновных кислот основаниями. Например NaHCO3 – гидрокарбонат натрия. При растворении в воде дисоциирует NaHCO3 = Na + + HCO3- Основные соли – продукты неполной нейтрализации многокислотных оснований кислотами. Например Fe(OH)Cl2 гидроксохлорид железа (III). При растворении диссоциирует Fe(OH)Cl2 = Fe(OH) 2+ + 2Cl- Перманганат калия относится к средним солям. Диссоциирует: KMnO4 = K+ + MnO4 - |
||||||||||||||||||||||
|
№ 56. С гидроксидом калия КОН будут взаимодействовать следующие вещества: Al(OH)3, H2SO4 KOH + Al(OH)3 = KAl(OH)4 K+ + OH- + Al(OH)3 = K+ + Al(OH)4- OH- + Al(OH)3 = Al(OH)4- 2KOH + H2SO4 = K2SO4 + 2H2O 2K+ + 2OH- + 2H+ + SO42- = 2K+ + SO42-+ 2H2O 2OH- + 2H+ = 2H2O OH- + H+ = H2O С гидроксидом бария гидроксид калия не реагирует. Оба вещества являются основаниями и между ними не возможно взаимодействие |
||||||||||||||||||||||
|
№ 57. С раствором серной кислоты будут взаимодействовать следующие вещества: Al(OH)3, NiSO4, Na2S: 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O 2Al(OH)3 + 6H + + 3SO42- = 2Al3+ + 3SO42-+ 6H2O 2Al(OH)3 + 6H + = 2Al3+ + 6H2O Al(OH)3 + 3H + = Al3+ + 3H2O NiSO4 + H2SO4 = Ni(HSO4)2 в этом случае образуется кислая соль гидросульфат никеля Na2S + H2SO4 = Na2SO4 + H2S 2Na+ + S2- + 2H + + SO42- = 2Na+ + SO42- + H2S S2- + 2H + - = H2S С уксусной кислотой серная кислота не реагирует (вещества одной природы) |
||||||||||||||||||||||
|
№ 58. С раствором гидроксида натрия будут реагировать: NiSO4, Be(OH)2, KHCO3 NiSO4 + 2NaOH = Ni(OH)2 + Na2SO4 Ni2+ + SO42- + 2Na + + 2OH- = Ni(OH)2 + 2Na + + SO42- Ni2+ + 2OH- = Ni(OH)2 2NaOH + Be(OH)2 = Na2Be(OH)4 2Na+ + 2OH- + Be(OH)2 = 2Na+ + Be(OH)42- 2OH- + Be(OH)2 = Be(OH)42- 2KHCO3 + 2NaOH = K2CO3 + Na2CO3 + 2H2O 2K+ + 2HCO3- +2Na+ + 2OH- = 2K+ + CO32- +2Na+ + CO32- + 2H2O 2HCO3- + 2OH- = 2CO32- + 2H2O HCO3- + OH- = CO32- + H2O
|
||||||||||||||||||||||
|
№ 59. Жесткость воды отражает содержание в ней ионов кальция и магния Ca2+ и Mg2+. Жесткость, обусловленная наличием в воде гидрокарбонатов кальция и магния, называется временной, или карбонатной (Жвр). Жесткость, обусловленная хлоридами и сульфатами этих металлов, называется постоянной (Жп). Суммарная жесткость воды носит название общей жесткости. Жесткость воды (степень жесткости принято выражать в миллимолях ионов Са2+ или Mg2+ (или обоих ионов) в 1 дм3 или 1 кг воды – ммоль/дм3 или ммоль/кг. В технической литературе встречается единица измерения степени жесткости воды – мг экв/дм3 или мг-экв/кг. Зная, что молярные массы эквивалентов ионов Са2+ и Mg2+ соответственно равны 20,04 и 12,16 мг/дм3, можно рассчитать обжую жесткость воды (в ммоль/дм3)
Жесткость воды
Существует множество способов устранения жёсткости: Карбонатную жёсткость устраняют: 1) Кипячением: Ca(HCO3)2→CaCO3↓+H2O+CO2 Mg(HCO3)2→MgCO3↓+H2O+CO2 2) Действием известкового молока или соды: Ca(OH)2+Ca(HCO3)2→2CaCO3↓+2H2O Ca(HCO3)2+NaCO3→CaCO3↓+2NaHCO3 Некарбонатную жёсткость устраняют действием соды: CaSO4+Na2CO3→CaCO3↓+Na2SO4 MgSO4+Na2CO3→MgCO3↓+Na2SO4 Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4: 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓+ 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4 Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому достигается лучшее умягчение воды. Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану. Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости. Термический способ. Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в быту. В промышленности применяется, например, на ТЭЦ. Реагентное умягчение. Метод основан на добавлении в воду соды или гашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента. Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду. Определенное умягчение воды происходит и в бытовых фильтрах для питьевой воды. Отфильтрованная вода дает меньше накипи. Полностью очистить воду можно методом перегонки (дистилляцией). |
||||||||||||||||||||||
|
№ 60. Схема гальванического элемента, который состоит из марганцевого анода и стандартного водородного потенциала, следующая: анод (-) Mn |Mn2+| 2H+ |Pt, H2 (+) катод На аноде происходит процесс окисления марганца Mn – 2e = Mn 2+ На катоде восстанавливаются ионы водорода 2Н+ + 2е = Н2 Суммарное уравнение реакции: Mn + 2H+ = Mn2+ + H2 Рассчитаем ЭДС гальванического элемента, зная, что концентрация ионов марганца составляет 0,01 моль/л. E = к - а Поскольку катодом является стандартный водородный электрод, его потенциал равен 0. Потенциал анода рассчитываем по уравнению Нернста а = 0 Mn2+ /Mn + 0,059 lgNi2+/n = -1,05 + 0,059 lg10-2/2 = -1,05 – 0,059 = - 1,109 В Е = 0 – (-1,109) = 1,109 В Ответ: 1,109 В |
||||||||||||||||||||||
|
№ 61. Количественной характеристикой способности веществ вступать в окислительно-восстановительные реакции (ОВР) является электродный потенциал. Электродный потенциал - разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение электродного потенциала обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически. Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродными потенциалами, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю. Стандартный электродный потенциал (Е0) металла – это ЭДС гальванического элемента при условии, что один полуэлемент – водородный (СН+ = 1 моль/л, РН2 = 1атм, Т = 250С), а второй – металл, погруженный в раствор его соли с концентрацией ионов металла 1 моль/л. Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый ряд стандартных электродный потенциалов. Этот ряд важен для предсказания многих свойств металлов: вытеснения металлов из солей, взаимодействия с кислотами, электролиз растворов солей и т.д. Величина электродного потенциала металла зависит от природы металла, концентрации ионов электролита, температуры. Математически эта зависимость выражается уравнением Нернста: Е = Е0 + (RT/nF) ln C Здесь Е – потенциал металла при данной концентрации ионов, В; Е0 – стандартный электродный потенциал металла, В; R – универсальная газовая постоянная (8,316 Дж/град моль); Т – абсолютная температура, К; n – заряд иона металла; F – число Фарадея (96500 Кл/моль); С – концентрация (или активность) ионов металла в растворе, М. Устройство стандартного водородного электрода: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K
|
||||||||||||||||||||||
|
№ 62. Окислительно-восстановительный потенциал — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Биологически важной системой является система:Fe3+/Fe2+.Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением: Aox + n·e− → Ared, то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста. Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях. Равновесный потенциал электрода PbO2 + 4H+ + 2e = Pb2+ + 2H2O Рассчитывается по уравнению Нернста: PbO2 /H+ / Pb2+ = 0 PbO2 /H+ / Pb2+ + 0,059 lg H+ n Pb2+
Преобразуем выражение PbO2 /H+ / Pb2+ = 0 PbO2 /H+ / Pb2+ + 0,059 lg H+ + 0,059 lg Pb2+ = 2 2 0 PbO2 /H+ / Pb2+ - 0,059 рН - + 0,059 lg Pb2+ 2 2 Подставляем данные и решаем уравнение PbO2 /H+ / Pb2+ =1,45 -0,059 4 - + 0,059 lg 10-1 = 1,45 – 1,18 + 0,03 = 0,3 В 2 2 Ответ: 0,3 В
|
||||||||||||||||||||||
|
№ 63. В гальваническом элементе протекает реакция Cr + Cd2+ = Cr3+ + Cd Следовательно, анодом в данной гальванической паре является хром (окисляется), катодом – кадмий (восстанавливается). Схема гальванического элемента такова: анод (-) Cr |Cr3+| Cd2+ |Cd (+) катод Уравнение анодного процесса: Cr – 3e Cr3+ окисление Уравнение катодного процесса: Cd2+ + 2e = Cd восстановление ЭДС гальванического элемента равна разности потенциалов катодного и анодного процессов E = к - а Потенциалы катода и анода рассчитаем по уравнению Нернста, зная концентрации потенциалобразующих ионов
к = 0 Cd2+ /Cd + 0,059 lgCd2+/2 0 Cd2+ /Cd = -0,40B к = -0,40 + 0,059 lg1 = - 0,40 B 2 a = 0 Cr3+ /Cr + 0,059 lgCr3+/3 0 Cr3+ /Cr = - 0,74B a = - 0,74 + 0,059 lg10-3 = - 0,74 – 0,059 = - 0,799 B 3 Ответ: - 0,799 B |
||||||||||||||||||||||
|
№ 64. Для того, чтобы никель в гальваническом элементе был анодом, в паре с ним должен быть электрод с большим значением потенциала, т.е. менее активный металл, например серебряный электрод. В этом случае схема элемента будет такова: анод (-) Ni |Ni2+| Ag+ |Ag (+) катод Анодный процесс: (-) Ni -2e = Ni2+ - окисление Катодный процесс: (+) Ag+ + e = Ag - восстановление ЭДС гальванического элемента равно: E = к - а Потенциал катода – серебряного стандартного электрода – находим по справочнику 0 Ag+ / Ag = 0,80 В Потенциал анода рассчитываем по уравнению Нернста: 0 Ni2+ / Ni = - 0,23 В к = 0 Ni2+ / Ni + 0,059 lgNi2+/n = -0,23 + 0,059 lg10-2/2 = - 0,23 – 0,059 = - 0,289 В Е = 0,80 –(-0,289) = 1,089 В Для того, чтобы никель в гальваническом элементе был катодом, в паре с ним должен быть электрод с меньшим значением потенциала, т.е. более активный металл, например цинковый электрод. В этом случае схема гальванического элемента будет такова: анод (-) Zn |Zn2+| Ni2+ |Ni (+) катод Анодный процесс: (-) Zn - 2e = Zn2+ - окисление Катодный процесс: (+) Ni2+ +2e = Ni - восстановление Аналогично рассчитываем ЭДС гальванического элемента а = 0 Zn2+ /Zn = -0,76 В Потенциалом никелевого электрода будет рассчитанное ранее E = к - а = -0,289 – (-0,76) = 0,471 В Ответ: 1,089В; 0,471 В |
||||||||||||||||||||||
|
№ 65. Электролиз - это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор. Электролиз - это ещё один способ получения чистых металлов и неметаллов. Электролиз расплавов солей 1) Все катионы металлов восстанавливаются на катоде: К(-): Zn2+ + 2e- → Zn0; Na+ + 1e- → Na0 2) Анионы бескислородных кислот окисляются на аноде: А(+): 2Cl¯ - 2e-→Cl2 3) Анионы кислородсодержащих кислот образуют соответствующий кислотный оксид и кислород: А(+): 2SO42ˉ - 4e- → 2SO3 + O2 Электролиз водных растворов. При определении продуктов следует помнить, что: 1. На катоде восстанавливающийся продукт зависит от положения металлов в ряду стандартных электродных потенциалов. Li - Al – восстанавливается водород воды; Mn - H - восстанавливается водород воды и металл; Cu - Au - восстанавливается металл 2. На аноде получающийся продукт зависит как от материала анода, так и от природы аниона: а) инертный анод (С, Pt) – окисляются в такой последовательности: S-2,I- Br-,Cl- OH- (H2O) анионы кислородсодержащих кислот, F-; б) неинертный анод (Cu, Ag, Ni, Zn) – анод растворяется. В зависимости от природы катиона и аниона можно выделить 4 типа растворов, процессы которых приведены ниже. 1. Разряжается катион и анион соли. В результате электролиза концентрация соли уменьшается: CuCl2 + (H2O) Cu + Cl2 K(+): Cu2+ + 2 e Cu0 A(-): 2Cl- - 2e Cl20 2. Разряжается катион металла и вода. В результате электролиза меняется состав раствора 2CuSO4 + 2H2O 2Cu + 2H2SO4 + O2 K(+): Cu2+ + 2 e Cu0 A(-): 2H2O - 4e O20 + 4H+ 3. Разряжается анион соли и вода. В результате электролиза меняется состав раствора 2NaCl + 2H2O 2 NaOH + H2 + Cl2 K(+): 2H2O + 2e H20 + 2OH- A(-): 2Cl- - 2e Cl20 4. Разряжается только вода (Na2SO4 ) + 2H2O = 2H2 + O2 K(+): 2H2O + 2e H20 + 2OH- A(-): 2H2O - 4e O20 + 4H+ |
||||||||||||||||||||||
|
№ 67. При электролизе водного раствора сульфата магния произойдут следующие процессы: (MgSO4)+ 2H2O 2H2 + O2 , т.е., идет электролиз воды. Масса сульфата магния останется прежней. m (O2) = 1930 ·16/96500 = 3,2 г на аноде m (H2) = 2 ·1930 ·1/96500 = 0,04 г на катоде В околоэлектродном пространстве останется раствор сульфата магния более высокой концентрации, чем до начала процесса. |
||||||||||||||||||||||
|
№ 66. Электролиз водного раствора NiSO4 на угольном аноде 2NiSO4 + 2H2O 2Ni + O2 + 2Н2SO4 (1) K(+): Ni2+ + 2 e Ni0 A(-): 2H2O - 4e O20 + 4H+ Электролиз водного раствора NiSO4 на никелевом аноде K(+): Ni2+ + 2 e Ni0 A(-): Ni0 - 2e Ni2+ На катоде восстанавливаются ионы никеля из раствора, анод сам растворяется. Этот процесс используют для электрохимического покрытия поверхностей никелем (хим.никель) – никелирования. Если количество электричества Q = 965 Кл, то согласно 2 закону Фарадея (расчёт по уравнению 1) m(Ni) = 2· 965 ·29,5/96500 = 0,59 г на катоде m (O2) = 965 ·16/96500 = 0,16 г на аноде m (H2SO4) = 2 ·965 ·49/96500 = 0,98 г Закон
Фарадея: масса m вещества, выделившегося
на электроде, прямо пропорциональна
электрическому заряду q, прошедшему
через электролит:
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
Второй закон Фарадея записывается в следующем виде:
где
|
||||||||||||||||||||||
|
№ 67. При электролизе водного раствора сульфата магния произойдут следующие процессы: (MgSO4)+ 2H2O 2H2 + O2 , т.е., идет электролиз воды. Масса сульфата магния останется прежней. m (O2) = 1930 ·16/96500 = 3,2 г на аноде m (H2) = 2 ·1930 ·1/96500 = 0,04 г на катоде В околоэлектродном пространстве останется раствор сульфата магния более высокой концентрации, чем до начала процесса. |
||||||||||||||||||||||
|
№ 68. Электролиз водного раствора NiSO4 на угольном аноде 2NiSO4 + 2H2O 2Ni + O2 + 2Н2SO4 (1) K(+): Ni2+ + 2 e Ni0 A(-): 2H2O - 4e O20 + 4H+ Расчёт
по закону Фарадея:
где
m(Ni) = 2· 1990 ·29,5/96500 = 1,2 г на катоде m (O2) = 1990 ·16/96500 = 0,33 г на аноде m (H2SO4) = 2 ·1990 ·49/96500 = 2,02 г |
||||||||||||||||||||||
|
№ 69. Электролиз раствора хлорида алюминия 2AlCl3 + 6H2O 3H2 + 3Cl2 + 2Al(OH)3 K(+): 2H2O + 2e H20 + 2OH- A(-): 2Cl- - 2e Cl20 Если
известно количество электричества
(1965 Кл), то расчёт по закону Фарадея:
где
m (Н2) = 3 1965 ·1/96500 = 0,06 г на катоде m (Cl2) = 3 ·1995 ·35,5/96500 = 2,17 г на аноде |
||||||||||||||||||||||
|
№ 70. Чтобы с помощью электролиза нанести покрытие из цинка на изделие, надо изделие сделать катодом и поместить в раствор соли цинка. При электролизе ионы цинка на катоде будут восстанавливаться и покрывать поверхность изделия Электролиз водного раствора ZnSO4 на угольном аноде 2ZnSO4 + 2H2O 2Zn + O2 + 2Н2SO4 (1) K(+): Zn2+ + 2 e Zn0 A(-): 2H2O - 4e O20 + 4H+ Решение Выход по току: (Zn) = (mпр / mтеор)-100 % mтеор (Zn) = (mпр / (Zn) по току ) 100 = 32,5/0,75 = 43,3г. I = 43,3 ·96 500 / 32,5·600 =214 A. |
||||||||||||||||||||||
|
№ 71. Решение Эквивалентный
объем кислорода (н.у.)
m(H2SO4) = V(O2)· Mэкв(H2SO4) / Vэкв (O2) = 1,12 · 49/5,6 = 9,8 г
|
||||||||||||||||||||||
|
№ 72. Электролиз раствора NaBr Разряжается анион соли и вода. В результате электролиза меняется состав раствора 2NaBr + 2H2O 2 NaOH + H2 + Br2 K(+): 2H2O + 2e H20 + 2OH- A(-): 2Br- - 2e Br20 Электролиз расплава NaBr: 2NaBr 2 Na + Br2 K(+): Na+ + e Na0 A(-): 2Br- - 2e Br20 Если масса брома 60 г, а время электролиза 3 часа (10800 с), то I = 60 ·96 500 / 80·10800 = 6,7 A
|
||||||||||||||||||||||
|
№ 73. Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию. Основу химических источников тока составляют два электрода (анод, содержащий окислитель, и катод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя. В современных химических источниках тока используются:
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление - на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи. Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди. Этот элемент (элемент Якоби-Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала. При работе элемента, т.е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением: Zn = Zn2+ + 2e- На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид: Cu2+ + 2e- = Cu Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента, электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. Электрод, на котором протекает окисление, называется анодом(цинк). Электрод, на котором протекает восстановление, называется катодом (медь). В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако, число реакций, практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами. Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ. В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации. Аккумуляторы являются химическими источниками электрической энергии многоразового действия. Они состоят из двух электродов (положительного и отрицательного), электролита и корпуса. Накопление энергии в аккумуляторе происходит при протекании химической реакции окисления-восстановления электродов. При разряде аккумулятора происходят обратные процессы. Напряжение аккумулятора - это разность потенциалов между полюсами аккумулятора при фиксированной нагрузке. Для получения достаточно больших значений напряжений или заряда отдельные аккумуляторы соединяются между собой последовательно или параллельно в батареи. Существует ряд общепринятых напряжений для аккумуляторных батарей: 2; 4; 6; 12; 24 В. Ключевые электрохимические процессы в свинцово-кислотном аккумуляторе Активные вещества аккумулятора сосредоточены в электролите и положительных и отрицательных электродах, а совокупность этих веществ называется электрохимической системой. В свинцово-кислотных аккумуляторных батареях электролитом является раствор серной кислоты (H2SO4), активным веществом положительных пластин - двуокись свинца (PbO2), отрицательных пластин - свинец (Pb). Основные процессы, проходящие на электродах, описывают реакции: На отрицательном электроде: Pb + HSO4- → PbSO4 + H+ + 2e- (разряд) PbSO4 + H+ + 2e- → Pb + HSO4- (заряд) На положительном электроде: PbO2 + HSO4- + 3H+ + 2e- → PbSO4 + 2H2O (разряд) PbSO4 + 2H2O → PbO2 + HSO4- + 3H+ + 2e- (заряд) Суммарная реакция в свинцовом аккумуляторе имеет вид: PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O (разряд) 2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4 (заряд) Таким образом, при разряде свинцового аккумулятора на обоих электродах формируется малорастворимый сульфат свинца (двойная сульфатация) и происходит сильное разбавление серной кислоты. Напряжение разомкнутой цепи заряженного аккумулятора равно 2,05-2,15 В, в зависимости от концентрации серной кислоты. При разряде по мере разбавления электролита напряжение разомкнутой цепи аккумулятора понижается и после полного разряда становится равным 1,95-2,03 В. При заряде свинцово-кислотного аккумулятора, как и в других аккумуляторах с водным электролитом, имеют место побочные реакции выделения газов. Выделение водорода начинается при полном заряжении отрицательного электрода. Кислород начинает выделяться гораздо раньше: в обычных условиях заряда при 50-80% заряженности (в зависимости от тока заряда), а при температуре 0 °С уже после заряда на 30-40 %. Вследствие этого отдача положительного электрода по емкости составляет 85-90 %. Для получения полной разрядной емкости при заряде аккумулятору должен быть обеспечен перезаряд на 10-20 %. Этот перезаряд сопровождается существенным выделением водорода на отрицательном электроде и кислорода - на положительном. Выделение водорода имеет место и при хранении заряженного свинцово-кислотного аккумулятора. Саморазряд его определяется преимущественно скоростью растворения свинца согласно реакции: Pb + H2SO4 → PbSO4 + H2 Скорость этого процесса зависит от температуры, объема электролита и его концентрации, но более всего от чистоты компонентов. В отсутствие примесей реакция протекает медленно из-за большого перенапряжения выделения водорода на свинце. Но на практике, на поверхности свинцового электрода всегда много примесей, среди которых наибольшее влияние оказывает сурьма, количество которой в сплаве для решеток и токоведущих деталей доходит до 6 %. На положительном электроде может также самопроизвольно проходить реакция восстановления диоксида свинца: PbO2 + H2SO4 → PbSO4 + 1/2O2 + H2O в результате которой выделяется кислород, но скорость ее незначительна. В процессе эксплуатации саморазряд аккумулятора может увеличиваться из-за образования дендритных мостиков из металлического свинца. Потери емкости свежеизготовленного аккумулятора за счет саморазряда как правило не превышают 2-3 % в месяц. Но при эксплуатации они быстро увеличиваются. В щелочных аккумуляторах положительный электрод изготавливается из никелевой решетки, пропитанной гелеобразным гидроксидом никеля II Ni(OH)2; а отрицательный – из кадмия или железа. Ионным проводником служит 20%-ый раствор гидроксида калия КОН. Суммарные токообразующие и генерирующие реакции в таких аккумуляторах имеют вид: разряд 2NiOOH + Cd + 2H2O ◄======►2Ni(OH)2 + Cd(OH)2; ЕЭ0 = 1,45В. заряд разряд 2NiOOH + Fe + 2H2O ◄======►2Ni(OH)2 + Fe(OH)2; ЕЭ0 = 1,48В. заряд К достоинствам этих аккумуляторов относят большой срок их службы (до 10 лет) и высокую механическую прочность, а к недостаткам – невысокие КПД и рабочее напряжение. Щелочные аккумуляторы используются для питания электрокар, погрузчиков, рудничных электровозов, аппаратуры связи и электронной аппаратуры, радиоприемников. Вспомним также, что кадмий является высокотоксичным металлом, что требует соблюдения правил безопасности при утилизации отработанных устройств. В последние годы активно разрабатываются аккумуляторы с литиевым отрицательным электродом, неводным электролитом и положительным электродом, состоящим из оксидов V2O3; NiO; CoO; MnO2. Они используются в электронной слаботоковой аппаратуре.
№ 74. Коррозия металлов – разрушение металлов и сплавов под действием окружающей среды. Это всегда окислительно-восстановительный процесс. Металл окисляется, превращаясь в положительно заряженный ион. В общем виде: Me – ne = Me+n Известны различные виды коррозии металлов. Одним из основных её видов является химическая, которую иногда ещё называют газовой, так как иногда она происходит под воздействием газообразных компонентов из окружающей среды при высоких температурах. Химическая коррозия может происходить и под воздействием некоторых агрессивных жидкостей. Основным этого процесса является то, что она происходит без возникновения в системе электрического тока. Ей подвергаются детали и узлы машин, работающих в атмосфере кислорода при высоких температурах, например турбинные двигатели, ракетные двигатели и некоторые другие, а также подвергаются детали узлы оборудования химического производства. Другим распространённым видом разрушения металлов является электрохимическая коррозия - поверхностное разрушение в среде электролита с возникновением в системе электрического тока. Характер разрушения поверхности металла может быть различным и зависит от свойств этого металла и условиях протекания процесса. Теперь остановимся подробнее на электрохимической коррозии. Электрохимическая коррозия. Этот вид коррозии наиболее распространен и включает те случаи, когда процессы окисления металла и восстановления окислительного компонента протекают раздельно в среде жидкого электролита, т.е. в среде, проводящей электрический ток. Такими средами могут являться: природная вода, водные растворы солей, кислот, щелочей, а также воздух, почва и теплоизоляционные конструкции, содержащие электролит (влагу) в определенном количестве. Таким образом, процесс электрохимической коррозии представляет собой совокупность двух сопряженно протекающих реакций: анодной (окисление) Ме → Ме z+ + ze- (2), и катодной (восстановление) D + ze- → (Dze- ) (3), где D – деполяризатор (окислитель), присоединяющий к себе электроны металла. В качестве деполяризатора могут выступать: кислород, растворенный в электролите, ионы водорода (Н+) и некоторых металлов. Общая схема электрохимического коррозионного процесса металла приведена на рисунке 3, а частный случай ржавления железа описывается реакцией: 2Fe + 2H2O + O2 → 2Fe2+ + 4 OH- (4). Возникновение гальванических элементов «катод – анод» на углеродистых сталях (основного конструкционного материала трубопроводов) при их контакте с электролитами происходит в основном из-за дифференциации поверхности сталей на участки с различными электродными потенциалами (теория локальных коррозионных элементов). Причины дифференциации могут быть различны: 1) неоднородность структуры металла (в углеродистых сталях присутствуют фазы – феррит и цементит, структурные составляющие – перлит, цементит и феррит, имеющие различные электродные потенциалы); 2) наличие на поверхности сталей оксидных пленок, загрязнений, неметаллических включений и т.п; 3) неравномерное распределение окислителя на границе «металл-электролит», например, различные влажность и аэрация на различных участках поверхности металла; 4) 0 неравномерность распределения температуры; 5) контакт разнородных металлов. Защита от коррозии: изоляция металлов от агрессивной среды. Защитить металл от разрушения можно путём создания на его поверхности защитной плёнки - покрытия. Пути создания защитных плёнок различны. Например, корродирующий металл покрывают слоем другого металла, который не разрушается при тех же условиях. В качестве покрытий используются неметаллические покрытия, органические материалы - плёнки высокополимерных веществ, лаки, олифа, а также композиции из высокополимерных и неорганических красящих веществ. Особое значение имеют плёнки из оксидов металлов, получаемые при действии кислорода или подходящих окислителей (азотная кислота HNO3, дихромат калия K2Cr2O7 и др.) на поверхность металлов. Часто такие оксидные плёнки образуются на поверхности металлов даже просто при соприкосновении с воздухом, что делает химически-активные металлы (алюминий, цинк) коррозионностойкими. Подобную роль играют защитные нитридные покрытия, образующиеся при действии азота или аммиака на поверхность некоторых металлов. Искусственное оксидирование, азотирование, фосфатирование - хорошая защита металлов от коррозии. Электрохимическая защита металлов основана на изменении потенциала защищаемого металла и не связана с изоляцией металла от коррозионной среды. К ней относится катодная защита. Её называют также анодная защита. Катодная защита - заключается в том, что защищаемая конструкция "А", находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду (отрицательно заряженный электрод) источника электричества. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается. Протекторная защита - отличается от катодной защиты тем, что для её осуществления используется специальный анод - протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор соединяют с защищаемой конструкцией проводником электрического тока. В процессе коррозии протектор служит анодом (положительно заряженный электрод) и разрушается, тем самым предохраняя от разрушения нашу охраняемую конструкцию. Рассмотрим коррозионный процесс повреждения металлических защитных покрытий. 1. Если металл покрыт менее активным металлом. Например, олово (Sn) хорошо покрывает железо (Fe) и достаточно стойко против действия разбавленных кислот. В случае повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову, то есть анод - железо (оно растворяется и разрушается), а катод - олово (остаётся без изменений). 2. Если металл покрытия более активный, чем защищаемый металл. Например, покрытия железа (Fe) цинком (Zn). При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом (не растворяется), а цинк - анодом. В этом случае железо не будет разрушаться до тех пор, пока не разрушится весь цинк. Из этих случаев можно сделать вывод, что белее надёжное защитное покрытие то, что из металла более активного, чем защищаемый металл.
Коррозия железа кислородом Коррозия «белой жести» Катодная защита воздуха, растворенным (железо покрыто оловом) в оцинкованном железе в воде |
||||||||||||||||||||||
|
№ 75. Металлические покрытия на поверхности изделия можно получить разными способами: погружением в расплавленный металл, гальванической обработкой, распылением, плакированием. При погружении деталей в расплавленный металл образуется защитная пленка, не только устойчивая к действию коррозионно-активных веществ, но и обладающая высокой механической прочностью. Таким способом покрывают изделия оловом (лужение), цинком (цинкование) и другими металлами и сплавами. Гальваническое покрытие — осаждение слоя защитного металла на поверхности детали из раствора электролита, через который пропускают электрический ток. Это наиболее совершенный вид покрытия, обеспечивающий создание равномерной прочной защитной пленки (получение цинкованных, хромированных и других поверхностей). Цинкование применяют для защиты от коррозии деталей машин, работающих вне помещения, а также в закрытых помещениях с умеренной влажностью, загрязненных газами и продуктами сгорания. Преимущество цинковых покрытий — сохранение защитных свойств при малой толщине, наличии пор и обнаженных участков: в первую очередь разрушается цинк, изделие коррозии не подвергается. Кадмирование (покрытие слоем кадмия толщиной 10—15 мкм, для тяжелых условий 20—25 мкм) позволяет обеспечить защиту стальных деталей в условиях контакта с кислыми растворами, щелочами, морской и горячей водой. Распыление (электрометаллизация) заключается в нанесении на поверхность специальным аппаратом расплавленного защитного металла. На прокатных станах металлургических предприятий можно получать биметаллические материалы, например, черные металлы, покрытые тонким слоем нержавеющей стали или меди (плакирование). Эффективным способом защиты от коррозии является нанесение на поверхность металла газопламенной наплавкой нескольких слоев полимеров и др.
|
||||||||||||||||||||||
|
№ 76. Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Последние по характеру защитного действия можно разделить на анодные и катодные. Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент: А (–) Cr | H2O, O2 | Fe (+) К на аноде: Cr – 2e Cr2+ на катоде: 2 H2O + O2 + 4e 4 OH– Cr2+ + 2 OH– Cr(OH)2 Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3: 4 Cr(OH)2 + 2H2O + O2 4 Cr(OH)3 Таким образом, в результате электрохимической коррозии разрушается анодное покрытие. Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае. А (–) Fe | H2O, O2 | Sn (+) К на аноде: Fe – 2e Fe2+ на катоде: 2 H2O + O2 + 4e 4 OH– Fe2+ + 2 OH– Fe(OH)2 Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
|
||||||||||||||||||||||
|
№ 77. К анодным покрытиям относят покрытия, потенциалы которых в данной среде имеют более отрицательные значения, чем потенциал защищаемого (основного) металла. Так, для анодного покрытия стали служит цинк. В этом случае основной металл будет катодом коррозионного элемента, поэтому не корродирует (рис. 8.10)
1 - раствор; 2- покрытие; 3 - основной металл; 4 - пора. 1. Коррозия оцинкованного железа во влажном воздухе: при контакте Zn – Fe в нейтральной среде. При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В нейтральной среде его схема выглядит следующим образом: А (–) Zn| H2O, O2 | Fe (+) K Так как цинк электрохимически более активен (см. ряд напряжений металлов), он будет окисляться (корродировать). На железе будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация): А (–): Zn – 2e- = Zn2+ K (+): 2H2O + O2 + 4e- = 4OH– Продукт коррозии – Zn(OH)2. Ответ: Zn(OH)2. 2. Коррозия оцинкованного железа в кислой среде. При контакте Zn – Fe в кислой среде (HCl).При контакте двух металлов различной электрохимической активности возникает гальванический элемент. Его схема для кислой среды раствора: A (–) Zn | HCl | Fe (+) K Так как цинк электрохимически более активен (см. ряд напряжений металлов), он будет окисляться (корродировать). На железе будет протекать восстановительный процесс (в кислой среде – водородная деполяризация): А (–): Zn – 2e- = Zn2+ K (+): 2H+ + 2e- = H2. Продукт коррозии : ZnCl2. Ответ: ZnCl2. 3. Коррозия луженного железа во влажном воздухе: при контакте Sn – Fe в нейтральной среде. При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В нейтральной среде его схема выглядит следующим образом: А (–) Fe| H2O, O2 | Sn (+) K Так как железо электрохимически более активно (см. ряд напряжений металлов), оно будет окисляться (корродировать). На олове будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация): А (–): Fe – 2e- = Fe2+ K (+): 2H2O + O2 + 4e- = 4OH– Продукт коррозии – Fe(OH)2. Ответ: Fe(OH)2. 4. Коррозия луженного железа в кислой среде. При контакте Sn – Fe в кислой среде (HCl).При контакте двух металлов различной электрохимической активности возникает гальванический элемент. Его схема для кислой среды раствора: A (–) Fe | HCl | Sn (+) K Так как железо электрохимически более активно (см. ряд напряжений металлов), оно будет окисляться (корродировать). На олове будет протекать восстановительный процесс (в кислой среде – водородная деполяризация): А (–): Fe – 2e- = Fe2+ K (+): 2H+ + 2e- = H2. Продукт коррозии: FeCl2. Ответ: FeCl2. Происходит во всех случаях электрохимическая коррозия.
|
||||||||||||||||||||||
|
№ 78. Коррозия никелированной меди во влажном воздухе: при контакте Ni – Cu в нейтральной среде. При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В нейтральной среде его схема выглядит следующим образом: А (–) Ni | H2O, O2 | Cu (+) K Так как никель электрохимически более активен (см. ряд напряжений металлов), он будет окисляться (корродировать). На меди будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация): А (–): Ni – 2e- = Ni2+ K (+): 2H2O + O2 + 4e- = 4OH– Продукт коррозии – Ni(OH)2. Ответ: Ni(OH)2. Нарушение покрытия ускоряет скорость коррозии в том случае, если поверхность металла покрыта менее активным металлом. Это объясняется работой гальванического элемента менее активный металл – более активный металл. Трещины и царапины заполняются влагой, в результате чего образуются растворы, ионные процессы в которых облегчают протекание электрохимического процесса (коррозии). |
||||||||||||||||||||||
|
79. Цинковая пластина: Zn + CuSO4 → Cu↓ + ZnSO4 Zn0 - 2e → Zn2+ Cu2+ + 2e → Cu0 Железная пластина: Fe + CuSO4 → Cu↓ + FeSO4 Fe0 - 2e → Fe2+ Cu2+ + 2e → Cu0 При замыкании пластин: Стандартные электродные потенциалы железа и цинка: E0Fe2+/Fe = -0,44 B E0Zn2+/Zn = -0,76 B Т.к. E0Zn2+/Zn < E0Fe2+/Fe, железо будет катодом, а цинк - анодом. A: Zn0 - 2e → Zn2+ - окисление К: Cu2+ + 2e → Cu0 - восстановление На железе восстанавливается медь, а цинк растворяется. |
||||||||||||||||||||||
|
80. Протекторная защита от коррозии. Протекторная защита является разновидностью катодной защиты. К защищаемой конструкции присоединяют более электроотрицательный металл — протектор — который, растворяясь в окружающей среде, защищает от разрушения основную конструкцию. После полного растворения протектора или потери контакта с защищаемой конструкцией, протектор необходимо заменить. Протектор работает эффективно, если переходное сопротивление между ним и окружающей средой невелико. Действие протектора ограничивается определенным расстоянием. Максимально возможное удаление его от защищаемой конструкции называется радиусом защитного действия протектора. Протекторную защиту применяют в тех случаях, когда получение энергии извне для организации катодной защиты связано с трудностями, а сооружение специальных электролиний экономически невыгодно. Протекторную защиту применяют для борьбы с коррозией металлических конструкций в морской и речной воде, грунте и других нейтральных средах. Использование протекторов в кислых растворах нецелесообразно вследствие высокой скорости саморастворения. Однако использовать чистые металл в качестве протекторов не всегда целесообразно. Так, например, чистый цинк растворяется неравномерно из-за крупнозернистой дендритной структуры, поверхность чистого алюминия покрывается плотной оксидной пленкой, магний имеет высокую скорость собственной коррозии. Для придания протекторам требуемых эксплуатационных свойств в их состав вводят легирующие элементы. Cd, In, Gl,Hg,Tl,Mn,Si (от сотых до десятых долей процента), способствующие требуемому изменению параметров решетки. Магниевые протекторные сплавы в качестве легирующих добавок содержат А1 (5-7 %) и Zn (2-5 %); содержание таких примесей, как Fe, Ni, Cu,Pb, Si поддерживают на уровне десятых или сотых долей процента. Железо в качестве протекторного материала используют либо в чистом виде либо в виде углеродистых сталей. Алюминиевые протекторы применяют для защиты сооружений, эксплуатирующихся в проточной морской воде, а также для защиты портовых сооружений и конструкций, располагающихся в прибрежном шельфе.
|
||||||||||||||||||||||



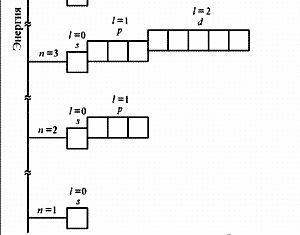
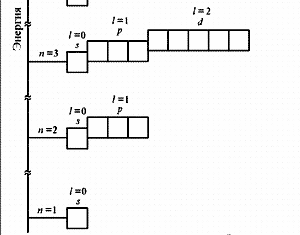

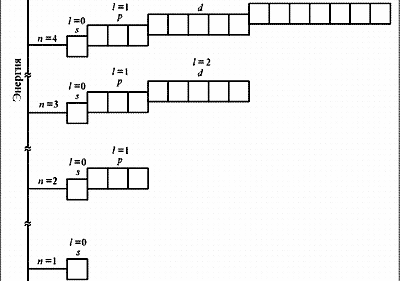

 или
или
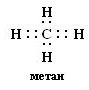 Атом
углерода в молекуле метана находится
в состоянии sp3-гибридизации.
Атом
углерода в молекуле метана находится
в состоянии sp3-гибридизации.
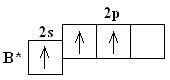
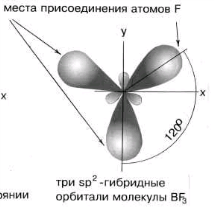
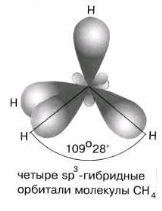





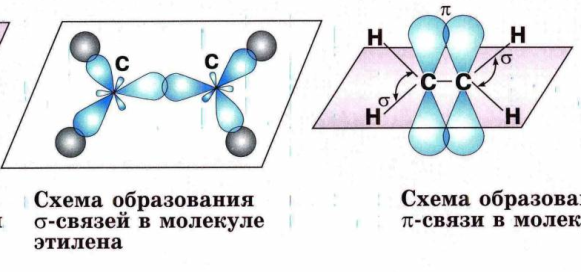
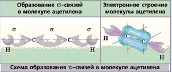





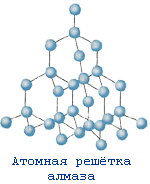
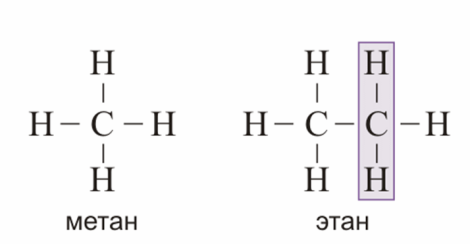

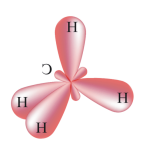 строение
молекулы метана
строение
молекулы метана
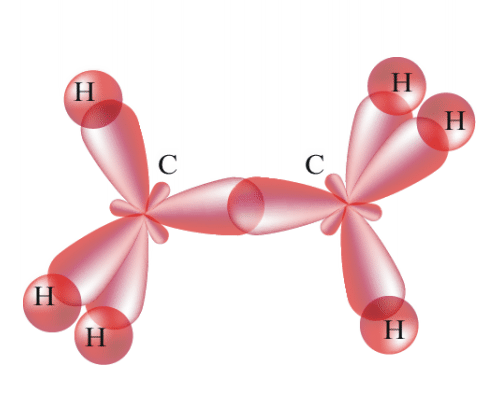 схема образования
-связи
в молекуле этана
схема образования
-связи
в молекуле этана
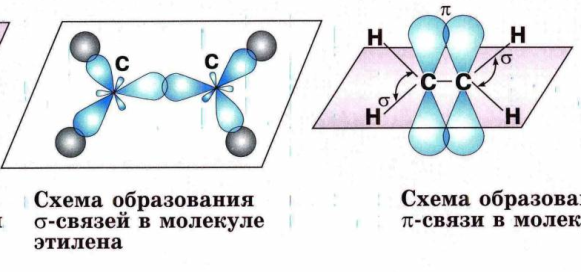
 В молекуле CH4
угол НСН такой же, как в математическом
тетраэдре: 109о28’.
Однако, этот метод не является
универсальным. Этому методу часто
предпочитают более простые по своей
структуре молекулярных орбиталей
методы.
В молекуле CH4
угол НСН такой же, как в математическом
тетраэдре: 109о28’.
Однако, этот метод не является
универсальным. Этому методу часто
предпочитают более простые по своей
структуре молекулярных орбиталей
методы.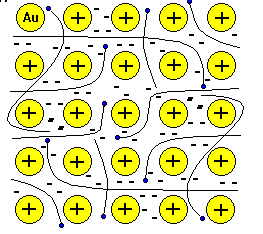
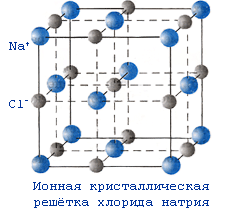
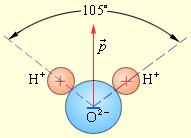 Дипольный
момент молекулы воды
Дипольный
момент молекулы воды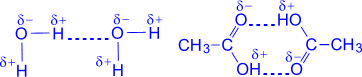 на схеме водородную
связь обозначают точками.
на схеме водородную
связь обозначают точками.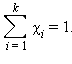



 ,
SO
,
SO
 ,
Cl
,
Cl ,
NO
,
NO ,
SO
,
SO