- •2. Уравнение правила фаз.
- •3. Геометрический образ уравнения состояния.
- •4. Однокомпонентные системы.
- •5. Двухкомпонентные системы.
- •5.1. Системы с неограниченной растворимостью
- •5.2. Системы с неограниченной растворимостью компонентов в жидком состоянии и ограниченной в твердом.
- •6. Трехкомпонентные системы.
- •VII Растворы.
- •1. Общая характеристика растворов и их классификация.
Чтобы рассчитать число степеней свободы системы нужно из общего числа параметров состояния вычесть число связывающих их уравнений.
2. Уравнение правила фаз.
Пусть рассматриваемая система состоит из f - фаз и k - компонентов, причем каждый из k - компонентов находится в каком-то количестве в каждой из f - фаз.
Давление и температура одинаковы для всех фаз данной системы, т.е. имеется два общих параметра состояния.
Так как каждый компонент находится в каждой фазе, то возможные концентрации компонентов во всех фазах:
![]() - для первого
компонента;
- для первого
компонента;
![]() - для второго
компонента;
- для второго
компонента;
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
![]() - для k - го компонента.
(6.1)
- для k - го компонента.
(6.1)
Число возможных
концентраций компонентов составит
величину k![]() f
. Итого, для рассматриваемой системы
общее число параметров состояния равно
(k
f
. Итого, для рассматриваемой системы
общее число параметров состояния равно
(k![]() f
+ 2), где цифра учитывает число общих
параметров для всех фаз данной системы
- давление и температуру.
f
+ 2), где цифра учитывает число общих
параметров для всех фаз данной системы
- давление и температуру.
Для каждой из фаз имеется свое уравнение состояния.
Например, для первой фазы это уравнение таково:
![]() .
(6.2)
.
(6.2)
Таких уравнений столько, сколько фаз в системе, т.е. f - штук.
Система находится
в состоянии термодинамического
равновесия, что означает равенство
химических потенциалов компонентов
(![]() )
во всех фазах системы, т.е.:
)
во всех фазах системы, т.е.:
![]() - для первого
компонента;
- для первого
компонента;
![]() - для второго
компонента;
- для второго
компонента;
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
![]() - для k - го компонента.
(6.3)
- для k - го компонента.
(6.3)
Число строк в матрице равно числу компонентов (k), а число столбцов равно (f - 1), тогда общее число уравнений составит:
k(f - 1).
Таким образом, общее число уравнений, связывающих значения химических потенциалов компонентов вычислится как
f + k(f - 1).
Согласно определению, число степеней свободы равно разности между общим числом параметров состояния и числом уравнений, связывающих эти параметры:
с = (k![]() f
+ 2) - [f
+ k(f
- 1)]
f
+ 2) - [f
+ k(f
- 1)]
или
с = k - f + 2. (6.4)
т. е. число степеней свободы равно разности между числом компонентов и фаз плюс два.
В системах без участия в равновесии газообразной фазы, один из параметров, общий для всех фаз системы, а именно давление, не оказывает влияние на равновесие в системе, если изменяется в небольших пределах и поэтому исключается из числа общих параметров состояния. Это положение применимо, в частности, к металлическим расплавам и поэтому уравнение правила фаз записывается в виде:
с = k - f + 1. (6.5)
Равновесие нонвариантно (безвариантно), если с = 0, моновариантно (одновариантно), если с = 1 и дивариантно (двухвариантно), если с = 2.
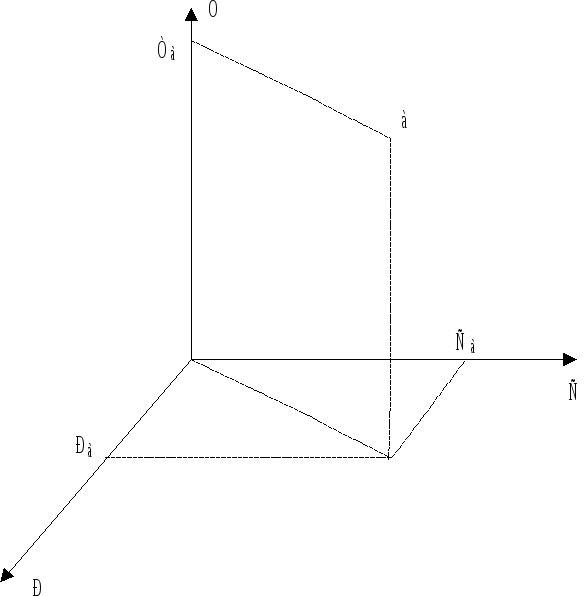
3. Геометрический образ уравнения состояния.
Ранее указывалось,
что состояние системы однозначно
определяется уравнением состояния вида
![]() .
В то же время численные значения
параметров конкретного состояния
определяют положение некоторой точки
(фигуративной точки) в трехмерной системе
координат Р - Т -С (рис. 6.1).
.
В то же время численные значения
параметров конкретного состояния
определяют положение некоторой точки
(фигуративной точки) в трехмерной системе
координат Р - Т -С (рис. 6.1).
Однако на практике нет необходимости всегда пользоваться трехмерным пространством для определения состояния системы, достаточно установить только два параметра, так как третий определится из уравнения состояния. Другими словами, для однозначного определения состояния системы достаточно определить положение фигуративной точки в двухмерной системе координат, например Р - Т или Т - С. Такое графическое изображение уравнения состояния системы носит название диаграммы состояния.
Важно заметить, что, несмотря на широкое использование в термодинамике уравнений состояния, они весьма приближенны, а все попытки их уточнения приводят к громозким формулам, работа с которыми затруднительна. Поэтому диаграммы состояния приобретают огромный интерес. С их помощью, используя экспериментальные данные, открывается возможность доступно и наглядно изображать в виде геометрических образов реальную взаимосвязь термодинамических параметров, определяющих состояние системы.