
ЗАГАЛЬНІ МЕТОДИЧНІ ВКАЗІВКИ
ДО ВИКОНАННЯ КОНТРОЛЬНИХ РОБІТ
При виконанні контрольних робіт із фізики слід дотримуватись низки дуже важливих правил.
1 Перед виконанням контрольної роботи, що пов’язана з певним розділом фізики, слід вивчити теоретичний матеріал усього розділу. Не слід намагатися розв’язати задачі, не засвоїв теорію. Рекомендовані підручники вказані в переліку літератури.
-
Перш за все слід переписати повністю умову задачі, а також записати її у скороченому вигляді, виразивши всі величини у Міжнародній системі одиниць (СІ). Виключення можна зробити тільки для тих величин, одиниці вимірювання яких, як видно відразу, скоротяться.
-
Розв’язання задач (особливо з механіки та електромагнетизму) частіше за все треба починати з рисунка. Вірний рисунок набагато полегшує розв’язання задачі. В деяких випадках він є основою розв’язку. Рисунок повинен бути чітким та акуратним, його не слід захаращувати цифрами. Використовуйте загально прийняті буквені позначки.
-
Після детального аналізу умови задачі та визначення суті фізичного явища, якому вона присвячена, обміркуйте, які закони та формули можна використати при розв’язанні. Якщо ви бачите декілька шляхів розв’язку, намагайтеся вибрати найбільш раціональний.
-
Починайте розв’язання завжди із загальновідомих законів та формул. Якщо формула не є загальновідомою, а стосується тільки конкретних умов задачі, її слід вивести. Обов’язково необхідно пояснити, що означають величини ( позначки величин), що входять до формули.
-
Задачу слід розв’язувати у загальному вигляді. Тільки після отримання для шуканої величини кінцевої формули до неї підставляють цифрові значення (в одиницях СІ) та проводять обчислення.
-
Одиниці вимірювання необхідно обов’язково перевірити. Це можна зробити двома способами:
А) підставити у формулу значення величин разом з одиницями вимірювання;
Б) підставити у формулу тільки числа, а потім, окремо, одиниці вимірювання та переконатися у відповідності отриманої розмірності одиницям вимірювання шуканої величини.
Якщо отримані одиниці вимірювання не відповідають шуканій величині, це означає, що при розв’язанні задачі допущена помилка. Таким чином, перевірка розмірності відповіді є додатковим методом самостійного контролю слушності розв’язання задачі.
-
Усі задачі розв’язуйте тільки в Міжнародній системі одиниць. Використання цієї системи в розділах з електрики та магнетизму пов’язане із записом формул у раціоналізованому вигляді. Винятки допускаються тільки у випадках, коли за умовою задачі необхідно визначити якусь величину в одиницях, що не входять до СІ (наприклад, енергію – в електрон-вольтах).
-
Розрахунок відповіді слід виконувати із ступенем точності, що відповідає точності завдання умови задачі. Наприклад, якщо в умові задана відстань 3,00 м, то відповідь треба обчислювати до трьох значущих цифр. Пам’ятайте, що відповідь, яка містить надлишок кількості цифр не краща за занадто (грубо) округлену.
-
Проведіть аналіз отриманого чисельного результату; подумайте, чи є він реальним, чи відповідає він законам фізики та здоровому глузду. Дотримання наведених правил допоможе вам успішно розв’язати всі задачі.
ВИМОГИ ДО ВИКОНАННЯ КОНТРОЛЬНИХ РОБІТ
-
За програмою студент повинен виконати 4 контрольних робіт.
-
Номера задач вибирають із таблиці із завданням до відповідної контрольної роботи за номером залікової книжки (шифру) студента та першими чотирма буквами українського алфавіту, якими позначені стовпчики таблиці.
Для цього треба записати число, яке складається з останніх двох цифр шифру, і дописати до них останні дві цифри результату його множення на “n” (таблиця А).
Таблиця А
|
Навчальний рік |
2005 /06 |
2006 /07 |
2007 /08 |
2008 /09 |
2009 /10 |
2010 /11 |
2011 /12 |
2012 /13 |
2013 /14 |
|
Число “n” |
5 |
6 |
7 |
8 |
9 |
10 |
1 |
2 |
3 |
Під отриманим чотирьохзначним числом слід підписати по порядку букви алфавіту. Тоді цифра, що відповідає кожній букві, вказуватиме на номер строки, із якої треба взяти номер задачі у відповідному стовпчику.
Наприклад,
номер залікової книжки студента 03257.
Відповідно таблиці А у 2005 – 06 навчальному
році n = 5. Тому останні дві цифри шифру
– 57 множимо на 5: 57![]() 5
= 285. Від результату беремо останні дві
цифри – 85 і дописуємо їх до 57. Отримане
чотирьохзначне число становить 5787.
Записуємо під ним по порядку букви
алфавіту
5
= 285. Від результату беремо останні дві
цифри – 85 і дописуємо їх до 57. Отримане
чотирьохзначне число становить 5787.
Записуємо під ним по порядку букви
алфавіту
5 7 8 5.
а б в г
Це означає, що зі стовпчика „а” треба взяти задачу із строки номер 5, зі стовпчика „б” – задачу із строки номер 7 і далі.
3. Вимоги до виконання та оформлення контрольної роботи:
1)Контрольні роботи виконуються у зошиті, на обкладинці якого приводяться відомості за зразком:
|
Варіант |
Номери задач |
|||||||
|
1 |
1.1 |
1.11 |
1.21 |
1.31 |
1.41 |
1.51 |
1.61 |
1.71 |
|
2 |
1.2 |
1.12 |
1.22 |
1.32 |
1.43 |
1.52 |
1.62 |
1.72 |
|
3 |
1.3 |
1.13 |
1.23 |
1.33 |
1.43 |
1.53 |
1.63 |
1.73 |
|
4 |
1.4 |
1.14 |
1.24 |
1.34 |
1.44 |
1.54 |
1.64 |
1.74 |
|
5 |
1.5 |
1.15 |
1.25 |
1.35 |
1.45 |
1.55 |
1.65 |
1.75 |
|
6 |
1.6 |
1.16 |
1.26 |
1.36 |
1.46 |
1.56 |
1.66 |
1.76 |
|
7 |
1.7 |
1.17 |
1.27 |
1.37 |
1.47 |
1.57 |
1.67 |
1.77 |
|
8 |
1.8 |
1.18 |
1.28 |
1.38 |
1.48 |
1.58 |
1.68 |
1.78 |
|
9 |
1.9 |
1.19 |
1.29 |
1.39 |
1.49 |
1.59 |
1.69 |
1.79 |
|
0 |
1.10 |
1.20 |
1.30 |
1.40 |
1.50 |
1.60 |
1.70 |
1.80 |
|
|
а |
б |
в |
г |
а |
б |
в |
г |
Приклади розв’язання задач Приклад 1. Знайти густину кисню при нормальних умовах.
Розв’язання
Застосуємо рівняння Менделєєва – Клапейрона (2.3)
![]() (1)
(1)
де P – тиск газу, V – об’єм газу; m – маса газу; M – молярна маса газу; R – газова постійна; T – термодинамічна температура.
Густина речовини
![]() (2)
(2)
Розв’язуємо сумісно (1) і (2). Для цього з (2) виразимо m і підставимо в (1)
![]() або
або ![]()
звідки ![]()
Перевіримо одиницю вимірювання
![]()
Підставимо числові дані.
При
нормальних умовах P = 760 мм. рт. ст.
![]() ,
T = 0
С = 273К;
,
T = 0
С = 273К;
R
= 8,31 Дж / (моль
K), M =
![]() .
.
![]()
Відповідь
![]()
Приклад2. Скільки молекул міститься у посудині ємністю 5л, заповненому вуглекислим газом? Температура у посудині 127 С, тиск 0,1 МПа.
Розв’язання
Кількість
молекул ![]() ,
,
де
– кількість речовини;
![]() – постійна Авогадро.
– постійна Авогадро.
Кількість речовини знайдемо, скориставшись рівнянням Менделєєва – Клапейрона (2.3)
![]()
де P – тиск газу, V – об’єм газу; R – газова постійна;
T – термодинамічна температура.
![]()
Тоді ![]()
Перевіримо одиницю вимірювання.
![]() (безрозмірна
величина).
(безрозмірна
величина).
Підставимо числові дані, виразивши їх в системі Сі
![]()
Т = 127 + 273 = 400К
![]()
![]()
Відповідь ![]()
Приклад 3. У балоні об’ємом 5л міститься гелій під тиском 2МПа і температурі 127 С. Після того як з балону було взято деяку масу гелію, температура у балоні зменшилась на 10 градусів, а тиск зменшився до 1,5 МПа. Яку масу гелію було взято з балону?
Розв’язання
Скористаємось рівнянням Менделєєва – Клапейрона (2.3) записавши його для початкового і кінцевого станів газу у балоні.
![]() (1)
(1)
![]() (2)
(2)
де
![]() ,
,
![]() ,
,
![]() – тиск, маса, термодинамічна температура
у початковому стані;
– тиск, маса, термодинамічна температура
у початковому стані;
![]() ,
,
![]() ,
,
![]() – відповідні величини у кінцевому
стані; V – об’єм балону;
– молярна маса гелію; R – газова
постійна.
– відповідні величини у кінцевому
стані; V – об’єм балону;
– молярна маса гелію; R – газова
постійна.
З
(1) виразимо
![]() ,
з (2) виразимо
,
з (2) виразимо
![]() .
.
![]()
![]()
Тоді
![]()
Перевіримо одиницю вимірювання
![]()
Знайдемо числове значення з урахуванням того, що
![]()
R = 8,31 Дж / (моль K),
![]()
![]()
M
=
![]() .
.
![]()
Відповідь
![]() = 2,77г.
= 2,77г.
Приклад
4.
У посудині об’ємом V =25л міститься
![]() =100г
гелію і
=100г
гелію і
![]() =140г
азоту при температур t =27
=140г
азоту при температур t =27![]() .
Знайти тиск у посудині.
.
Знайти тиск у посудині.
Розв’язання
Скористаємося законом Дальтона (2.8), згідно з яким тиск у суміші газів дорівнює сумі парціальних тисків.
![]() ,
(1)
,
(1)
де
![]() і
і
![]() (2)
(2)
![]() і
і
![]() -
малярні маси гелію і азоту відповідно.
-
малярні маси гелію і азоту відповідно.
Підставимо (2) в (1).
![]()
Перевіримо одиницю вимірювання.
![]()
Обчислення.
![]() Па
Па
Відповідь:Р=2,99 МПа.
Приклад
5.
Знайти густину ρ деякого газу,
якщо тиск Р у балоні 380 мм рт. ст. , а
середня квадратична швидкість руху
його молекул
![]() =800м/с.
=800м/с.
Розв’язання
Середня квадратична швидкість теплового руху молекул газу за формулою (2.16) дорівнює
![]()
![]() ,
(1)
,
(1)
де
![]() ;
Т – абсолютна температура; M– молярна
маса газу.
;
Т – абсолютна температура; M– молярна
маса газу.
Звідки ![]()
![]()
![]() .
(2)
.
(2)
Порівняємо з рівнянням Менделєєва-Клапейрона
![]() (3)
(3)
З
(2) виразимо
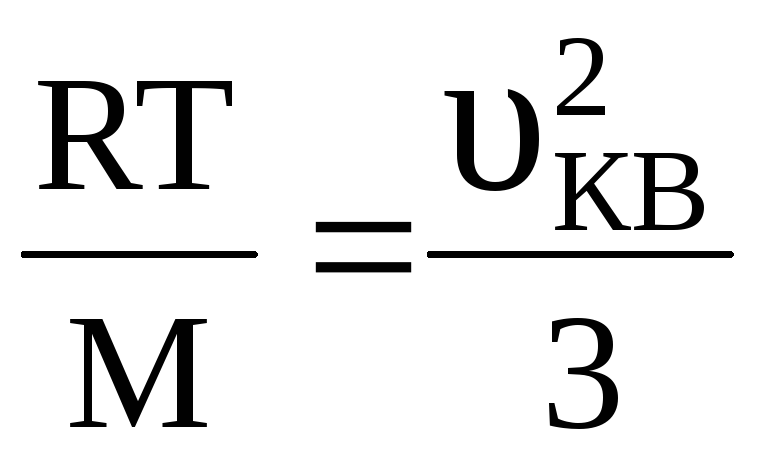 і підставимо в (3):
і підставимо в (3):
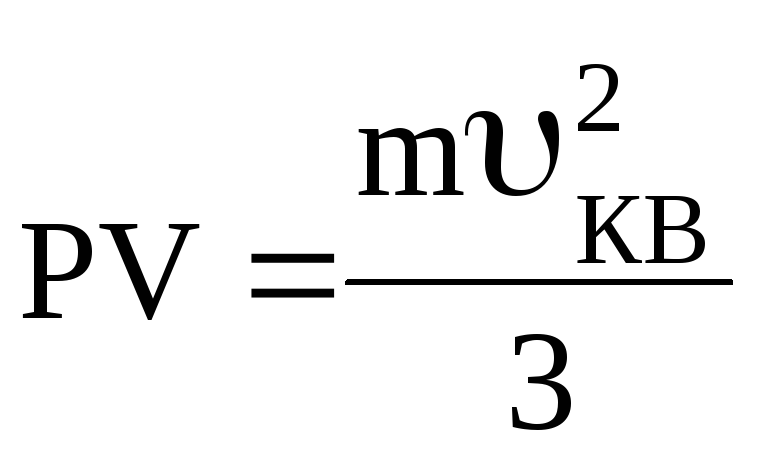 ,
або
,
або
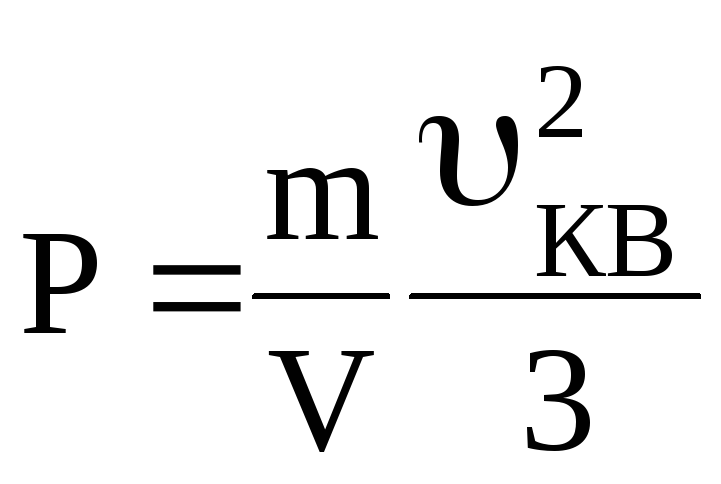 (4)
(4)
За визначенням густина ρ= m/V, тому з (4)
ρ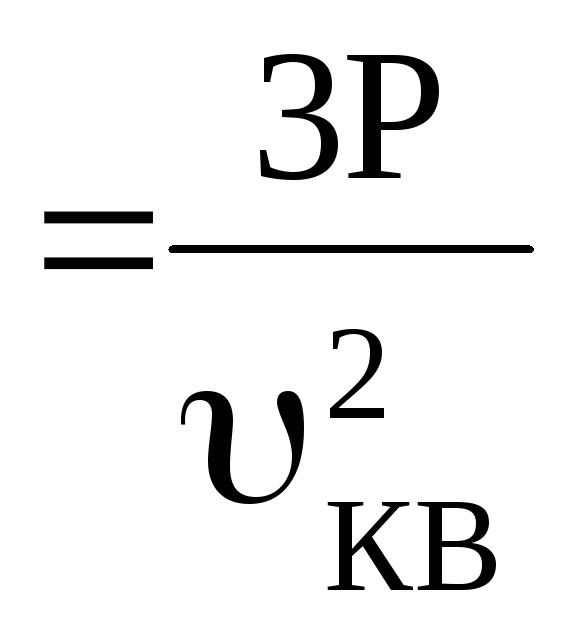 .
(5)
.
(5)
Перевіримо одиницю вимірювання.
[ρ]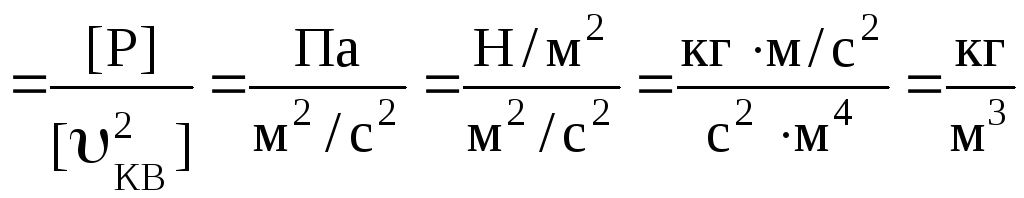 .
.
Переведемо
тиск у одиницю вимірювання в системі
![]() :
:
P=380
мм рт. ст.
![]() 133
= 0,5
133
= 0,5![]() Па.
Па.
Підставимо у (5) числові дані
ρ![]() кг/
кг/![]() .
.
Відповідь:
ρ=0,23 кг/![]() .
.
Приклад
6. Визначити
середню довжину вільного пробігу
![]() молекул азоту при нормальних умовах, а
також середнє число зіткнень
молекул азоту при нормальних умовах, а
також середнє число зіткнень
![]() молекули за одну секунду при даних
умовах.
молекули за одну секунду при даних
умовах.
Розв’язання
Середню довжину вільного пробігу молекул можна визначити за допомогою співвідношення (2.17):
де
![]() - ефективний діаметр молекули. Із таблиць
визначаємо, що для азоту
- ефективний діаметр молекули. Із таблиць
визначаємо, що для азоту
![]() =
=![]() м;
м;
n – концентрація молекул при даних умовах.
Концентрація молекул можна зв’язати з параметрами стану газу за допомогою рівняння (2.13):
P
=
nkT,
звідки
![]() ,
(2)
,
(2)
де Р – тиск газу; Т – термодинамічна температура; k – постійна Больцмана.
Підставимо (2) у (1)
![]()
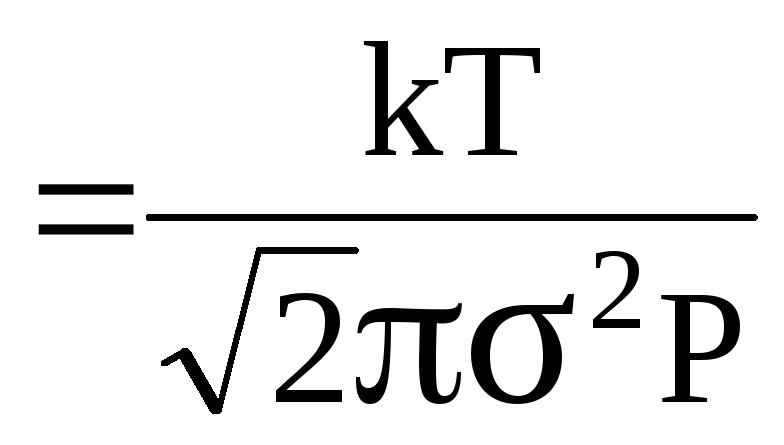 .
(3)
.
(3)
Перевіримо одиницю вимірювання
![]() .
.
Для
нормальних умов Т=273 К і Р=![]() Па, k=
Па, k=![]() Дж/К.
Дж/К.
Обчислення.
![]() =
=![]() м.
м.
Середнє число зіткнень кожної молекули за 1 сек. можна визначити за формулою (2.18).
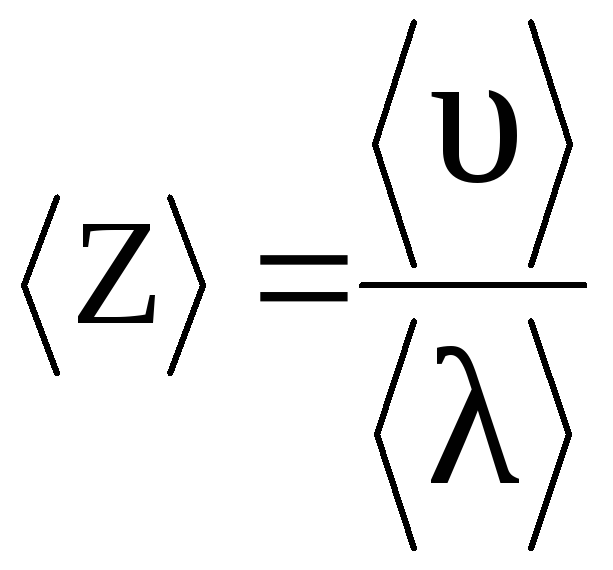 ,
(4)
,
(4)
де
![]() - середня арифметична швидкість теплового
руху молекул;
- середня арифметична швидкість теплового
руху молекул;
![]() - середня довжина вільного пробігу
молекул, яку вже визначено за формулою
(3).
- середня довжина вільного пробігу
молекул, яку вже визначено за формулою
(3).
Середню арифметичну швидкість молекул знайдемо за допомогою формули (2.15).
 м/с.
м/с.
Підставимо
значення
![]() і
і
![]() у (4)
у (4)
![]()
![]() .
.
Відповідь:
![]() м;
м;
![]()
![]() .
.
Приклад
7. Знайти
енергію W обертального руху молекул,
які містяться у
![]() =2
кг водню при температурі t=27
=2
кг водню при температурі t=27![]() .
.
Розв’язання
Кількість молекул, які містяться у даній масі газу, згідно з (2.2)
![]() ,
(1)
,
(1)
де
![]() - кількість речовини, а
- кількість речовини, а
![]() - постійна Авогадро.
- постійна Авогадро.
У
свою чергу
![]() ,
де M – малярна маса.
,
де M – малярна маса.
Тоді ![]() .
(2)
.
(2)
Так
як молекула водню
![]() складається з двох атомів і має між ними
жорсткий зв'язок, кількість ступенів
свободи для такої молекули i=5 з них 2
припадає на обертальний рух:
i=2.
Середня кінетична енергія однієї
молекули (2.12)
складається з двох атомів і має між ними
жорсткий зв'язок, кількість ступенів
свободи для такої молекули i=5 з них 2
припадає на обертальний рух:
i=2.
Середня кінетична енергія однієї
молекули (2.12)
![]() ,
(3)
,
(3)
де k – постійна Больцмана; Т – термодинамічна температура.
Тоді загальна енергія обертального руху всіх молекул
![]() ,
або
,
або
![]() .
.
Так
як
![]() ,
де k – газова постійна,
,
де k – газова постійна,
![]() .
(4)
.
(4)
Перевіримо одиницю вимірювання
![]() .
.
Підставимо
числові дані, зважаючи на те, що i=2;
М=![]() кг/моль;
Т=27
кг/моль;
Т=27![]() +273=300
К; R=8,31Дж/
+273=300
К; R=8,31Дж/![]() .
.
![]() Дж.
Дж.
Відповідь:
W=
![]() Дж.
Дж.
Приклад
8. Вуглекислий
газ масою m=66г, який має температуру t=![]() ,
ізотермічно розширюється так, що його
об’єм збільшується вдвічі. Яку роботу
виконує при цьому газ?
,
ізотермічно розширюється так, що його
об’єм збільшується вдвічі. Яку роботу
виконує при цьому газ?
Розв’язання
Роботу, яку виконує газ, можна знайти, скориставшись формулою (2.24):
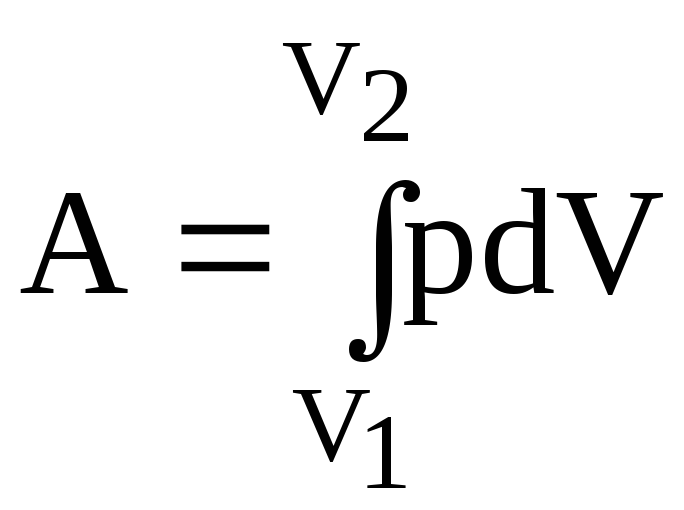 .
(1)
.
(1)
Так як під час ізотермічного процесу тиск Р теж змінюється, виразимо тиск через об’єм газу з рівняння Менделєєва – Клапейрона (2.3):
![]() ,
звідки
,
звідки
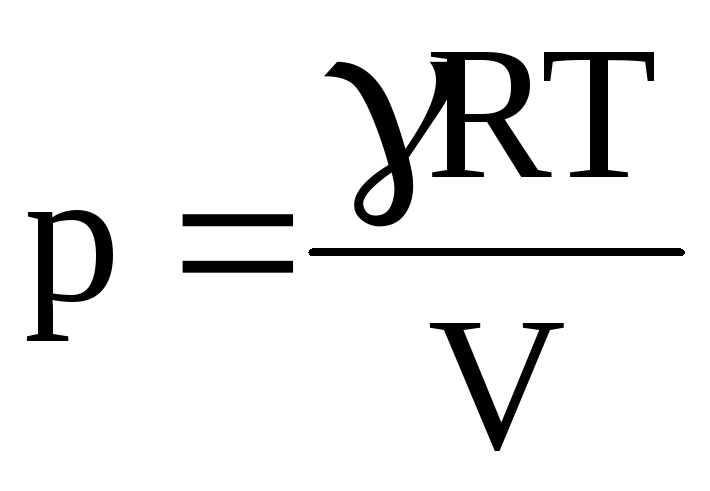 .
(2)
.
(2)
Підставимо (2) у (1) і виконаємо інтегрування:
 .
(3)
.
(3)
Зважаючи
на те , що
![]() =m/M,
маємо
=m/M,
маємо
![]() .
.
Перевіримо одиницю вимірювання
![]() .
.
З
урахуванням того, що за умовою задачі
![]() і крім того
і крім того
m=66г=![]() кг;
кг;
Т=7+273=280К;
![]() кг/моль.
кг/моль.
одержимо
![]() Дж=2,41
кДж.
Дж=2,41
кДж.
Відповідь: А=2,41 кДж.
Приклад
9.
При ізобаричному нагріванні m=6г водню
з початковою температурою t=![]() ,
його об’єм зріс у два рази (
,
його об’єм зріс у два рази (![]() ).
Знайти: 1) роботу А газу; 2) зміну внутрішньої
енергії
).
Знайти: 1) роботу А газу; 2) зміну внутрішньої
енергії
![]() газу; 3) кількість теплоти Q, яку надано
газу.
газу; 3) кількість теплоти Q, яку надано
газу.
Розв’язання
Робота газу при ізобаричному нагріванні (2.25):
![]() .
.
Скористаємося рівнянням Менделєєва – Клапейрона, записавши його двічі: для початкового і кінцевого станів.
![]() (1)
(1)
![]() (2)
(2)
З (2) віднімаємо (1)
![]() ,
або
,
або
![]() .
(3)
.
(3)
Різницю температур можна знайти з (2.26):
При
Р=const
![]() ;
за умовою задачі
;
за умовою задачі
![]() ,
тому
,
тому
![]() .
Тобто
.
Тобто
![]() К.
К.
Тоді
![]() К.
К.
Робота
газу
![]() Дж =7,48 кДж.
Дж =7,48 кДж.
Внутрішня енергія газу визначається за формулою (2.23).
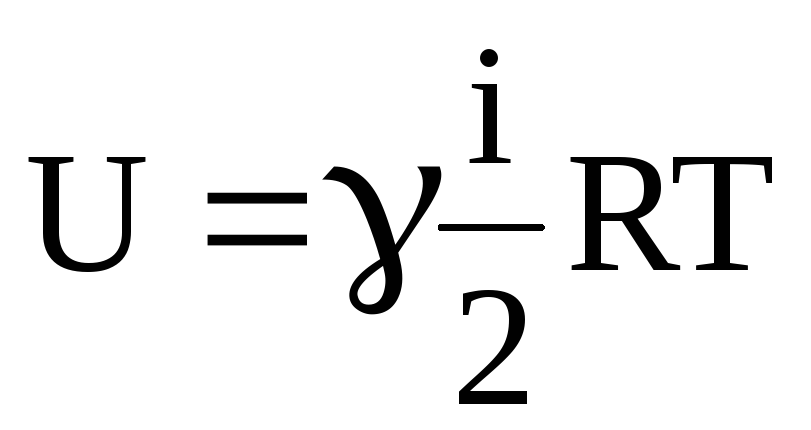 ,
,
Тоді
зміна внутрішньої енергії 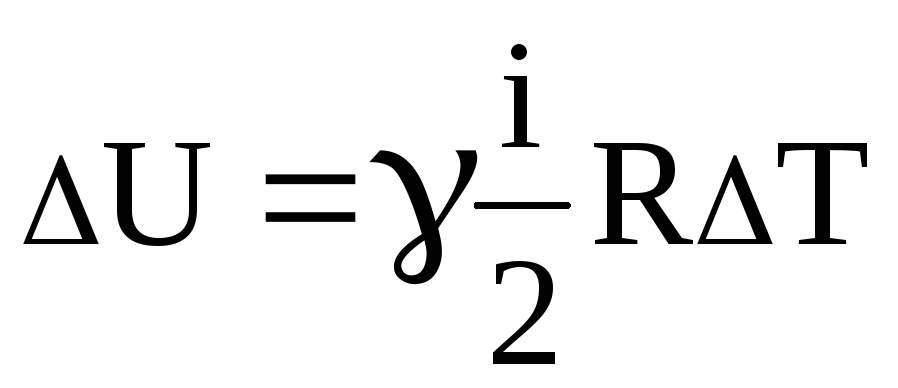 ,
(4)
,
(4)
де
i – кількість ступені свободи; для водню
![]() (двохатомна молекула) і=5.
(двохатомна молекула) і=5.
Обчислення:
![]() Дж
= 18,68 кДж.
Дж
= 18,68 кДж.
Згідно з першим началом термодинаміки (2.22)
![]()
Тому
![]() кДж.
кДж.
Відповідь:
А=7,48 кДж;
![]() =18,68
кДж; Q=26,16 кДж.
=18,68
кДж; Q=26,16 кДж.
Приклад
10.
Ідеальна теплова машина працює за
циклом Карно. Температура нагрівача
![]() =400
К, охолоджувача
=400
К, охолоджувача
![]()
![]() =300
К. За кожен цикл машина отримує від
нагрівача кількість теплоти
=300
К. За кожен цикл машина отримує від
нагрівача кількість теплоти
![]() =2,1
кДж. Визначити коефіцієнт корисної дії
=2,1
кДж. Визначити коефіцієнт корисної дії
![]() машини і корисну роботу А, яку виконує
машина за один цикл.
машини і корисну роботу А, яку виконує
машина за один цикл.
Розв’язання
Коефіцієнт корисної дії можна визначити або за формулою (2.29)
![]() , (1)
, (1)
або (для циклу Карно) за формулою (2.30)
![]() (2)
(2)
Спочатку за формулою (2) знайдемо коефіцієнт корисної дії
![]() .
.
Потім за формулою (1) знайдемо А.
![]() =525
Дж.
=525
Дж.
Відповідь:
![]() =25%;
А=525 Дж.
=25%;
А=525 Дж.
Приклад
11.
m=10г водню ізобарично нагрівають від
![]() до
до
![]() .
Знайти зміну ентропії газу
.
Знайти зміну ентропії газу
![]() у цьому процесі.
у цьому процесі.
Розв’язання
Згідно з (2.31) зміна ентропії визначається за формулою
 , (1)
, (1)
де
![]() і
і
![]() - значення ентропії відповідно у кінцевому
і у початковому станах;
- значення ентропії відповідно у кінцевому
і у початковому станах;
![]() - кількість теплоти, яку отримує газ у
елементарному процесі; Т – термодинамічна
температура, при якій відбувалась
теплопередача.
- кількість теплоти, яку отримує газ у
елементарному процесі; Т – термодинамічна
температура, при якій відбувалась
теплопередача.
При ізобаричному процесі
![]() , (2)
, (2)
де
![]() - молярна теплоємність водню при
ізобаричному нагріванні;
- молярна теплоємність водню при
ізобаричному нагріванні;
![]() - кількість речовини; dT – збільшення
температури.
- кількість речовини; dT – збільшення
температури.
У свою чергу
![]() , (3)
, (3)
де
i – ступені свободи молекул (для водню
![]() i=5); R – газова стала. R=8,31
i=5); R – газова стала. R=8,31
![]() .
.
 , (4)
, (4)
де
m – маса газу; M– молярна маса газу. Для
водню M=![]() кг/моль.
кг/моль.
Підставимо (2), (3), (4) у (1) і виконаємо інтегрування:
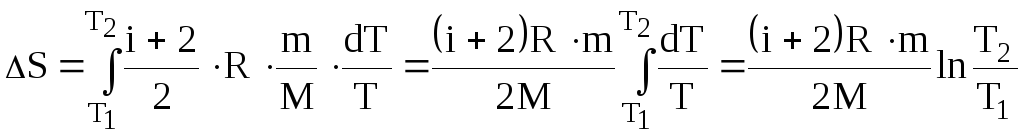 .
.
Виразимо
температури
![]() і
і
![]() у кельвінах (К):
у кельвінах (К):
![]() К;
К;
![]() 327+273=600
К.
327+273=600
К.
Обчислення.
![]() 100
Дж/К.
100
Дж/К.
Відповідь:
![]() =100
Дж/К.
=100
Дж/К.
Приклад
12.
Коефіцієнт внутрішнього тертя азоту
при нормальних умовах дорівнює
![]() =1,78
=1,78![]()
![]() .
Знайти коефіцієнт дифузії азоту D при
цих умовах.
.
Знайти коефіцієнт дифузії азоту D при
цих умовах.
Розв’язання
Скористаємося
формулами для коефіцієнтів D і
![]() (2.35):
(2.35):
![]() (1)
(1)
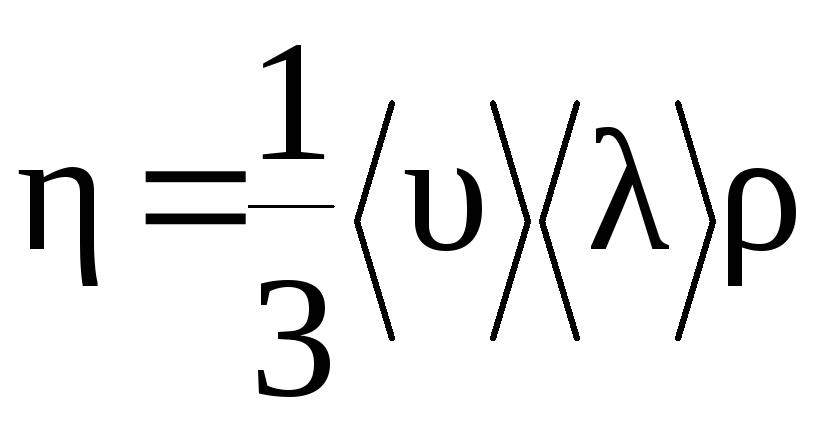 (2)
(2)
де
![]() - середня арифметична теплового руху
молекул;
- середня арифметична теплового руху
молекул;
![]() - середня довжина вільного пробігу
молекул;
- середня довжина вільного пробігу
молекул;
![]() - густина газу.
- густина газу.
З порівняння (1) і (2) випливає, що
![]() =D
=D![]() . (3)
. (3)
Таким чином, для знаходження коефіцієнту дифузії азоту треба знайти його густину при нормальних умовах. З цією метою скористаємося рівнянням Менделєєва – Клапейрона (2.3):
![]() (4)
(4)
За
визначенням густина речовини
![]() =m/V,
тому виразимо звідси m і підставимо у
(4):
=m/V,
тому виразимо звідси m і підставимо у
(4):
![]() ,
,
звідки
![]() . (5)
. (5)
Тоді рівняння (3) з урахуванням співвідношення (5) має вигляд:
![]() ,
звідки
,
звідки
 .
.
Перевіримо одиницю вимірювання.
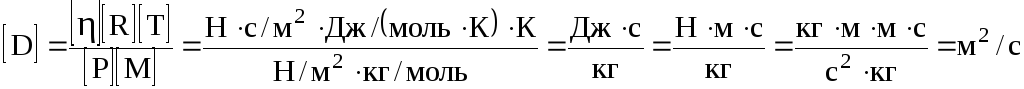 Обчислення
проводимо з урахуванням того що при
нормальних умовах Р=760 мм рт. ст. =
Обчислення
проводимо з урахуванням того що при
нормальних умовах Р=760 мм рт. ст. =
![]() Па; Т=
Па; Т=![]() +273=273
К;
+273=273
К;
R=8,31
Дж/![]() ;
M=28
;
M=28![]() кг/моль.
кг/моль.
![]()
![]()
Відповідь:
В=1,44![]()
![]() .
.
Приклад
13.
Яка частина молекул азоту при температурі
t=![]() має швидкості від
має швидкості від
![]() =300м/с
до
=300м/с
до
![]() =310м/с?
=310м/с?
Розв’язок
Розподіл молекул по швидкостям має вигляд (2.36):
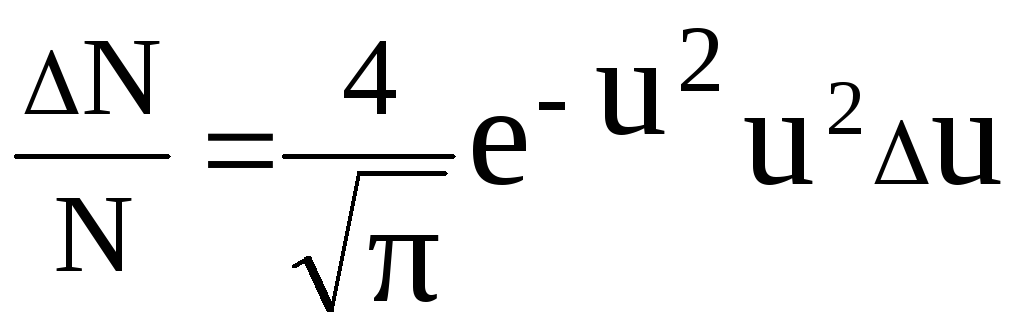 , (1)
, (1)
де
![]() –
відносна швидкість. Вона дорівнює
–
відносна швидкість. Вона дорівнює

де
![]() - швидкість молекули;
- швидкість молекули;
![]() - найбільш імовірна швидкість молекул.
За формулою (2.16)
- найбільш імовірна швидкість молекул.
За формулою (2.16)
![]()
У нашому випадку
![]() м/с.
м/с.
Тоді,
![]() ;
;
![]() ;
;
![]() ;
;
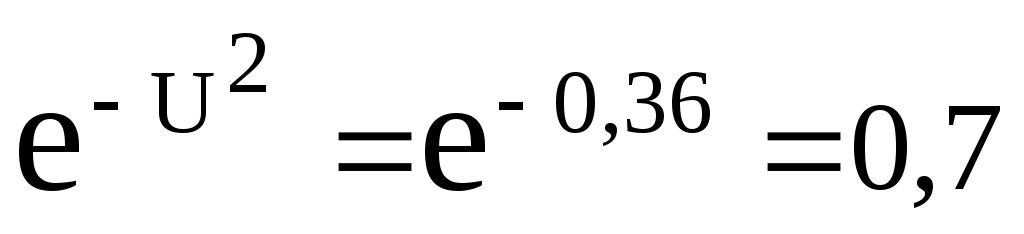
і формула (1) дає:
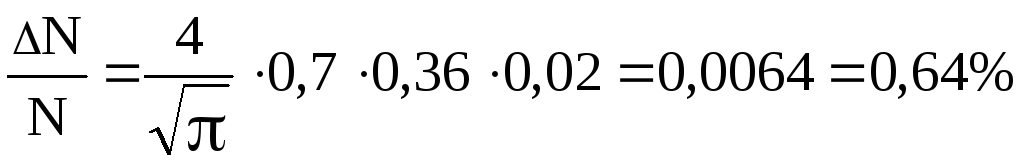
Відповідь:
![]() =0,64%.
=0,64%.
Приклад
14.
На якій висоті h атмосферний тиск Р
складає 50% від тиску на рівні моря?
Температуру вважати постійною і рівною
t=![]() ,
молярну масу для повітря вважати рівною
M=0,029 кг/моль.
,
молярну масу для повітря вважати рівною
M=0,029 кг/моль.
Розв’язання
Залежність атмосферного тиску від висоти над рівнем моря представлена барометричною формулою (2.37):
![]() , (1)
, (1)
де
Р – тиск на висоті h;
![]() -
тиск на рівні моря; M– молярна маса
повітря; g=9,8
-
тиск на рівні моря; M– молярна маса
повітря; g=9,8
![]() - прискорення сили тяжіння; R=8,31 Дж/
- прискорення сили тяжіння; R=8,31 Дж/![]() - газова постійна; Т – теплодинамічна
температура.
- газова постійна; Т – теплодинамічна
температура.
Поділимо обидві частини рівняння (1) на Р:
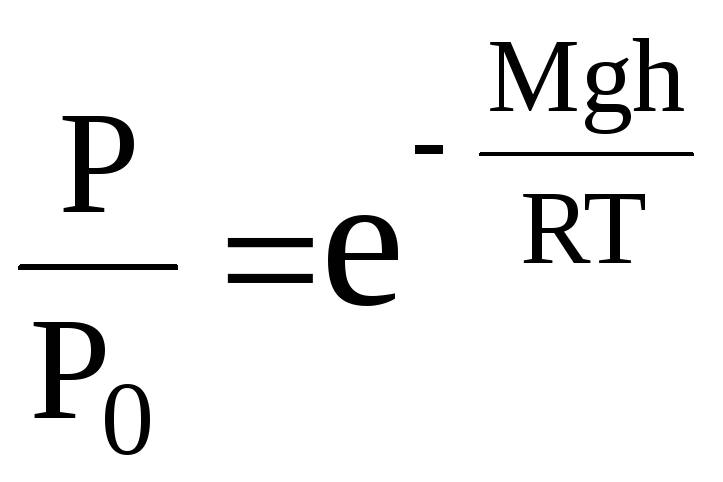 ,
звідки
,
звідки
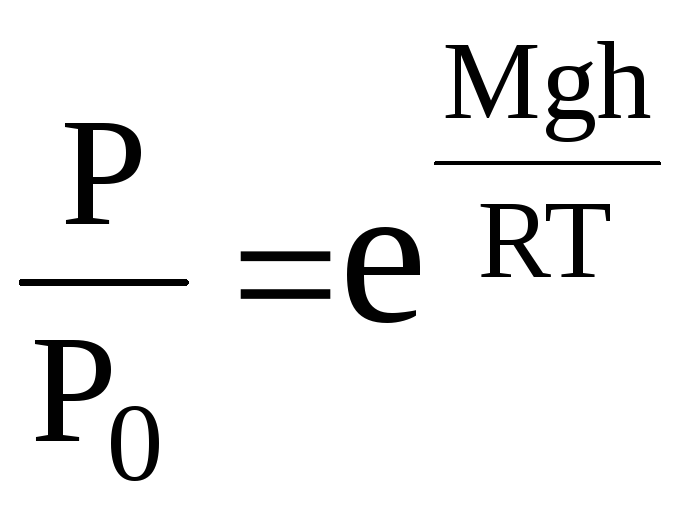 .
.
За
умовою задачі
![]() =2,
тому
=2,
тому ![]() .
(2)
.
(2)
Логарифмуємо вираз (2):
Ошибка! Объект не может быть создан из кодов полей редактирования., звідки
![]() .
(3)
.
(3)
Перевіримо одиницю вимірювання.
![]() .
.
Підставимо у (3) числові дані:
![]() м
=5,53 км.
м
=5,53 км.
Відповідь: h=5,53 км.
Приклад 15. Дві краплині ртуті радіусом r=1 мм кожна, зливаються в одну. Скільки теплоти Q при цьому виділяється?
Розв’язання
Кількість
теплоти Q дорівнює енергії
![]() ,
яка звільнюється тому, що зменшилося
площа поверхні. Цю енергію можна знайти
з формули (2.41):
,
яка звільнюється тому, що зменшилося
площа поверхні. Цю енергію можна знайти
з формули (2.41):
![]() , (1)
, (1)
де
![]() - коефіцієнт поверхневого натягу ртуті;
- коефіцієнт поверхневого натягу ртуті;
![]() - площа, на яку зменшилась поверхня
однієї краплі порівняно з площею поверхні
двох попередніх.
- площа, на яку зменшилась поверхня
однієї краплі порівняно з площею поверхні
двох попередніх.
![]() , (2)
, (2)
де r – радіус маленької краплі; R – радіус великої краплі.
Радіус великої краплі можна знайти з тих міркувань, що об’єм великої краплі повинен дорівнювати двом об’ємам малої краплі.
![]() ;
звідки
;
звідки
![]() .
.
Підставимо у (2):
![]() .
.
Тоді
![]() .
.
Перевіримо одиницю вимірювання:
![]() .
.
Коефіцієнт поверхневого натягу для ртуті знаходимо з таблиць.
![]() =0,5
Н/м.
=0,5
Н/м.
Обчислення.
![]() Дж
= 2,57 мкДж.
Дж
= 2,57 мкДж.
Відповідь: Q=2,57 мкДж.
