
- •8.Конструктивний та енергетичний метаболізм. Принцип „біохімічної єдності".
- •9. Перелічіть відомі вам критерії класифікації вірусів за біологічними властивостями
- •15. Мікроелементи. Фактори росту. Поняття про ауксотрофію.
- •Віруси класифікуються на ті, що містять днк (вірус простого герпесу) і ті, що містять рнк (вірус імунодефіциту людини).
- •Основные критерии таксономической классификации вирусов
- •Вирусологические исследования
- •Структура антитіл
- •Специфичность антител
- •Функции антител
- •26. Поняття про імунітет. Види імунітету
- •Различают два типа иммунитета: специфический (адаптивным,приобретённым, специфическим) и неспецифический (врождённым (включая неспецифическую резистентность).
- •I. Механізмы природнього імунитету, включаючи неспеціфичну резистентність:
- •Клеточный иммунный ответ
- •Три этапа приобретённой иммунной защиты Распознавание антигенов
- •Иммунный ответ
- •Г). Элективные (избирательные) среды
- •Литический каскад и лизогенная репрессия
- •Лабораторная диагностика подвижности бактерий
- •Искусственно приобретённый иммунитет
- •Лимфоциты
- •Функции интерферона (ифн)
- •Механизм антивирусного действия интерферона (ифн)
- •Бактериальный геном
- •Бактериальные рибосомы
- •Запасные гранулы бактерии
Типи екологічних взаємовідносин між мікроорганізмами
Микроорганизмы жёстко конкурируют между собой. Это связано с тем, что обитающие в конкретном биоценозе микробы обладают принципиально сходными потребностями в источниках энергии и питания. Каждый микроорганизм приспосабливается не только к неживым субстратам, но и к другим окружающим его организмам. Подобная адаптация иногда приводит к приобретению особых метаболических свойств, наделяющих обладателя способностью занимать специфические ниши. Например, нитрифицирующие бактерии могут расти без органических источников энергии, окисляя аммиак или нитриты в качестве источника энергии в отсутствие света; другие организмы в подобных условиях не развиваются. Поэтому нитрифицирующие бактерии не испытывают биологической конкуренции. Значительная часть бактерий участвует в конкурентной борьбе, адаптируясь к сосуществованию с другими формами жизни либо вступая с ними в противодействие.
Симбіоз — взаємно корисне співіснування організмів різних видів. Прикладом є співжиття молочнокислих бактерій і дріжджів. Бактерії утворюють молочну кислоту, яка підкислює середовище, створюючи сприятливі умови для росту дріжджів. Останні синтезують ростові речовини, необхідні для розвитку бактерій. Інші приклади симбіозу — лишайник (симбіоз водорості й гриба), бульбочкові бактерії та бобові рослини. Симбиоз [от греч. symbiosis, совместное проживание] — совместное длительное существование микроорганизмов в долгоживущих сообществах. Взаимоотношения, при которых микроорганизм располагается вне клеток хозяина (более крупного организма), известны как эктосимбиоз; при локализации внутри клеток — как эндосимбиоз.
Типичные эктосимбиотические микробы — Escherichia coli, бактерии родов Bacteroides и Bifidobacterium, Proteus vulgaris, a также другие представители кишечной микрофлоры. Как пример эндосимбиоза можно рассматривать плазмиды, обеспечивающие, например, резистентность бактерий к ЛС. Симбиотические отношения также разделяют по выгоде, получаемой каждым из партнёров.
Мутуализм [от лат. mutuus, взаимный] — взаимовыгодные симбиотические отношения. Так, микроорганизмы вырабатывают БАБ, необходимые организму хозяина (например, витамины группы В). При этом обитающие в макроорганизмах эндо- и эктосимбионты защищены от неблагоприятных условий среды (высыхания и экстремальных температур) и имеют постоянный доступ к питательным веществам. Наприклад взаємовідносини між мікрофлорою рубця жуйних і організмом тварини. Бактерії розкладають клітковину в рубці до сполук, які засвоюються організмом хазяїна, а останній забезпечує бактерії поживними речовинами і захищає їх від несприятливих умов. Из всех видов мутуализма наиболее удивительно культивирование некоторых грибов насекомыми (жуками и термитами). С одной стороны, это способствует более широкому распространению грибов, с другой — обеспечивает постоянный источник питательных веществ для личинок. Это напоминает выращивание человеком полезных растений и микроорганизмов.
Комменсализм — разновидность симбиоза, при которой выгоду извлекает только один партнёр (не принося видимого вреда другому); микроорганизмы, участвующие в таких взаимоотношениях. — комменсалы [от лат. сот-, с, + mensa, стол; буквально — сотрапезники]. Микроорганизмы-комменсалы колонизируют кожные покровы и полости организма человека (например, ЖКТ), не причиняя «видимого» вреда; их совокупность — нормальная микробная флора (естественная микрофлора). Типичные эктосимбиотические организмы-комменсалы — кишечная палочка, бифидобактерии, стафилококки, лактобациллы. Многие бактерии-комменсалы принадлежат к условно-патогенной микрофлоре и способны при определённых обстоятельствах вызывать заболевания макроорганизма (например, при внесении их в кровоток во время медицинских манипуляций).
Метабіоз — взаємовідносини між мікробами, при яких продукти метаболізму одного виду прокаріотів використовуються як пожива або енергетичний матеріал іншим видом мікробів. Наприклад, амоніфікатори розкладають білки з утворення NН3, який використовується нітрифікуючими бактеріями.
Синергізм. При цій формі взаємовідносин у симбіонтів взаємно посилюються фізіологічні функції і виникають нові властивості. Це явище можна спостерігати при співжитті оцтовокислих бактерій і дріжджів. Бактерії перетворюють цукри на кислоти, які використовуються дріжджами, а останні забезпечують бактерії вітамінами.
Сратегія реплікації ретровірусів (подив.в зошиті)
Ретровирусы. Геном представлен двумя идентичными молекулами (+)РНК. Вместо того чтобы функционировать как мРНК, геном транскрибируется с помощью вирионной обратной транскриптазы, с образованием гибридной молекулы РНК-ДНК. Затем на (-)ДНК синтезируется (+)ДНК и образуется двуспиральная ДНК (другой активностью того же самого фермента) и непрерывно включается в клеточную ДНК. Интегрированная вирусная ДНК (провирус) транскрибируется клеточной РНК-полимеразой II с последующим сплайсингом РНК-транскриптов и расщеплением образующихся белков. Часть вновь синтезированных полноразмерных (+)РНК транскриптов соединяется в пары и образует диплоидные геномы новых вирионов.
Ретровирусы— родина вірусів. имеют геномную (+) одноцепочечную РНК. В отличие от других РНК-вирусов, они реплицируются посредством ДНК-посредника.
Це оточені мембраною віруси, Генетическая информация яких представлена в виде РНК, що реплікується через ДНК, як проміжну ланку.. Вскоре после проникновения ретровируса в клетку, его РНК переписывается в двухцепочечную ДНК с помощью специфического вирусного фермента – обратной транскриптазы, способной синтезировать ДНК на РНК-матрице (вирусной РНК). Зворотня транскриптаз (або РНК-залежна ДНК-полімераза) — фермент (КФ 2.7.7.49), що катализує синтез ДНК з використанням РНК в якості матриці. Називається так тому, що більшість процесів транскрипції в живих організмах відбуваються в іншому напрямку, а саме, з молекули ДНК синтезується РНК-транскрипт.
После завершения синтеза вирусная двухцепочечная ДНК транспортируется в ядро клетки и встраивается в структуру хромосомной ДНК (за допомогою ферменту інтеграли), где может постоянно присутствовать в любой хромосоме, формируя т.н. провирус. В некоторых случаях провирусная ДНК тут же переписывается в РНК, но иногда провирус находится в «дремлющем» состоянии продолжительное время, после чего активируется с образованием дочерних вирусных частиц. При переписывании провирусной ДНК генетическая информация ретровируса передается с помощью клеточных ферментов в обычном, прямом направлении. Из образовавшихся вирусных РНК и белков собираются новые вирусные частицы, которые покидают клетку, распространяются и заражают другие клетки.
Вирионная обратная транскриптаза, используя РНК-молекулу как праймер, создает односпиральную ДНК-копию. Затем, функционируя как рибонуклеаза, тот же самый фермент удаляет родительскую молекулу РНК из ДНК-РНК-гибрида и копирует одноцепочечную ДНК-цепь, чтобы образовать линейную двуцепочечную ДНК, которая содержит дополнительную последовательность, известную как длинный концевой повтор (LTR) на каждом конце. Эта двуцепочечная ДНК затем циркулирует и интегрирует с клеточной хромосомальной ДНК. Вирусная РНК транскрибируется с интегрированной (провирусной) ДНК.
Синтез геномной вирусной ДНК в принципе не отличается от синтеза клеточной ДНК. У разных вирусов это происходит с использованием разных механизмов. Известно, что клеточные ДНК-полимеразы могут начинать синтез новой цепи ДНК только с короткого праймера.
Для решения этой проблемы ДНК-вирусы разных семейств пользуются различной стратегией. Одни из них имеют циркулярный ДНК-геном, другие —линейный геном с комплементарными концами, у третьих имеется белковый праймер на 5'-конце.
Для репликации вирусной ДНК необходимы некоторые кодируемые вирусом ферменты: геликаза (с АТФазной активностью), чтобы расплести двойную спираль; белок, дестабилизирующий двойную спираль до тех пор, пока каждая из нитей не будет скопирована; ДНК-полимераза для копирования каждой цепи в направлении от 5'-конца к З'-концу; РНКаза для разрушения РНК-праймера после его функционирования; ДНК-лигазы для соединения ДНК-фрагментов, если она синтезируется не целиком. Часто один большой фермент обладает двумя и более активностями.
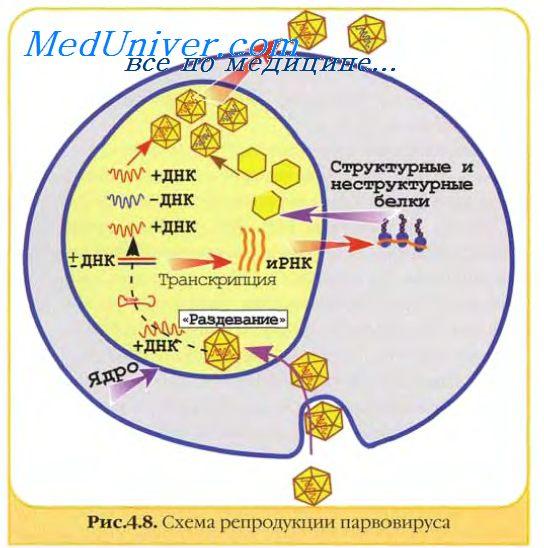
Геном парвовирусов использует для своей репликации клеточные ферменты, включая ДНК-полимеразу А. Ранний вирусный белок присоединяется к месту регуляторной последовательности вирусного генома и начинается репликация ДНК.
Происходит непрерывный и прерывистый синтез, соответственно, двух растущих цепей ДНК: главной и ответвляющейся. Прерывистый синтез ответвляющейся цепи связан с повторяющимися короткими олигонуклеотидными праймерами, поочередно рождающими короткие цепи ДНК (фрагменты Оказаки), которые затем соединяются ковалентно индуцированной вирусом ДНК-лигазой в одну растущую цепь.
Инициирующими единицами репликации папиллома- и полиомавирусов являются ковалентно связанные циркулярные (±)ДНК и линейные (±)ДНК адено- и герпесвирусов. Праймером синтеза аденовирусной ДНК служит предшественник белка, ковалентно связанный с вирионной ДНК. Репликация ДНК происходит непрерывно от 5'-конца к 3'-концу с использованием вирионной ДНК полимеразы. Синтез фрагментов Оказаки не происходит. Герпесвирусы кодируют большинство (если не все) белков, необходимых для репликации ДНК, включая ДНК-полимеразу, геликазу, праймазу, белок, соединяющий одноцепочечные ДНК, и белок, различающий начало репликации.
Вирусы оспы и асфаравирусы, которые размножаются целиком в цитоплазме, являются самодостаточными по механизму репликации. Гепаднавирусы, подобно ретровирусам, используют положительно полярные одноцепочечные РНК транскрипты в качестве посредников в синтезе ДНК с помощью обратной транскрипции. Синтез вирусной ДНК может происходить как в цитоплазме, так и в ядре зараженной клетки. Например, ДНК вирусов оспы синтезируется в цитоплазме, а ДНК герпес-, адено-, папиллома-, полиома- и парвовирусов — в ядре.
Делеция значительного количества генов (~ 40%) у оспо- и герпесвирусов не оказывает существенного влияния на их размножение в культуре клеток, возможно, что они важны для выживания этих вирусов в природе.
Репликация вирусных РНК является уникальным феноменом. Существенное отличие механизма синтеза вирусных РНК от механизма синтеза клеточных РНК состоит в том, что в качестве матрицы в первом случае используется РНК, а во втором — ДНК.
Для транскрипции РНК на РНК-матрице необходима вирионная РНК-зависимая РНК-полимераза. Репликация вирусной РНК требует, прежде всего, синтеза комплементарной РНК, которая затем служит матрицей для производства большого количества вирусной РНК.
Когда вирусная РНК имеет отрицательную полярность (орто-, парамиксо-, рабдо-, фило-, борна-, арена- и буньявирусы), комплементарная РНК будет иметь положительную полярность и РНК-полимераза, подобно вирионной транскриптазе, используется для первичной транскрипции мРНК.
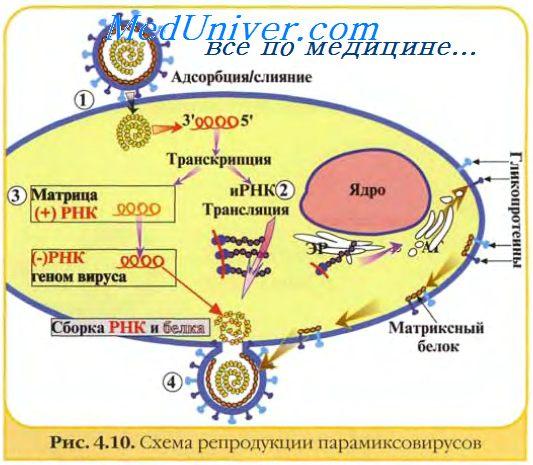
Так как большинство транскриптов, синтезируемых на каждой вирусной (-)цепи РНК, являются молекулами субгеномной РНК, некоторые полноразмерные цепи служат матрицами для синтеза (репликации) вирусной РНК. Некоторые вирусы для транскрипции и репликации используют различные РНК-полимеразы, тогда как в других случаях одни и те же ферменты могут выполнять различные функции.
У многих РНК-вирусов, (пикорна-, калици-, астро-, тога-, флави-, корона-, артери-, нодавирусы) комплементарная РНК является отрицательно полярной. На одной комплементарной РНК-матрице может транскрибироваться одновременно несколько молекул вирусной РНК, а на каждом РНК-транскрипте начинается продукция полимеразы. Образуется структура, известная как реплика-тивный посредник, — частично двуцепочечная структура с одноцепочечными хвостами.
Для начала репликации РНК пикорнавирусов и калицивирусов, а также ДНК аденовирусов требуется небольшой белок, связанный ковалентно с 5'-концом вновь синтезированных (+) или (—) цепей РНК, так же как с родительской вирионной РНК, но не с мРНК.
Вновь синтезированные (+)РНК могут иметь разное назначение: включаться в репликативный комплекс и служить матрицей для синтеза комплементра-ных (—)РНК; выполнять функции мРНК; включаться в качестве генома в новые вирионы. Механизм, определяющий судьбу вновь синтезированных (+)РНК, не известен.
Імунний статус організму. Імунологічні тести ІІ рівня.
Иммунная система играет важнейшую роль в выздоровлении от многих, особенно инфекционных болезней. Её состояние (то есть иммунный статус) на момент развития и течения патологического процесса представляет исключительный интерес.
Имму́нный ста́тус — это комплексный показатель состояния иммунной системы, это количественная и качественная характеристика состояния функциональной активности органов иммунной системы и некоторых неспецифических механизмов противомикробной защиты.
Нарушения иммунного статуса делают организм восприимчивым к различным возбудителям, в том числе к условно-патогенным. Кроме того, существенно возрастает риск развития аутоиммунных процессов и болезней злокачественного роста. Распознавание дефектного звена иммунного статуса — актуальная задача клинической медицины. Состояние иммунной системы можно оценить комплексом показателей.
• Состояние факторов неспецифической резистентности определяют по содержанию в сыворотке крови комплемента, лизоцима, ИФН; также определяют фагоцитарную способность макрофагов и цитотоксическую активность естественных киллеров.
• Об активности иммунной системы судят по уровню различных классов Ig и цитокинов в сыворотке крови, содержанию субпопуляций Т- и В-лимфоцитов, их способности отвечать на Аг и митогены, кожным реакциям ГЗТ.
Иммунологические тесты второго уровня позволяют, во-первых, подтвердить результаты, полученные на первом этапе, и, во-вторых, более точно определить локализацию дефекта в системе регуляции антигенного гомеостаза. Для этих целей в системе первичного звена медицинской службы наиболее приемлемы следующие методы:
1) определение относительного и абсолютного количества Т- и В-лимфоцитов крови. У здоровых лиц эти показатели равны;
2) определение дифференцировочных антигенов Т-лимфоцитов. Метод позволяет оценить количество субпопуляций Т-лимфоцитов (Т-хелперов и Т-супрессоров).
3) реакция торможения миграции лейкоцитов - РТМЛ. Метод позволяет in vitro оценить функциональное состояние Т-системы иммунитета, а именно: способность Т-лимфоцитов и лейкоцитов к кооперации.
У здоровых людей в присутствии Т-митогена (ФГА, коэнзим А) миграция лейкоцитов крови в капиллярах уменьшается на 20-80%.
4) количественные определения иммуноглобулинов методом радиальной иммунодиффузии. Метод позволяет количественно оценить функциональную активность гуморального иммунитета. У здоровых лиц в периферической крови содержится:
Ig M, - 0,65 - 1,65 г/л
Ig G - 7,50 - 15,45 г/л
Ig A - 1,25 - 2,50 г/л
Ig D – 0,00 - 0,07 г/л
5) определение параметров фагоцитарной реакции нейтрофилов крови. Метод основан на определении с помощью светового микроскопа поглотительной и переваривающей способности нейтрофилов крови по отношению к микробной тест-культуре после их совместной инкубации.
У здоровых взрослых людей в процессе фагоцитоза принимают участие 40 - 80% от общего числа нейтрофилов, каждый из которых за 30 мин поглощает 4-9 клеток стафилококка или 1 - 2,5 клеток дрожжей.
6) тест восстановления нитросинего тетразолия или НСТ-тест. Результаты этого исследования отражают активность НАДФ-Н-оксидазы лейкоцитов, ответственной за восстановление нитросинего тетразолия (НСТ) в нерастворимый диформазан.
У здоровых людей доля НСТ-позитивных нейтрофилов в базальных условиях составляет в среднем до 10%, при стимуляции зимозаном - 40-80%. Показатели НСТ-теста существенно повышаются в начальном периоде многих острых инфекций, тогда как при подостром и хроническом течении инфекционного процесса они являются, как правило, сниженными.
7) лизосомально-катионный тест - ЛКТ - характеризует степень активности кислороднезависимых микробоцидных систем фагоцитоза. В норме у взрослого человека показатель ЛКТ равен 1,5 - 1,7 усл.ед.; у детей - около 1,9.
8) определение лизоцима в сыворотке крови. Лизоцим (мурамидаза) - антибактериальный фермент, содержащийся в крови, секретах и тканях. Уровень лизоцима отражает функциональное состояние мононуклеарных фагоцитов как его главного продуцента, у здоровых лиц он равен 5-19 мкг/мл или (СИ 0,05-0,019 г/л).
9) система комплемента, состоящая из 11 гликопротеидных фракций, играет важную защитную и иммунорегулирующую роль. В сыворотке крови здоровых лиц определяется 40-80 % гемолитических единиц комплемента (СН50). Снижение общего уровня комплемента свидетельствует, как правило, о нарушении резистентности организма или его аллергизации.
Все приведенные нормы, характеризующие иммунный статус здоровых лиц, могут иметь объективные отклонения в зависимости от пола, возраста, особенностей конкретного региона, характеристик используемых реактивов. Из этого следует необходимость для каждой лаборатории предварительно обследовать здоровых лиц для определения собственных контрольных значений в том или ином тесте. Отклонения от нормы каких-либо показателей иммунореактивности у обследуемых могут носить транзиторный характер и требуют подтверждения. По одному какому-либо тесту не представляется возможным с полной уверенностью судить о состоянии иммунной системы, поэтому обследование должно носить комплексный характер. Если при обследовании вышеприведенными методами определено стойкое изменение показателей иммунореактивности, то пациент должен быть направлен в специализированное лечебно-диагностическое учреждение иммунологического профиля для окончательной диагностики и лечения.
Оценка иммунного статуса
Существуют скрининговые тесты оценки иммунного статуса, которые позволяют быстро оценить основные показатели работы иммунной системы. Стандартный скрининговый тест включает:
Подсчет абсолютного количества лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов.
Определение концентрации сывороточных иммуноглобулинов различных классов (IgG, IgA и IgM)
Определение гемолитической активности системы комплемента CH50.
Проведение кожных тестов гиперчувствительности замедленного типа.
Более детальное изучение иммунного статуса включает изучение количества и функциональной активности клеточного и гуморального звеньев иммунной системы:
Исследование фагоцитарной функции.
Исследование система комплемента.
Исследование Т-системы иммунитета.
Исследование В-системы иммунитета.
Рациональным считается исследование иммунного статуса в несколько этапов. Вначале проводятся ориентировочные исследования для выявления значительных дефектов иммунной системы (1 уровень), затем можно провести более подробное изучение (2 уровень) основываясь на данных предыдущего исследования.
Тесты 1-го уровня:
Исследование фагоцитарной функции:
подсчет абсолютного числа фагоцитов (нейтрофилов и моноцитов);
оценка интенсивности поглощения микробов фагоцитами;
способности фагоцитирующих клеток переваривать захваченные микробы.
Исследование система комплемента:
определение гемолитической активности комплемента CH50.
Исследование Т-системы иммунитета:
подсчет общего числа лимфоцитов;
подсчет процента и абсолютного числа зрелых T-лимфоцитов (CD3) и двух основных их субпопуляций: хелперов/индукторов (CD4) и киллеров/супрессоров (CD8);
определение пролиферативного ответа на основные T-митогены (фитогемагглютинин и конканавалин A).
Исследование В-системы иммунитета:
определение концентрации иммуноглобулинов различных классов (G, A, M, E) в сыворотке крови;
определение процента и абсолютного количества B-лимфоцитов (CD19, СD20) в периферической крови.
Тесты 2-го уровня:
Исследование фагоцитарной функции:
оценка интенсивности хемотаксиса фагоцитов;
определение экспрессии молекул адгезии (CD11a, CD11b, CD11c, CD18) на поверхностной мембране нейтрофилов.
Исследование Т-системы иммунитета:
исследование продукции цитокинов (интерлейкина-2, (ИЛ-2 или IL-2), ИЛ-4, ИЛ-5, ИЛ-6, гамма-интерферона (INF-γ), фактора некроза опухоли (ФНО или TNF-α) );
определение активационных молекул на поверхностной мембране T-лимфоцитов (CD25, HLA-DR);
выявление молекул адгезии (CD11a, CD18);
исследование пролиферативного ответа на специфические антигены, чаще всего на дифтерийный и столбнячный анатоксины;
проведение аллергической реакции с помощью кожных тестов с рядом микробных антигенов.
Исследование В-системы иммунитета:
субклассов иммуноглобулинов, особенно IgG;
секреторного IgA;
исследование соотношения κ (каппа) и λ (лямбда) цепей иммуноглобулинов;
определение специфических антител к белковым и полисахаридным антигенам;
исследование способности лимфоцитов к пролиферативному ответу на B- (стафилококк, липополисахарид энтеробактерий) и T-B- (митоген лаконоса) митогены.
Охарактеризуйте хімічний (елементарний) склад вірусів.
ХІМІЧНИЙ СКЛАД ВІРУСІВ
Віріони просто організованих вірусів являють собою вірусну нуклеїнову кислоту, укладену в оболонку (капсид), що складається з повторюваних субодиниць (капсомерів). Кожен капсомер побудований з одного чи декількох білків, закодованих у геномі вірусу. Крім нуклеїнової кислоти і білків вони містять ліпіди і гліколіпіди, які здебільшого розташовуються в зовнішній (суперкапсидній) оболонці віріонів. До складу останніх часто входять глікопротеїди (гліколізовані білки, до поліпептидних ланцюгів яких ковалентно приєднані вуглеводні ланцюги), ліпопротеїди, найчастіше ациліровані білки (білки, до поліпептидних ланцюгів яких ковалентно приєднані залишки жирних кислот) і фосфопротеїди (білки, до поліпептидних ланцюгів яких ковалентно приєднані залишки фосфорної кислоти). Здебільшого ліпіди і гліколіпіди клітинного походження, за винятком, можливо, поксвірусів. Ліпіди не завжди розташовані в зовнішній оболонці віріону.
Вуглеводи, що входять до складу вірусних білків, являють собою полімерні ланцюги, синтезовані з мономерних ланок, що поставляються клітиною. Причому, у поксвірусів структура олігосахаридних ланцюгів залежить від структури білка, до якого вони приєднані.
Приєднання до вірусних білок залишків фосфорної і жирної кислот і вуглеводних ланцюгів здійснюється, як правило, клітинними ферментами, але специфічність приєднання залежить від структури білка.
Нуклеїнові кислоти являють собою лінійні полімери, що складаються з нуклеотидів. Нуклеотиди складаються з трьох частин: залишку фосфорної кислоти, вуглеводного залишку (дезоксирибози для ДНК, рибози для РНК) і азотистої основи.
Вірусні нуклеїнові кислоти. Клітини всіх живих організмів містять два види нуклеїнових кислот ДНК і РHК. На відміну від клітин віруси містять лише один вид нуклеїнової кислоти — або РНК, або ДНК. І та й інша може бути носієм спадкоємної інформації, виконуючи в такий спосіб функції генома.
Вірусні нуклеїнові кислоти характеризуються разючою розмаїтістю форм. Вірусний геном може бути представлений як односпіральними, так і двоспіральними молекулами РНК і ДНК. ДНК може бути як лінійною, так і кільцевою молекулою.
Вірусні ДНК. Мол. маса вірусних ДНК варіює в широких межах від 106 до 25·107 Д. Найбільші вірусні геноми містять кілька сотень генів, а самі маленькі містять інформацію, достатню для синтезу лише декількох білків.
У вірусних геномах, представлених двоспіральними ДНК, інформація може бути закодована на обох нитках ДНК.
Вірусні РНК.
З декількох сотень відомих у даний час вірусів людини і тварин РНК - геном містить близько 80% вірусів. У деяких РНК - геномних вірусів нуклеїнова кислота при відсутності білка може викликати інфекційний процес. Структура вірусних РНК надзвичайно різноманітна. У вірусів виявлені односпіральні і двоспіральні, лінійні, фрагментовані і кільцеві РНК. РНК - геном є здебільшого гаплоїдним, але геном ретровірусів — диплоїдний, тобто складається з двох ідентичних молекул РНК.
Вірусні білки.
Вірусні (вірусоспецифічні) білки — білки, що кодуються геномом вірусу, — синтезуються в зараженій клітці. Виходячи з функції, локалізації, структури і регуляції синтезу, вірусні білки поділяють на структурні і неструктурні; ферменти, попередники, гістоноподібні капсидні білки; мембранні, трансмембранні і т.д.
Структурні білки.
Структурними називають усі білки, що входять до складу зрілих позаклітинних віріонів.
У залежності від розташування того чи іншого білка у віріоні виділяють групи білків:
а) капсидні білки. б) білки вірусної суперкапсидної оболонки. в) матриксні білки. г) білки вірусних серцевин; д) білки, асоційовані з нуклеїновою кислотою
Неструктурні вірусні білки - це всі білки, що кодуються вірусним геномом, але не входять у склад зрілих віріонів.
Ліпіди.
Виявлені в складно організованих вірусів і в основному знаходяться в складі ліпопротеїдної оболонки (суперкапсида), формуючи її ліпідний подвійний шар, у який вставлені суперкапсидні білки.
Усі складно організовані РНК-вмістні віруси, мають у складі значну кількість ліпідів (від 15 до 35% від сухої маси). З ДНК-містких вірусів ліпіди мають віруси віспи, герпесу і гепатиту В. Приблизно 50—60% ліпідів у складі вірусів представлено фосфоліпідами, 20—30,% складає холестерин.
Ліпідний компонент стабілізує структуру вірусної частки.
якісний склад ліпідів вірусних оболонок подібний з таким у тих мембран, через які відбувається брунькування, але відмінний від нього по кількісному співвідношенню різних класів ліпідів. Так, наприклад, вірусні суперкапсидні оболонки часто збагачені холестерином. З цього випливає, що склад ліпідів вірусів, що брунькуються, близький до складу ліпідів клітини-хазяїна.
Вуглеводи.
Вуглеводний компонент вірусів знаходиться в складі глікопротеїдів і гліколіпідів. Наявність глікопротеїдів у вірусів і їхній процентний уміст коливається від 3 до 9%.
Звичайними цукровими залишками, що виявляються у вірусних білках, є фруктоза, сахароза, маноза, галактоза, нейрамінова кислота, глюкозамін. Вуглеводний компонент гліколіпідів по своїй структурі цілком визначений клітиною. У той же час вуглеводний компонент глікопротеїдів визначається, з одного боку, клітиною-хазяїном, а з іншого боку, вірусом, а саме структурою його гліколізованих білків.
Компоненти клітини-хазяїна.
У складі віріонів можуть знаходитися компоненти клітини-хазяїна. До таких компонентів можуть відноситися білки і навіть цілі клітинні структури. Так, наприклад, у складі ряду оболонкових вірусів може знаходитися білок цитоскелету актин, а у складі паповавірусів містяться клітинні гістони. Ряд вірусів містить клітинні ферменти, наприклад протеїнкінази. У складі аренавірусів виявлені рибосоми.
Клітинні компоненти можуть включатися у віріон випадково чи закономірно. У деяких випадках вони відіграють істотну роль у репродукції вірусу, як, наприклад, гістони в репродукції паповавірусів.
елементарний склад: C, O, N, H, P, S. Інші необхідні в іонному вигляді елементи: Na, K, Ca, Cl, Mg.
Імунологічні тести ІІІ рівня.
Все существующие в настоящее время лабораторные иммунологические тесты, согласно классификации, предложенной кафедрой иммунологии Российского медицинского университета, могут быть разделены на тесты I и II уровня.
Тесты I уровня (ориентирующие) включают:
подсчет общего числа лимфоцитов (абсолютное и относительное содержание в периферической крови);
определение количества Т- и В-лимфоцитов;
оценка фагоцитарной активности нейтрофилов;
определение основных классов сывороточных иммуноглобулинов (IgA, IgM, IgG);
определение титра комплемента (не всегда).
После анализа результатов тестов I уровня определяют тактику дальнейшего исследования иммунного статуса. Тесты II уровня в отличие от тестов I уровня ставят избирательно в зависимости от того, какие цели преследует проводимое иммунологическое обследование.
Тесты II уровня могут включать:
определение Т- и В-лимфоцитов и их субпопуляций (CD4+, CD8+);
определение циркулирующих иммунных комплексов (ЦИК);
постановка реакции бласттрансформации лимфоцитов (РБТЛ);
определение специфических IgE;
НСТ, а также любые другие исследования состояния иммунной системы.
Тесты ІІІ уровня: включ. оценку эффекторного звена иммуни тета (определяют более тонкие нарушения):
определение отдельных субклассов иммуноглобулинов и В-лимфоцитов, регуляторных и эффекторных клеток.
наличия активационных мол.
Также на этом этапе можно определить концентрации отдельных цитокинов — главных регуляторных молекул, определяющих тип иммунного ответа.
Умовно-патогені та патогенні мікроорганізми. Фактори патогенності та вірулентності.
Патогенные микроорганизмы вызывают инфекционные заболевания у здоровых лиц. Такие возбудители произошли от свободноживущих видов, адаптировавшихся к существованию во внутренней среде организма.
Патогенные микробы активно проникают в чувствительные организмы, так как паразитирование — важная часть их жизненного цикла. Адаптация к паразитированию в тканях проявляется специфическими поражениями, выделенными в отдельные нозологические формы.
Основные болезни, вызываемые патогенными микроорганизмами:
Str. Agalactiae, Staph. Aureus и др.→ Мастит, Brucella → Бруцеллез, Mycobacterium tuberculosis → Туберкулез, Bacillus anthracis → Сибирская язва
Патогенность – это способность микроба определенного вида при соответствующих условиях вызывать характерное для него инфекционное заболевание. Следовательно, патогенность есть видовой признак.
Вирулентность – это степень патогенности определенного штамма микроба, т. е. индивидуальный признак. Например, бацилла сибирской язвы является патогенной, так как обладает свойством вызывает заболевание сибирской язвой. Но штамм одной культуры вызывает заболевание и смерть через 96 часов, а другой – через 6-7 дней. Следовательно, вирулентность первого штамма более высокая, чем второго.
Вирулентность микроба может быть повышена путем его пассажей через чувствительный организм лабораторных животных, т.е. последовательным заражением ряда животных (после гибели первого зараженного животного выделенными из него микробами заражают следующее животное и т.д.).
В естественных условиях вирулентность бактерий повышается путем пассажа через восприимчивый организм, поэтому больных заразной болезнью необходимо немедленно изолировать от здоровых.
Снизить вирулентность микроба в лабораторных условиях можно путем пересевов и выращивания на питательных средах при повышенной температуре или при добавлении в среду некоторых химических веществ (бычья желчь, слабый раствор карболовой кислоты и пр.).
Таким образом, вирулентность как мера патогенности – величина переменная. Она может быть повышена, понижена и даже утеряна.
Патогенность как особое качество болезнетворного вида микроба проявляется в агрессивных его свойствах и в токсическом действии на организм. Агрессивность – это способность патогенного микроба жить, размножаться и распространяться в организме, противостоять неблагоприятным влияниям, оказываемым организмом.
Некоторые патогенные микробы, размножаясь в организме или на питательной среде в пробирке, вырабатывают растворимые продукты, получившие название агрессины. Назначение агрессинов - подавлять действие фагоцитов. Сами агрессины безвредны для организма, но если их прибавить к несмертельной дозе культуры соответствующего микроба, они вызывают смертельно протекающую инфекцию.
Токсичность – способность патогенного микроба вырабатывать и выделять ядовитые вещества, вредно действующие на организм. Токсины бывают двух видов – экзотоксины и эндотоксины.
Экзотоксины – выделяются в окружающую среду при жизни микробов в организме или на искусственных питательных средах, а также в пищевых продуктах. Они очень ядовиты. Например, 0,005 мл жидкого столбнячного токсина или 0,0000001 мл ботулинического токсина убивает морскую свинку.
Микробы, способные образовывать токсины, получили название токсигенных.
Под влиянием нагревания и света экзотоксины легко разрушаются, а под действием некоторых химических веществ теряют токсичность.
Эндотоксины прочно связаны с телом микробной клетки и освобождаются только после ее гибели и разрушения. Они весьма устойчивы при действии высоких температур и не разрушаются даже после нескольких часов кипячения. Ядовитое действие многих бактерийных экзотоксинов связано с ферментами – лецитиназой (разрушает эритроциты), коллагеназой, гиалуронидазой (расщепляет гиалуроновую кислоту) и рядом других ферментов, которые производят в организме разрушение жизненно важных соединений. Условленно также, что некоторые патогенные бактерии (дифтерийные стафилококки и стрептококки) продуцируют фермент дезоксирибонуклеазу. В процессе жизнедеятельности патогенные микробы выделяют и другие вещества, обусловливающие их вирулентность.
Условно-патогенные микроорганизмы, как правило, лишены болезнетворных свойств и не вызывают инфекционных заболеваний у здорового человека, но вызывают в определенных условиях заболевания у людей с пониженной сопротивляемостью организма.Они нередко колонизируют кожу и слизистые оболочки, но способны и к длительному существованию во внешней среде.
Могут обладать рядом факторов патогенности, способностью к колонизации (заселению) организма, выраженной гетерогенностью и изменчивостью популяции, определяющей быстрое приобретение устойчивости к неблагоприятным факторам, в т. ч. к антимикробным препаратам.
Заражение может происходить экзогенным путем (контактным, воздушно-капельным, алиментарным), в результате аутоинфекции, а также при использовании инструментальных методов лечения и обследования больных, когда микробы попадают непосредственно во внутреннюю среду организма, минуя естественные барьеры. Инф. процесс развивается на фоне снижения естественного или приобретенного иммунитета
Условно-патогенные микробы вызывают поражения после пассивного переноса во внутреннюю среду организма (например, при нарушении целостности анатомических барьеров). Поскольку эти микроорганизмы лишены тропности к тем или иным тканям, то заболевания не имеют выраженной специфичности и больше зависят от степени поражения органа, чем от патогенных свойств возбудителя. Важные условия их развития — массивность инфицирования и нарушения сопротивляемости организма. Чем более выражены эти нарушения, тем более широкий спектр микроорганизмов способен вызывать инфекционные поражения.
Наиболее часто У. -п. м. являются возбудителями внутрибольничной инфекции (напр., стафилококковой), т. к. именно в стационарных леч. учреждениях создаются условия, благоприятные для их распространения, и имеется ослабленный контингент людей, восприимчивых к заражению.
7. Типи живлення у мікроорганізмів. Катаболізм та анаболізм.
За способом живлення бактерії діляться на гетеротрофних і автотрофних. Більшість видів відносяться до першої групи, тобто харчується готовими органічними речовинами. Гетеротрофні бактерії (їх більшість), у свою чергу, поділяються на сапрофітів і симбіонтів. Бактерії-сапрофіти живляться органічними рештками відмерлих рослин і тварин, продуктами харчування людини. Вони спричиняють гниття і бродіння (ферментацію) органічних речовин. Гниття - це розчеплення білків, жирів та інших азотовмісних сполук під дією гнійних бактерій. Бродіння, або ферментація, - це анаеробне розщеплення вуглеводів під дією ферментів бактерій.
Автотрофні бактерії — це бактерії, що можуть синтезувати органічні речовини з неорганічних у результаті фотосинтезу (фототрофт) або хемосинтезу (хемопгрофні). До фототрофних належать пурпурові й зелені сіркобактерії, які синтезують складові частини свого тіла з мінеральних речовин і вуглекислого газу, а енергію використовують світлову. Хемотрофні бактерії, або хемосинтетики, живляться за допомогою хемосинтезу, оскільки органічні речовини синтезуються з неорганічних за рахунок енергії хімічних реакцій. До них належать нітрифікуючі, залізо і сіркобактерії.
Катаболи́зм (от греч. καταβολή, «основание, основа») — процесс метаболического распада, разложения на более простые вещества или окисления какого-либо вещества, обычно протекающий с высвобождением энергии в виде тепла и в виде АТФ. Катаболические реакции лежат в основе диссимиляции: утраты сложными веществами своей специфичности для данного организма в результате распада до более простых.
Примерами катаболизма являются превращение этанола через стадии ацетальдегида (этаналя) и уксусной кислоты (этановой кислоты) в углекислый газ и воду, или процесс гликолиза — превращение глюкозы в молочную кислоту либо пировиноградную кислоту и далее уже в дыхательном цикле — опять-таки в углекислый газ и воду.
Интенсивность катаболических процессов и преобладание тех или иных катаболических процессов в качестве источников энергии в клетках регулируется гормонами. Например, глюкокортикоиды повышают интенсивность катаболизма белков и аминокислот, одновременно тормозя катаболизм глюкозы, а инсулин, напротив, ускоряет катаболизм глюкозы и тормозит катаболизм белков.
Катаболизм является противоположностью анаболизма — процессу синтеза или ресинтеза новых, более сложных, соединений из более простых, протекающему с расходованием, затратой энергии АТФ.
Анаболи́зм (от греч. ἀναβολή, «подъём») — совокупность химических процессов, составляющих одну из сторон обмена веществ в организме, направленных на образование составных частей клеток и тканей. Анаболизм взаимосвязан с противоположным процессом — катаболизмом, так как продукты распада различных соединений могут вновь использоваться при анаболизме, образуя в иных сочетаниях новые вещества. Процессы анаболизма, происходящие в зелёных растениях с поглощением энергии солнечных лучей (см. Фотосинтез), имеют планетарное значение, играя решающую роль в синтезе органических веществ из неорганических.
Анаболизм (пластический обмен, ассимиляция) — одна из сторон обмена веществ. Включает процессы синтеза аминокислот, моносахаридов, жирных кислот, нуклеотидов, полисахаридов, макромолекул белков, нуклеиновых кислот, АТФ.
Анаболизм - синтез собственных органических соединений из полученных питательных веществ, идёт с потреблением энергии, полученной при окислении. Процесс происходит в три этапа: 1. Синтез промежуточных соединений из низкомолекулярных веществ. 2. Синтез "строительных блоков" из промежуточных соединений. 3. Синтез из "строительных блоков" макромолекул белков, нуклеиновых кислот, полисахаридов, жиров.Идет с поглощением энергии и участием ферментов.
В результате такого обмена из питательных веществ, поступающих в клетку, строятся свойственные организму белки, жиры, углеводы, которые, в свою очередь, идут уже на создание новых клеток, их органов, межклеточного вещества.
8.Конструктивний та енергетичний метаболізм. Принцип „біохімічної єдності".
Конструктивный метаболизм
За исключением некоторых специфических моментов биохимические пути, по которым осуществляется синтез белков, жиров, углеводов и нуклеотидов, у бактерий схожи с таковыми у других организмов. Однако по числу возможных вариантов этих путей и, соответственно, по степени зависимости от поступления органических веществ извне они различаются.
Часть из них может синтезировать все необходимые им органические молекулы из неорганических соединений (автотрофы), другие же требуют готовых органических соединений, которые они способны лишь трансформировать (гетеротрофы).
Наибольшей степенью гетеротрофности отличаются внутриклеточные паразиты. Если при этом они способны существовать на богатых искусственных средах, они называются факультативными (факультативными иногда также называют паразитов, способных проделывать весь свой жизненный цикл во внешней среде, без участия хозяина). Некоторые облигатные (обязательные) внутриклеточные паразиты утратили часть путей биосинтеза и получают многие органические вещества, вплоть до АТФ, из клеток хозяина. Велика степень зависимости от хозяев также многих бактерий-эндосимбионтов. Большинство бактерий принадлежит к сапрофитам: они не питаются непосредственно веществами других организмов, но используют синтезированные ими органические вещества после их смерти. Существует также ряд бактерий, требующих наличия в среде небольшого круга определённых органических веществ (аминокислот, витаминов), которых они не могут синтезировать самостоятельно и, наконец, гетеротрофы, которые нуждаются лишь в одном довольно низкомолекулярном источнике углерода (сахар, спирт, кислота). Некоторые из них отличаются высокой специализацией (Bacillus fastidiosus может использовать только мочевую кислоту), другие в качестве единственного источника углерода и энергии могут использовать сотни различных соединений (многие Pseudomonas).
Удовлетворять потребности в азоте бактерии могут как за счёт его органических соединений (подобно гетеротрофным эукариотам), так и за счёт молекулярного азота (как и некоторые археи). Большинство бактерий используют для синтеза аминокислот и других азотсодержащих органических веществ неорганические соединения азота: аммиак (поступающий в клетки в виде ионов аммония), нитриты и нитраты (которые предварительно восстанавливаются до ионов аммония). Фосфор они способны усваивать в виде фосфата, серу — в виде сульфата или реже сульфида.
Энергетический метаболизм
Способы же получения энергии у бактерий отличаются своеобразием. Существует три вида получения энергии (и все три известны у бактерий): брожение, дыхание и фотосинтез.
Брожение — серия окислительно-восстановительных реакций, в ходе которых образуются нестабильные молекулы, с которых остаток фосфорной кислоты переносится на АДФ с образованием АТФ (субстратное фосфорилирование). При этом возможно внутримолекулярное окисление и восстановление.
Дыхание — окисление восстановленных соединений с переносом электрона через локализованную в мембране дыхательную электронтранспортную цепь, создающую трансмембранный градиент протонов, при использовании которого синтезируется АТФ (окислительное фосфорилирование). В то время как эукариоты в конечном итоге почти всегда «сбрасывают» электрон на кислород (лишь в редких случаях акцептором электронов могут служить нитраты), бактерии могут использовать вместо него окисленные органические и минеральные соединения (фумарат, углекислый газ, сульфат-анион, нитрат- анион и др.; см. анаэробное дыхание), а вместо окисляемого органического субстрата использовать минеральный (водород, аммиак, сероводород и др.), что часто бывает сопряжено с автотрофной фиксацией CO2 (см. хемосинтез).
Фотосинтез бактерий может быть двух типов — бескислородный, с использованием бактериохлорофилла (зелёные, пурпурные и гелиобактерии) и кислородный с использованием хлорофилла (цианобактерии (хлорофилл a), прохлорофиты (a и b)). Цианобактерии, глаукоцистофитовые , красные и криптофитовые водоросли — единственные фотосинтезирующие организмы, содержащие фикобилипротеины. У архей встречается бесхлорофилльный фотосинтез с участием бактериородопсина (правда, энергия света используется при этом не для фиксации CO2, а непосредственно для синтеза АТФ, так что в строгом смысле это не фотосинтез, а фотофосфорилирование).
Бактерии, осуществляющие только бескислородный фотосинтез, не имеют фотосистемы II. Во-первых, это пурпурные и зелёные нитчатые бактерий, у которых функционирует только циклический путь переноса электронов, направленный на создание трансмембранного протонного градиента, за счёт которого синтезируется АТФ (фотофосфорилирование), а также восстанавливается НАД(Ф) +, использующийся для ассимиляции CO2. Во-вторых, это зелёные серные и гелиобактерии, имеющие и циклический, и нециклический транспорт электронов, что делает возможным прямое восстановление НАД(Ф) +. В качестве донора электрона, заполняющего «вакансию» в молекуле пигмента в бескислородном фотосинтезе используются восстановленные соединения серы (молекулярная, сероводород, сульфит) или молекулярный водород.
Существуют также бактерии с весьма специфическим энергетическим метаболизмом. Так, в октябре 2008 года в журнале Science появилось сообщение[1] об обнаружении экосистемы, состоящей из представителей одного единственного ранее неизвестного вида бактерии — Desulforudis audaxviator, которые получают энергию для своей жизнедеятельности из химических реакций с участием водорода, образующегося в результате распада молекул воды под воздействием радиации залегающих вблизи нахождения колонии бактерий урановых руд[2]. Некоторые колонии бактерий, обитающие на дне океана, используют для передачи энергии своим собратьям электрический ток.[
Энергетический метаболизм
Энергетический метаболизм бактерий основывается на фототрофии, использовании света через фотосинтез, или на хемотрофии, использовании химических веществ для получения энергии. Хемотрофы в свою очередь делятся на литотрофов, которые используют неорганические доноры электронов для дыхания, и органотрофов, которые используют органические соединения в качестве доноров электронов. Чтобы использовать химические соединения как источник энергии, электроны берутся из возобновляемых веществ и перемещают к акцепторам электронов в процессе окислительно-восстановительной реакции. Эта реакция высвобождает энергию, которая может использоваться для проведения метоболичных реакций. В аэробных организмах в качестве акцептора электронов используется кислород. В анаэробных организмах вместо него используются другие неорганические вещества, например нитраты, сульфаты или углекислота. Это приводит к экологически важным процессам денитрификации, восстановление сульфатов и ацетогенезу соответственно. Эти процессы также важные в биологических ответах на загрязнение, например, сульфат-выделяющие бактерии в значительной мере ответственны за производство чрезвычайно отравляющих форм ртути (метил- и диметил-ртуть) в окружении. Анаэробы используют процесс так называемого анаэробного дыхания (брожение) для получения энергии, выделяя метаболические побочные продукты (например этанол в пивоварении), поскольку они не могут быть использованы дали. Факультативные анаэробы могут переключаться между процессами аэробного и анаэробного дыхания, то есть разными акцепторами электронов, в зависимости от естественных условий, в которых они находятся.
Литотрофные бактерии могут использовать неорганические вещества как источник энергии. Общими неорганическими донорами электронов является водород, угарный газ, аммиак (что приводит к нитрификации), оксид железа II, другие восстановленные ионы металлов и некоторые восстановлены соединения серы. Хотя это и необычно, некоторые бактерии-метанотрофы могут использовать газ метан и как источник электронов, и как субстрат для углеродного анаболизма. Как в аэробных фототрофов, так и в хемолитотрофов, кислород используется как конечный акцептор электронов, тогда как по анаэробными условиям заметь его используются неорганические соединения. Большинство литотрофных организмов — автотрофы, тогда как органотрофы являются гетеротрофами.
Совокупность биосинтетических реакций включения низкомолекулярных соединений в клеточные полимеры составляет суть конструктивного метаболизма. Комплекс этих реакций иногда называют пластическим обменом.
Углеродные соединения для биосинтетических реакций бактерий
Для биосинтеза клеточных компонентов необходимы соответствующие низкомолекулярные соединения-предшественники (например, сахара или аминокислоты). При наличии таких предшественников в окружающей среде они непосредственно вовлекаются в различные биосинтети-че.ские пути. Однако гораздо чаще бактериям приходится предварительно синтезировать большую часть молекул-предшественников из доступных исходных продуктов. Исходные продукты для биосинтеза образуются в ходе различных путей катаболизма, включая гликолиз, КДФГ-путь, пентозофос-фатный путь, окисление пирувата и ЦТК. Например, углеродные фрагменты из ЦТК — сукцинил-КоА и ацетил-КоА — используются соответственно для образования тетрапирролов и жирных кислот.
Конструктивний обмін це сукупність усіх біосинтетичних реакцій в клітині, що проходять з метої синтезу необхідних компонентів (білків, НК, ліпідів, полісахаридів). З частини конструктивного обміну :
засвоєння неорганічних сполук
синтез мономерних сполук
біосинтез з мономерів основних клітинних полімерів. Засвоєння неорганічних сполук.
Це фіксація та включення у метаболізм клітини вуглецю, молекулярного азоту, неорганічної сірки т;
фосфору.
За джерелом вуглецю є автотрофи та гетеротрофи. Відомі 2 метаболічні цикли фіксації
вуглекислоти:
відновний цикл трикарбонових кислот (цикл Арнона)-для фотосинтетичних анаеробних та хемогетеротрофних бактерій.
відновний пентозофосфатний цикл (цикл Кальвіна)-для літотрофів, фотосинтезуючі- анаеробів, а також для вищих рослин, водоростей, ціанобактерій.
За джерелом азоту є аміноавтотрофи та аміногетеротрофи. Джерело сполук азоту:
змінний азот.
неорганічний азот в амонійній або нітратній формі.
атмосферний, або молекулярний.
Синтез глікополімерів. Глікополімери - полісахариди - глікоген, крохмаль, целлюлоза, хіти: муреїн. У гетеротрофів синтез вуглеводних сполук отримав назву глюконеогенез. СинтІ починається із утворення мономерів (фосфоцукри), які з'єднуються у полімерні вуглеводні сполуї полісахаридів. Фосфоцукри утворюються на шляхах проміжного або центрального обмін4 амфіболізму, що пов'язує анаболізм і катаболізм. З фосфогліцеринової кислоти утворюються в вуглецеві сполуки клітин. Сама ж кислота утворюється при катаболізмі полісахаридів а( вуглекислоти, форміату, ацетату, ліпідів.
В автотрофних фотосинтетиків і літотроофів глюкоза утворюється при відновленні вуглекислоти реакціях циклу Кальвіна або циклу Арнона.
Характерна риса синтезу полісахаридів - наявність „затравки", яка служить акцептором нові-мономерних фрагментів.
А. Клюйвер і К. ван Ніль. провели порівняльні біохімічні дослідження систематично віддалених фізіологічних груп мікроорганізмів і сформулювали теорію біохімічної єдності життя, яка базується на спільних закономірностях конструктивного і енергетичного обміну всіх живих організмів. У чому ж конкретно виявляється біохімічна єдність життя, поряд з великою фізіологічною різноманітністю і різними типами життя в світі мікроорганізмів? Спільне виявляється в єдності трьох груп процесів: передачі генетичної інформації, енергетичних і конструктивних процесів. Два останні положення сформулював А. Клюйвер, а єдність системи передачі генетичної інформації у всіх типів життя було встановлено пізніше.
