
61.07 Колоїдна хімія
.pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ХАРЧОВИХ ТЕХНОЛОГІЙ
ЗАТВЕРДЖУЮ
Ректор________________С.В.Іванов
_____ _______________2013 р.
ПОВЕРХНЕВІ ЯВИЩА ТА ДИСПЕРСНІ СИСТЕМИ (КОЛОЇДНА ХІМІЯ)
ЛАБОРАТОРНИЙ ПРАКТИКУМ
для студентів за напрямом 6.051301 «Хімічна технологія» денної форми навчання
Всі цитати, цифровий та фактичний матеріал, бібліографічні відомості перевірені. Написання одиниць відповідає стандартам
Підписи авторів_______________
26 червня 2013 р.
Реєстраційний номер електронного лабораторного практикуму у НМВ
61.07 – 27.06.2013
СХВАЛЕНО на засіданні кафедри
фізичної і колоїдної хімії Протокол № 15 від 08.04.2013 р.
КИЇВ НУХТ 2013
Поверхневі явища та дисперсні системи (колоїдна хімія): Лабор.
практикум для студ. напряму 6.051301 «Хімічна технологія» ден. форм навч. / Уклад.: О.В. Грабовська, О.В. Подобій, Н.І. Сабадаш – К.: НУХТ, 2013. – с.
Рецензент О.М. Полумбрик, д-р. хім. наук
Укладачі: О.В. Грабовська, д-р тех. наук О.В. Подобій, канд. тех. наук Н.І. Сабадаш, канд. тех. наук
Відповідальна за випуск О.В.Грабовська, д-р тех. наук, проф.
Видання подається в авторський редакції
ВСТУП
Предметом дисципліни «Поверхневі явища та дисперсні системи (колоїдна хімія)» є вивчення дисперсного стану речовини та поверхневих явищ в дисперсних системах, ролі цих явищ у визначенні фізико-хімічних властивостей колоїдних розчинів; вивчення властивостей розчинів високомолекулярних сполук; структурно-механічні властивості дисперсних систем.
Мета дисципліни – навчити студентів розуміти та використовувати основні положення хімії поверхневих явищ та методів дослідження колоїдної хімії для характеристики технологічних процесів у харчовій, хімічній та косметичній промисловості, аналізувати структурно-механічні властивості харчових систем.
Більшість процесів харчової промисловості пов‟язані з переробкою структурованих дисперсних систем – суспензій, пін, драглів, структурномеханічні параметри яких використовують при виборі найбільш раціональних режимів роботи устаткування, оптимальних умов проведення технологічних процесів, для проектування автоматичних систем керування виробництвом.
Згідно вимог освітньо-професійної програми вищої освіти за напрямом підготовки “Хімічна технологія” дисципліна «Поверхневі явища та дисперсні системи (колоїдна хімія)» вивчається після неорганічної, аналітичної, органічної та фізичної хімії. Дисципліна є теоретичною основою всіх технологічних виробництв у харчовій та косметичній промисловості.
Внаслідок вивчення дисципліни «Поверхневі явища та дисперсні системи (колоїдна хімія)» бакалавр отримує цілісне уявлення щодо процесів та явищ, які відбуваються в неживій та живій природі; розуміє можливості сучасних наукових методів пізнання природи, володіє ними для рішення конкретних завдань, що виникають при виконанні професійних функцій.
Одним з основних завдань дисципліни є навчити студентів розв‟язувати завдання ефективного керування виробництвом, прогнозувати перебіг і результат процесу, а також зміну умов, щоб процес відбувався у бажаному напрямі з найменшими витратами. Утворення структур, плинність та поведінка харчових мас у різних технологічних процесах, якість і товарний вигляд продуктів харчування визначаються структурно-механічними властивостями. На структуру та якість готової продукції можна впливати шляхом внесення різноманітних біологічно активних та інших цінних добавок, зміною режиму та способу технологічної обробки матеріалу, іншими методами.
Дисперсні системи характеризуються такими механічними властивостями: в`язкість, пружність, плинність, пластичність, міцність, релаксація та ін. Механічні властивості, які ще називають реологічними, визначають здатність системи чинити опір деформації та руйнуванню під дією зовнішніх сил. Ці властивості систем пов`язані з їх структурою, наявністю міжмолекулярної взаємодії та хаотичного теплового руху частинок. Тому механічні властивості ще називають структурно-механічними.
3
Таким чином, фізико-хімічна механіка встановлює залежність механічних властивостей системи від хімічного складу, структури, фізико - хімічних чинників: температури, перемішування, адсорбційної та хімічної взаємодії, рН середовища та ін. Вона також вивчає молекулярний механізм процесів деформації, плинності та руйнування тіл, закономірності та шляхи керування цими механізмами для отримання матеріалів з необхідними структурно -механічними властивостями.
Викладання дисципліни базується на знаннях, що набули бакалаври з курсів вищої математики, фізики та всього циклу хімічних дисциплін, які вивчаються з використанням сучасних досягнень науки, мають практичну направленість і підтверджуються прикладами із різноманітних технологічних процесів харчової промисловості.
З метою кращого засвоєння теоретичних основ дисципліни слід використовувати різні наочні посібники, технічні засоби навчання, комп‟ютерну техніку.
Лабораторні роботи повинні виконуватися при вивченні відповідної теми, що сприяє кращому засвоєнню теоретичного матеріалу і надає можливість студентам ознайомитися з фізико-хімічними процесами, які лежать в основі одержання та дослідження складу і властивостей продуктів харчування, а також харчових добавок та косметичних засобів та навчитися самостійно аналізувати системи і виконувати необхідні розрахунки.
Для самостійної підготовки студентів передбачені теоретичні відомості на початку кожної лабораторної роботи та питання для самоперевірки знань.
4
Лабораторна робота №1
ДИСПЕРСІЙНИЙ АНАЛІЗ СУСПЕНЗІЙ
Мета роботи – визначити розміри частинок; фракційний склад суспензії та найімовірніший радіус частинок.
Теоретичні відомості
Кінетично (або седиментаційно) стійкою є система, в якій рівномірний розподіл частинок дисперсної фази у дисперсійному середовищі зберігається з часом. Кінетична стійкість залежить від інтенсивності теплового руху і сили притягання частинок до Землі, яка визначається їх масою.
Внаслідок теплового руху і сили земного тяжіння, що діють на частинки дисперсної фази, в системі встановлюється рівновага, яка характеризується певним розподілом дисперсних частинок у дисперсійному середовищі.
Дисперсійний аналіз – це розділ колоїдної хімії, у якому займаються вивченням методів визначення розмірів часток і розділенням дисперсних систем на фракції за розмірами.
Для визначення розмірів часток і розділення на фракції дуже грубих систем (r 10-4 м) використовують ситовий аналіз, заснований на послідовному просіюванні досліджуваного порошку через набір сит з отворами певного і послідовно зменшуваного розміру.
Для високодисперсних седиментаційно стійких систем, які не осідають (r= 10-7-10-9 м), використовують метод ультрацентрифугування та методи, що засновані на на оптичних та молекулярно -кінетичних властивостях (броунівський рух, швидкість дифузії, осмотичний тиск).
У седиментаційно нестійких системах з частками від 10 -4 до 10-6 м для визначення їх розмірів широко використовують седиментаційний метод аналізу, заснований на швидкості осідання (седиментації) часток у рідкому середовищі.
В основу метода покладено закон Стокса, що пов‟язує швидкості осідання кулеподібної частки із силою в‟язкого опору, що виникає при русі частки радіусом r.
За законом Стокса швидкість осідання часточок дорівнює:
f1 6 r U |
(1.1) |
де f1 сила в‟язкого опору;
коефіцієнт в‟язкості рідини (дисперсійного середовища); r радіус частинки, що осідає;
U швидкість частинки, що осідає. Частинка осідає під дією сили тяжіння f2.:
5

f |
2 |
4 r 3 |
( d d )g |
(1.2) |
|
|
|
0 |
|||
|
|
|
|
|
|
|
|
|
3 |
|
|
де d, d0 – густина дисперсної фази та дисперсійного середовища; g – прискорення сили тяжіння.
За заданих умов частинка з радіусом r під дією сталої сили f2 рухається з прискоренням до тих пір, поки не набере швидкості U , за якої f1=f2, після чого частинка рухається рівномірно. За умови рівноваги, після прирівнювання рівнянь (1.1) та (1.2) (f1=f2 ) отримаємо рівняння для визначення радіуса частинок:
r |
9 U |
, |
(1.3) |
2(d d0 )g |
де – в`язкість дисперсійного середовища;
Оскільки в`язкість, густина середовища та густина порошку є сталими для даної системи, їх позначають через константу К:
K |
|
9η |
|
|
|||
|
|
|
|
. |
(1.4) |
||
|
2(d d0 )g |
||||||
Тоді радіус частинок визначають із такого рівняння |
|
||||||
|
|
|
|
|
|||
|
r K U . |
(1.5) |
|||||
Отже, частинка в суспензії осідає зі сталою швидкістю, що залежить від її радіусу. Такий метод визначення розміру часточок називається
седиментаційним аналізом.
Точність методу седиментаційного аналізу визначається дотриманням припущень, за яких було виведено закон Стокса:
1)частинки повинні бути сферичними, твердими та гладкими, але визначення радіуса за рівнянням (1.5) дає не дійсний, а лише ефективний (еквівалентний) розмір частинки;
2)концентрація суспензії має бути не більше 0,3 – 0,5 %, щоб частинки не взаємодіяли, інакше під час швидкого осідання великі частинки можуть захоплювати менші, що призводить до втрати тонких фракцій;
3)не повинно бути взаємодії між дисперсною фазою та дисперсійним середовищем; якщо ця умова не виконується, то радіус частинок визначається разом із сольватною оболонкою і навіть може статися розчинення порошку;
4)швидкість осідання частинок повинна бути постійною і не перевищувати певної межі, що пов`язано з можливістю турбулентного руху в товщі рідини поблизу частинок, що швидко осідають.
Отже, метод використовується для частинок з розмірами 10–4 10–6 м. Розрахунок розмірів частинок порошку методом седиментаційного
зважування зводиться до визначення швидкості осідання суспензії. У цьому
разі замість лінійної швидкості осідання суспензії |
U |
H |
знаходимо |
|
τ |
||||
|
|
|
||
|
|
|
6 |

пропорційну їй масову швидкість осідання U ΔPΔτ – приріст маси осаду з часом.
Завдання на виконання роботи
1.Побудувати криву седиментації полідисперсної суспензії.
2.Визначити розміри частинок системи, використовуючи формули.
3.Розрахувати фракційний склад суспензії.
4.Побудувати диференціальну криву розподілу.
5.Визначити найбільш ймовірний радіус частинок.
Прилади, лабораторний посуд, реактиви
Торсійні терези з шалькою; хімічний стакан місткістю 1 л; мішалка; секундомір; лінійка; дистильована вода; порошок досліджуваної речовини (крохмаль, крейда, глина тощо).
Порядок виконання роботи
1.У склянку з водою опускають шальку і підвішують її до гачка коромисла торсійних терезів. Визначають масу шальки Р0.
2.Для приготування суспензії (концентрація не вище 0,3 – 0,5 %) наважку порошку переносять у склянку з водою і старанно перемішують мішалкою, щоб частинки дисперсної фази рівномірно розмістилися по всьому об`єму.
3.Опускають шальку в суспензію (вона не повинна торкатися ні стінок, ні дна склянки), включають секундомір і терези.
4.Проводять періодичне зважування осаду на шальці до встановлення постійної маси осаду. Результати вимірювань заносять у табл.1.1.
Таблиця 1.1
Результати зважування осаду на шальці терезів
№ |
Час , с |
Показники терезів |
Маса осаду |
|
пор. |
Р, мг |
Рос, мг |
||
|
||||
|
|
|
|
Опрацювання результатів
1.Для кожного вимірювання визначають масу осаду Poc P P0 .
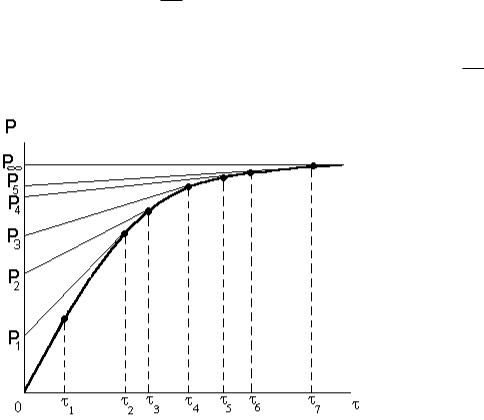
2.За даними табл. 1.1 будують криву седиментації в координатах Рос=f( ) (рис. 1.1).
3.Для побудови диференціальної кривої розподілу частинок за радіусами використовують “метод дотичних”. До шести – семи точок на кривій седиментації (див. рис. 1.1) проводять дотичні до перетину з віссю ординат.
Загальна маса осаду відповідатиме часу 7 і відрізку ОР7=100 %. 4. Величини фракцій F визначають у відсотках. Так,
7
Φ |
ΟΠ1 |
100 %, Φ |
Π1Π2 |
100 % і т. д. |
|
|
|||
1 |
ΟΠ7 |
2 |
ΟΠ7 |
|
|
|
|
5.Для часу 1, 2, ..., 7 визначають радіуси r частинок за рівнянням (1.5).
6.Визначають відношення ΔrF .
7.Дані розрахунків заносять в табл. 1.2.
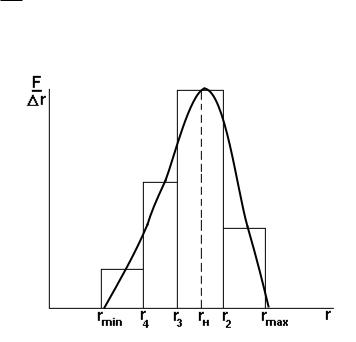
8.За даними табл. 1.2 будують диференціальну криву розподілу ΔrF f(r)
(рис.1.2).
Рис. 1.1. Крива седиментації
Таблиця 1.2
Результати розрахунків радіусів частинок дисперсної фази та відсоткового вмісту фракцій
№ |
, c |
r, мкм |
r |
F, % |
|
F |
|
пор. |
|
Δr |
|
||||
|
|
|
|
|
|
||
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
Оцінка похибки вимірювань |
|||||||
Загальна похибка |
|
|
|
|
|
||||||
|
|
|
|
|
Δr |
|
Δτ |
|
ΔP |
, |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
r |
|
τ |
|
P |
||
де |
Δτ |
і |
ΔP |
– похибки вимірювання відповідно часу і маси осаду. |
|||||||
τ |
P |
||||||||||
|
|
|
|
|
|
|
|
|
|||
Час вимірюють за допомогою секундоміра з точністю до 1 с.
8
Масу осаду вимірюють на торсійних терезах з точністю до 1мг. За даними досліду розраховують загальну похибку.
Опрацювання результатів
1.Із рис. 1.2 видно, що відсотковий склад частинок з розмірами від r1 до r5 відповідає площі під всією кривою.
2.На кривій ΔrF f(r) можна виділити три характерні розміри частинок:
мінімальний rmin , найімовірніший rн , що відповідає максимальному значенню фракції, і максимальний.
Рис.1.2. Диференціальна крива розподілу частинок за розмірами.
Максимум на кривій розподілу відповідає найбільш вірогідному розміру частинок, тобто переважної фракції досліджуваної дисперсної системи.
Питання для самоперевірки
1.Які властивості дисперсних систем називають молекулярнокінетичними?
2.Яка природа молекулярно-кінетичних явищ?
3.Що таке броунівський рух дисперсних часточок?
4.Що таке середньоквадратичний зсув часточки і як його розрахувати за теорією Ейнштейна – Смолуховського?
5.Чим обумовлена дифузія? Як визначити кількість речовини в результаті дифузії?
6.Фізичний зміст коефіцієнта дифузії і як він залежить від розміру частинок дисперсної фази?
7.Який зв‟язок між дифузією та броунівським рухом?
8.У чому причини виникнення осмосу?
9.Що таке осмотичний тиск і як його визначити?
10.Як залежить осмотичний тиск від розміру часточок?
9
11.Як кількісно охарактеризувати кінетичну стійкість системи?
12.Наведіть приклади практичного використання молекулярнокінетичних явищ в різних галузях харчових виробництв.
13.Як визначити найімовірніший радіус частинок у дисперсії?
14.Що називається дисперсністю?
15.Дайте характеристику седиментаційної стійкості колоїдних систем.
16.Сформулюйте закон Стокса.
17.У чому полягає принцип седиментаційного аналізу?
18.Охарактеризуйте седиментаційний аналіз монота полідисперсних систем.
19. Що таке фракція? Як обчислити процентний вміст фракцій? Побудова седиментаційної кривої.
20.Як побудувати диференціальну криву розподілу частинок за розмірами?
Лабораторна робота № 2
МЕТОДИ ОДЕРЖАННЯ КОЛОЇДНИХ СИСТЕМ
Мета роботи – навчитися отримувати основні колоїдні системи різними методами.
Теоретичні відомості
Колоїдними розчинами, або ліозолями, називають дисперсні системи, що складаються з дисперсної фази з частинками розміром 10-7 – 10-9м і рідкого дисперсійного середовища.
Будь-яку речовину за конкретних умов можна перевести в колоїднодисперсний стан. Наприклад, NaCl у воді утворює істинний розчин (гомогенну систему), а в бензолі – колоїдну (гетерогенну) систему. В колоїднодисперсному стані кожна частинка являє собою агрегат молекул даної речовини.
Основні умови одержання колоїдних розчинів такі:
речовина дисперсної фази практично не повинна розчинятися в дисперсійному середовищі;
концентрація золю бути невеликою;
в системі має бути присутнім третій компонент – стабілізатор.
Для приготування колоїдних розчинів треба враховувати, що вони є системами, які займають положення між грубодисперсними (суспензії та емульсії) і істинними розчинами, де речовина перебуває у вигляді молекул або іонів. Тому колоїдні розчини можуть бути отримані подрібненням грубих частинок на дрібніші – метод диспергації, або шляхом агрегації молекул у більші частинки – методи конденсації та пептизації.
Диспергування здійснюють у віброкульових млинах, тощо.
Емульсіями називаються дисперсні системи, що складаються з двох не змішуваних рідин, одна з яких міститься в другій у вигляді краплинок розміром
10
