
ДВЗ конспекти лекций нова прог
.pdf
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ РІВНЕНСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ВОДНОГО ГОСПОДАРСТВА ТА ПРИРОДОКОРИСТУВАННЯ РІВНЕНСЬКИЙ АВТОТРАНСПОРТНИЙ КОЛЕДЖ
Конспект лекцій
для вивчення предмету “Автомобільні двигуни” спеціальність 5.07010602 “Обслуговування та ремонт автомобілів і
двигунів”
м. Рівне – 2014
Зміст
1.Анотація……………………………………………………………………….
2.Газові закони і термодинамічні процеси…………………………………....
3.Теоретичні цикли………………………………………………………….......
4.Дійсні цикли. Показники робочого циклу і двигуна.………………………
5.Тепловий баланс двигуна. ……………………………………………….......
6.Карбюрація……………………………………………………………………. 7.Сумішоутворення у дизельних двигунах…………………………………….
8.Характеристики автомобільних двигунів……………………………………
9.Кінематика КШМ…………………………………………………………….
10.Динамміка КШМ…………………………………………………………….
11.Зрівноваження двигунів…………………………………………………….
12.Конструкція КШМ і ГРМ…………………………………………………..
13.Конструкція систем охолодження і мащення…………………………….
14.Перспективи розвитку двигунів……………………………………………
Заняття № 1. Газові закони та цикли.
План заняття.
1.Мета: зміст предмету . Література.
2.Загальні поняття про газ.
3.Перший закон термодинаміки.
4.Замкнутий процес.
5.Цикл Карно.
6.Другий закон термодинаміки.
7.Цикл компресора.
1.Предмет ДВЗ є другим розділом предмету "Автомобілі".
Мета предмету: Дати студентам необхідні відомості про особливості робочих процесів, які відбуваються в автомобільних двигунах. Навчити дослідно визначати і оцінювати потужність економічність двигунів, ознайомити з принципами конструювання, вибору матеріалів і термообробки основних деталей двигунів.
Зміст предмету. В першій частині викладаються основи технічної термодинаміки. В другій частині даються основи гідравліки, а також розглядають конструкцію механізмів та систем. Література: 1. Коденцев і інші " ДВЗ ", Київ, 1974.
2. Богданов і інші " Автомобільні двигуни ",Машинобудування, 1987.
Технічна термодинаміка вивчає перетворення теплоти на роботу в Теплових двигунах і практичних способів цього перетворення.
2. Загальні поняття про газ.
Природні гази, між молекулами яких існують сили молекулярного зчеплення, а самі молекули займають якийсь об'єм, прийнято називати реальними. Теоретично вивчити властивості цих газів дуже важко, а закономірності вивчені експериментально, мають складний характер. Тому для одержання простих розрахунків вивчаємо ідеальний газ.
Ідеальним газом називають неіснуючий в природі газ, що складається з абсолютно пружним молекул, між якими не діють сили взаємного притягання, а об'єм який займають молекули, зникаючи малий порівняно з об'ємом газу, тобто не мають розміру. Параметри, які характеризують газ: Тиск - Ρ (Па), (Н/м 2); Температура - Τ (К); Об'єм-V (м3).
Температура газу - це міра кінетичної енергії поступово рухомих молекул газу, яка характеризує ступінь нагріву газу. Вимірюється термометром.
Тиск - це відношення сили тиску газу до одиниці площі. Вимірюється барометром, манометром, вакуумметром. Розрізняють: Абсолютний тиск - (Рабс ); Надлишковий тиск - (Рнадл); Тиск розрідження (вакум) - (Рвак)
Рабс = Рнадл + Рбар ( при надлишковому тиску) Рабс = Рбар – Рвак ( при вакуумі )
В розрахунках треба користуватися тільки Рабс
Питомий об'єм - це об'єм одиниці маси речовини (υ). υ =V/M (м3 /кг)
Густина - це маса одиниці об'єму речовини (ρ – величина обернена до питомого об’єму) ρ =М/V(кг/м3); υ ρ =l
Нормальні умови газу: Рн = 101,3 кПА ; Тн = 273 К.
3. Перший закон термодинаміки є частковим випадком закону, збереження і перетворення енергії (енергія не зникає і не виникає знов, а тільки переходить з одного виду в інший, або передається від одного типа енергії іншому).
3.1 Теплова енергія може перетворюватися в механічну, а механічна в теплову в еквівалентних кількостях. Q = AW ( загальна формула першого закону термодинаміки) де Q - кількість теплової енергії - (Дж); W – кількість механічної енергії - (Дж).
А= Q / W - термічний еквівалент механічної роботи в системі СІ А=1.
Згідно закону збереження енергії, загальний запас енергії ізольованої термодинамічної системи при любих перетвореннях остається постійним.
∆Q+∆U+∆W= 0 це є основне рівняння першого закону термодинаміки. Або
∆Q=∆U+∆W
3.2. Термодинамічним процесом називається процес зміни стану робочого тіла, який супроводжується зміною його параметрів.
Всякий процес здійснюється в одному з двох напрямків, один з яких називається прямим, а другий зворотнім.
Роздивимося термодинамічний процес прямий 1 - 2 (розширення). Для його здійснення потрібно підведення деякої кількості теплоти ∆Q до робочого тіла (в цей час зменшилася внутрішня енергія U2 < U1· За рахунок роботи розширення запас механічного акумулятора збільшується на ∆W.
Нехай процес здійснюється в зворотному напрямку 2-1 (стиснення) це потребує витрати енергії механічного акумулятора, а в тепловий акумулятор вернеться теж сама кількість ∆Q теплоти, то такий процес буде зворотним.
Таким чином зворотнім процесом є такий процес, при здійснені якого в прямому і зворотних напрямках всі елементи термодинамічні системи (робоче тіло, тепловий і механічний акумулятори) повертається в початковий стан.
1.1.Схема перерозподілу енергії в термодинамічній системі.
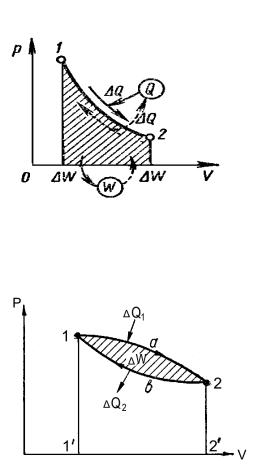
4. Замкнутий процес. Сукупність двох або кількох процесів, в результаті здійснення яких робоче тіло повертається до початкового стану, називається замкнутим процесом, або циклом. Реальні процеси перетворення не зворотні.
Графічно в PV координатах коловий процес зображений замкнутим контуром 1. a -2 - в -1, у якому лінія 1'- а -2' розширена лінія 2 - в -1' стиснення.
Робота розширення |
ΔWP= 1 - а - 2 - 2' - 1' - 1. |
Робота стиснення |
ΔWc= 2 - в - 1 - 1' - 2' - 2 |
||||||||
Корисна робота ΔW = ΔWP – ΔWC = 1 - а - 2 - в - 1 |
, |
ΔW = ΔQ1 – ΔQ2 |
|||||||||
|
|
W |
|
Q1 Q2 |
1 |
|
Q |
|
ηt = 1 |
T |
|
Термічний ККД: |
ηt = |
|
|
2 |
, |
2 |
|
||||
Q |
Q |
Q |
T |
||||||||
|
|
|
|
1 |
|
|
1 |
|
|
1 |
|
5. Цикл Карно. Припустимо що газ, який є робочим тілом може періодично з'єднуватися, то з гарячим джерелом теплоти (тепловіддавачем) з температурою Т1 то з холодним джерелом (теплоприймачем) з температурою Т2.

Цикл Карно складається з двох ізотерм 1- 2 і 3 - 4 і двох адіабат 2 - 3 і 4 - 1. |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
На ділянці 1-2 робоче тіло з'єднується з джерелом гарячим Т1, |
|
а на ділянці 3 - 4 з холодним |
|||||||||||||||||||||||||||||||||||||||||||||||||||
джерелом Т2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Робота виконана за цикл: |
|
|
|
|
ΔW =ΔQ1 – ΔQ2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
Термічний ККД: |
|
ηt = 1 |
Q2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
Q1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
ΔQ1 =2,3RT1lg |
V2 |
|
, |
|
|
|
|
(1) |
|
та |
|
|
ΔQ2 = 2,3RT2lg |
V3 |
|
|
|
|
|
|
|
|
|
(2) |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,3RT lg |
V3 |
|
|
|
T lg |
V3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q2 |
|
|
2 |
|
|
V4 |
|
|
|
2 |
|
V4 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
поділивши ці рівняння друге на перше : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q |
2,3RT1 lg |
V2 |
|
|
|
|
T1 lg |
V2 |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
V |
|
|
T |
k 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
T |
k 1 |
|
||||||||||||||||
для адіабати 2-3 : |
|
|
3 |
|
|
|
1 |
|
|
|
(3) |
; |
|
|
|
для адіабати 4 - 1 : |
|
|
|
|
4 |
|
1 |
|
|
( 4) |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|||||||||||||||
Порівняємо рівняння ( 3 ) і ( 4 ) і отримаємо пропорцію |
|
|
V3 |
|
V4 |
|
|
або |
|
V3 |
|
|
V2 |
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
|
|
V1 |
|
|
|
|
|
|
|
|
V4 |
|
V1 |
|
||||||||||
Тому |
lg |
V2 |
lg |
V3 |
|
, отже |
|
|
Q2 |
T2 |
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
V |
V |
|
|
|
|
|
|
|
|
|
|
|
Q |
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
1 |
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
тобто температурний |
|
ККД : |
|
|
1 |
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
t |
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Висновок:
Цикл Карно є ідеальним і в реальних двигунах нездійсненим, тому що ізотермічні і адіабатні процеси здійснити неможливо. Цикл Карно має велике прагматичне значення, бо за допомогою його можна оцінювати максимальний ККД будь - яких теплових двигунів у певних умовах.
6. Другий закон термодинаміки.
У колових процесах неможливо повністю перетворити підведену теплоту в роботу: частина теплоти неминуче буде віддана холодному джерелу теплоти.
Отже робота замкнутого процесу дорівнює ΔW = ΔQ1 – ΔQ2 Висновки:
1.Неможливо забезпечити роботу періодично діючого двигуна, в системі тільки з одним джерелом теплоти, або у системі, де у кількох джерел нема кінцевого перепаду температур.
2.Теплота сама по собі не може передаватися від тіла з нижчою температурою до тіла з вищою температурою.
Цей закон поклав кінець спробам створити вічний двигун другого роду, тобто двигун, що працює з одним джерелом теплоти.
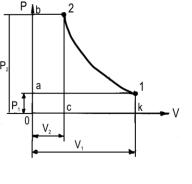
7. Цикл компресора.
Зображення циклу компресора в РV координатах:
Цикл компресора складається: із ізобари всмоктування а-1; криву 1-2, називають – адіабата стиску; 2- в, ізобара випуску.
Корисну роботу, що затрачається на дію компресора, можна визначити як суму робіт
стиснення і виштовхування мінус роботу всмоктування |
|
|
|
|||||
Wk = Wст +Wвишт – Wвсм (5) |
|
|
|
|
|
|
||
Робота всмоктування |
Wвсм = площі a -1-k-o-a = V1P1 |
|
|
|||||
Робота стиску |
Wст = площі 1 -2-c-k-1 = |
1 |
P V P V |
|||||
|
||||||||
|
|
|
k 1 |
2 |
2 |
1 |
1 |
|
|
|
|
|
|
|
|
||
Робота виштовхування Wвишт = площі 2 -b-o-c-2 = V2P2
Отримані роботи підставимо у формулу (5) і получимо кінцеву формулу корисної роботи компресора.
|
|
|
|
|
|
|
k 1 |
||
|
k |
|
|
P |
|
k |
|
||
|
|
|
|
|
2 |
|
|
||
Wk = |
|
|
PV |
|
|
|
|||
k 1 |
P |
||||||||
|
1 1 |
|
|
||||||
|
|
|
|
|
1 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 - робота компресора з адіабатним стисненням
Заняття 1.
Газові закони і термодинамічні процеси.(самостійно)
План уроку.
1.Газові закони. Суміш газів.
2.Теплоємність.
3.Ізохорний, ізобарний, ізотермічний, адіабатний і політропний процеси.
4.Зображення цих процесів в Р - V координатах, зв'язок параметрів. Роботи процесу і кількість теплоти.
3.Газові закони. Суміш газів.
3.1. Закон Бойля - Маріота. Якщо зміна стану газ відбувається при сталій температурі, то питомі об'єми обернено-пропорційні тискам, при Т= const
υ 1/ υ 2=P2/P1 або P1 υ1 = P2 υ 2 ; тобто P υ = const ( загальна формула)
3.2. 3акон Гей - Люсака. Якщо зміна стану газу відбудеться при сталому тиску, то питомі об'єми прямо пропорційні абсолютним температурам, при Р= const
υ 1/ υ 2 =Ti/T2 або υ 1/T1= υ 2 /T2 ; |
тобто υ /T-const ( загальна формула) |
З.З. Закон Шарля. Якщо зміна стану газу відбувається при сталому об'ємі, то тиски газів |
|
прямо пропорційні абсолютним температурам, при V= const |
|
Р1/Р2=Т1/Т2 або Р1/Т1=Р2/Т2 |
тобто Р/Т= const ( загальна формула) |
Характеристичне рівняння встановлює залежність між основними параметрами стану газу Ρ; V; Τ |
|
в випадку коли кожен не є сталим. P υ /T- const ; або P υ /T=R ((Н/м2 м3/кг)/К) = Дж/Кг К ; |
|
R - стала величина, тоді |
|
P υ =RТ - це рівняння для одного кілограму газу, а для m кілограмів газу, так як υ =V/M; PV=mRT - Рівняння Клапейрона для любої кількості газу.
3.4. Закон Авогадро. В ідеальних газах при однакових тисках і температурах в однакових об'ємах міститься однакова кількість молекул, при Ρ; V; T – const. Добуток молекул маси та питомий об'єм μυ = const ( загальна формула закона авогадро). Величина μυ - являє собою об'єм одного кіломоля.
Кіломолем (1 КМоль) називається кількість речовини, маса якої в (кг) дорівнює її молекулярній масі. Об'єм 1 КМоля при нормальних умовах газу: Рн = 101,3 кПА ; Тн = 273 К; дорівнює 22,4 м3/КМоль
μυ н =22,4 м3/КМоль; звичайно υн = 22,4/μ (м3/кг); ρн = μ/22,4(кг/м3)
Рівняння стану для 1 КМоля газу звуть Рівнянням Клапейрона – Менделєєва
ΡVμ = 8314 Τ, або ΡV=8314m/μΤ; де
Vμ- об'єм одного кіло моля; Vμ =М/ V; m - маса газу;
Μ - кількість кіло молів газу; μ - маса одного кіломоля; V - повний об'єм газу. Фізична суть: універсальної сталої і газової сталої, або 8314 - стала Менделєєва
Універсальна газова стала - це робота одного кіломоля газу при нагріві його на один кельвін в умовах сталого тиску.
R=8314/μ (Дж/кг К)
Газова стала - це робота одного кілограма газу при нагріві його на один кельвін в умовах постійного тиску.
3.5. Газова суміш - це механічна суміш кількох газів які між собою хімічно не взаємодіють. Гази що утворюють суміш, називаються компонентами. Тиск який утворюють компоненти суміші називають порціальним. Газові суміші підпорядковуються тим самим законам, що і одинарні гази.
За законом Дальтона при сталій температурі і відсутності хімічної реакції тиск газової суміші (Рсум) дорівнює сумі порціальних тисків компонентів які утворюють суміші.
Рсум=Р1+Р2+Р3+...+Рn
Для об’ємів Vсум=V1+V2+VЗ+ … +Vn; об'єм суміші дорівнює сумі об'ємів компонентів. Для мас: Μсум=М1+М2+Μ3+...+Μn; маса суміші дорівнює сумі мас компонентів.
Масовою часткою називається відношення маси компонента до маси всієї суміші. Якщо
масову частку позначити (g), то: g1=M1/Mсум; g2=M2/Mсум; g3=M3/Mсум. gl + g2 + g3 + … +gn = 1

Об’ємною часткою називається відношення об’єму компонента до об’єму всієї суміші
r1=V1/Vсум; r2=V2/Vсум; r3=V3/Vсум.
r1 + r2 + r3+ ... +rn = 1
4. Питомою теплоємністю називається кількість теплоти, яку треба підвести до одиниці кількості речовини (або відвести від неї) щоб підвищити (або знизити) її температуру на один Кельвін. Залежно від вибраної одиниці вимірювання кількості речовини розрізняють: масову, об'ємну і мольну теплоємність.
Теплоємність 1кг маси газу називають масою теплоємністю - С (Дж/кг К)
Теплоємність 1м3 газу за нормальних умов називається об'ємною теплоємністю - С - (Дж/м3 К) Теплоємність 1 КМоль називають мольною теплоємністю μС (Дж/КМоль К)
Взаємозв'язок параметрів С=μС/μ; С'=С ρ; або С'=μС/22,4=μС/ Vμ; де ρ - густина газу; Vμ - об'єм одного кіло моля газу.
Теплоємність при сталих об'ємах і тисках позначається- (Ср_ і Cv )
Ср − Cv = R - Рівняння Майєра,
помножимо на молекулярну масу μ , отримаємо μСр − μCv = μR
μСР - μCv = 8314, різниця між молярними теплоємністями при сталому тиску і об'ємі для всіх ідеальних газів однакова і дорівнює 8314 (Дж /КМоль К)
Відношення Ср / Cv =К - є показником адіабати.
5.Термодинамічні процеси
5.1.Ізохорним процесом називається процес зміни стану робочого тіла, який відбудеться при сталому об'ємі. Практично близьким до ізохорного процесу буде процес, який відбувається в герметично закритому посуді, при теплообміні між робочим тілом і джерелом теплоти.
|
|
P |
|
T |
|
|
На підставі закона Шарля можна записати: |
1 |
1 |
, де V = const |
|||
P2 |
T2 |
|||||
|
|
|
|
|||
Згідно першого закону термодинаміки: ΔQ = ΔU + ΔW , |
||||||
ΔU = mСv(T1 – T2) |
(Дж) |
|
|
|
|
|
ΔW =0 , тому ΔQ = ΔU |
|
|
|
|
||
В ізохорному процесі, який проходить без здійснення роботи (W = 0 ), внутрішня енергія робочого тіла змінюється за рахунок підводів або відводів тепла.
5.2.Ізобарний процес це процес зміни стану робочого тіла, який відбувається при сталому тиску. Практично близьким до ізобарного процесу буде процес, що відбувається в циліндрі, щільно закритому рухомим поршнем, який має стале зовнішнє навантаження при наявності теплообміну із зовнішнім середовищем. Співвідношення між параметрами здійснюється на основі закона Гей –Люсака :
V1 |
|
T1 |
де: Р – const |
|
V2 |
T2 |
|||
|
|

Згідно першому закону термодинаміки: |
ΔQ = ΔU + ΔW (Дж) |
ΔU = mСv(T1 – T2) |
(Дж) |
ΔW = P(V2 – V1) = mR (T2 – T1)
ΔQ = mСv (T2 – T1) + mR (T2 – T1) = m(Сv + R) ΔT = mСp ΔT
5.3.Ізотермічним процесом називається процес зміни стану робочого тіла, який відбувається при сталій температурі. Процес, практично близький до ізотермічного, можна здійснити при вільному стисненні газу рухомим поршнем у циліндрі, який піддається інтенсивному охолодженню.
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
V |
|
|
|
|
|
|
|
На підставі закону Бойля-Маріотта можна записати: |
1 |
2 |
, |
PV = const при Т = const |
||||||||||||||||||
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
P2 |
|
V1 |
|
|
|
|
|
|
|
Згідно першого закону термодинаміки : |
ΔQ = ΔU + ΔW |
(Дж) |
|
|
|
|
||||||||||||||||
ΔU = Cv( T2 – Т1) , |
так як Т1 = Т2 , |
тоді |
|
ΔU = 0 , |
|
|
ΔW = ΔQ |
|
||||||||||||||
З стану рівняння |
|
PV = RT , |
Р = |
RT |
|
підставимо ΔW |
|
|
|
|
|
|
|
|
||||||||
V |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Замінимо натуральний логарифм на десятковий, |
ΔW = 2,3RT lg |
V2 |
враховуючи, що |
|
||||||||||||||||||
|
V1 |
|
|
|||||||||||||||||||
|
P |
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
PV= RT і |
1 |
|
1 |
отримаємо чотири рівняння: |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
P2 |
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
V |
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
V |
|
P |
||||
1) ΔQ = 2,3 RT lg |
|
2 |
; |
2) ΔQ = 2,3 RT lg |
1 |
; 3) ΔQ = 2,3 Р1V1lg |
2 |
; 4) ΔQ = 2,3P1V1lg |
1 |
|||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
V |
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
V |
|
P |
|||
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
1 |
|
2 |
|||
5.4.Адіабатним процесом називається процес зміни стану робочого тіла, який відбувається при теплообміну із зовнішнім середовищем, тобто ΔQ = 0.
Щоб здійснити адіабатний процес, робоче тіло треба вмістити в циліндр з ідеальною теплоізоляцією з навколишнім середовищем, оскільки такої ізоляції в природі не існує, то ідеальний процес здійснити не можливо.
Процес близький до адіабатного, можна здійснити в циліндрі з рухомим поршнем, якщо відбувається він дуже швидко (швидкохідні двигуни).
Рівняння адіабати: |
PVk= const |
(1) |
Це рівняння показує, |
що в координатах РV процес зображується нерівнобічною гіперболою. |
|
P |
V |
k |
|
|
2 |
|
1 |
|
(2) |
|
|
|||
P |
V |
|
|
|
1 |
2 |
|
|
|
Для отримання зв'язків між параметрами напишемо рівняння Клапейрона-Менделєєва для двох точок (1 і 2 )
Р1V1 = 8314mT1 |
(3) |
P2V2 = 8314mT2 |
(4) |
|
P |
|
V |
|
T |
|
P |
|
V |
k |
|
поділимо одне рівняння (4) на друге (3) і отримаємо: |
2 |
|
2 |
|
2 |
, замінимо |
2 |
на |
|
1 |
, |
|
|||||||||||
|
P |
|
V |
|
T |
|
P |
|
V |
|
|
|
1 |
|
1 |
|
1 |
|
1 |
|
2 |
|
|
|
T |
V |
k 1 |
|
|
тоді отримаємо |
2 |
|
1 |
|
(5) |
|
|
||||
|
T1 |
|
|
|
|
|
V2 |
|
|
||
Роздивимося процес з точки зору перетворення енергії.
Згідно першого закону термодинаміки ΔQ = ΔU + ΔW , так як Q = 0 , то
ΔW = – ΔU , ΔU = mCv ( Т2 – Т1 ) = – ΔW , через молярну теплоємність ΔU = mμCvΔT , через
1 |
|
|
|
другі параметри ΔW = |
|
(P1V1 |
– P2V2) = – ΔU |
k 1 |
|||
5.5.Політропний процес. Вище ми роздивилися процеси, де на протікання їх були накладені певні обмеження які характеризують постійність одного з параметрів стану робочого тіла. ( V = const, Р = const, Т = const і Q = 0 ( відсутність теплообміну) ). Але є багато процесів, де всі параметри змінюються, а також здійснюється теплообмін. При цьому в процесах перетворення і перерозподілу енергії беруть участь всі елементи термодинамічних систем. І перетворення можуть проходити в обох напрямках.
Політропним зветься процес зміни стану робочого тіла при протіканні якого співвідношення зміни внутрішньої енергії робочого тіла до зміни енергії теплового акумулятора залишається
сталим під час здійснення цього процесу |
|
Ψ = |
U |
|||||||||||||||||
|
Q |
|||||||||||||||||||
Рівняння політропи |
|
PVn = 0 , |
|
де n - показник політропи. |
||||||||||||||||
Так як рівняння політропи аналогічно рівнянню адіабаті, то всі формули аналогічні, тільки |
||||||||||||||||||||
показник k |
замінити на n. |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
V |
n |
|
|
V |
n 1 |
|
|
|
|
|
|
n 1 |
|
|
|
|||
|
P |
T |
|
T |
|
P |
n |
|
1 |
|
||||||||||
|
2 |
|
1 |
|
2 |
|
|
1 |
|
|
2 |
|
|
2 |
|
|
|
|
||
|
P |
V |
; |
T V |
|
; |
T |
|
|
P |
|
; ΔW = n 1 (P1V1 – P2V2) ; ΔQ = mCp(T2 – T1). |
||||||||
1 |
2 |
|
1 |
|
2 |
|
|
1 |
|
|
1 |
|
|
|
|
|||||
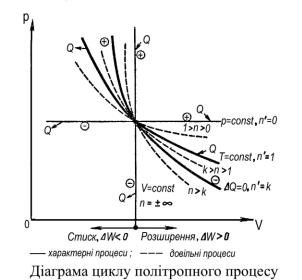
Аналіз зведеної діаграми політропних процесів.
Нанесемо в РV координатах лінії чотирьох характерних процесів (V– const ; P– const ; Т – const ; ΔQ = 0 ). Крім цих процесів можна через точку перетинання провести безкінечну кількість ліній політроп, їх розташування і форми будуть залежати від значення політропи.
Аналізуємо діаграму і робимо висновок:
1. Чим більше абсолютне значення ( n ), тим крутіша крива процесу . Використовуючи це правило визначимо:
-політропи з показниками 1>n>0 розташовані між ізобарою і ізотермо;
-політропи з показниками k>n>1 розташовані між ізотермою і адіабатою;
-політропи з показниками n>k розташовані між адіабатою і ізохорою.
