
методичка до розрахи
.pdf
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Варі- |
дос- |
Т, К |
|
|
|
Експериментальні кінетичні дані |
|
|
|
||||
ант |
лід |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
3 |
313 |
, с |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,500 |
0,934 |
|
0,736 |
0,626 |
0,554 |
0,503 |
0,463 |
0,432 |
0,406 |
||
|
|
|
|
||||||||||
|
1 |
275 |
, с |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,250 |
1,129 |
|
1,037 |
0,964 |
0,905 |
0,856 |
0,814 |
0,777 |
0,745 |
||
|
|
|
|
||||||||||
8 |
2 |
285 |
, с |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
с, моль/л |
1,250 |
0,937 |
|
0,781 |
0,684 |
0,615 |
0,564 |
0,524 |
0,491 |
0,464 |
|||
|
|
|
|
||||||||||
|
3 |
295 |
, с |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,250 |
0,650 |
|
0,494 |
0,414 |
0,364 |
0,328 |
0,301 |
0,280 |
0,263 |
||
|
|
|
|
||||||||||
|
1 |
298 |
, с |
0 |
10 |
|
15 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,500 |
1,096 |
|
0,966 |
0,712 |
0,606 |
0,527 |
0,467 |
0,419 |
0,380 |
||
|
|
|
|
||||||||||
9 |
2 |
308 |
, с |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
50 |
с, моль/л |
1,500 |
0,952 |
|
0,805 |
0,697 |
0,615 |
0,550 |
0,497 |
0,454 |
0,387 |
|||
|
|
|
|
||||||||||
|
3 |
318 |
, с |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
50 |
|
с, моль/л |
1,500 |
0,790 |
|
0,639 |
0,536 |
0,462 |
0,406 |
0,362 |
0,327 |
0,273 |
||
|
|
|
|
||||||||||
|
1 |
300 |
, с |
0 |
10 |
|
15 |
30 |
40 |
50 |
60 |
80 |
100 |
|
с, моль/л |
2,000 |
1,515 |
|
1,318 |
0,869 |
0,658 |
0,498 |
0,377 |
0,216 |
0,124 |
||
|
|
|
|
||||||||||
10 |
2 |
310 |
, с |
0 |
10 |
|
15 |
20 |
25 |
30 |
40 |
50 |
70 |
с, моль/л |
2,000 |
1,119 |
|
0,837 |
0,626 |
0,468 |
0,350 |
0,196 |
0,109 |
0,034 |
|||
|
|
|
|
||||||||||
|
3 |
320 |
, с |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
с, моль/л |
2,000 |
0,596 |
|
0,326 |
0,178 |
0,097 |
0,053 |
0,029 |
0,016 |
0,009 |
||
|
|
|
|
||||||||||
|
1 |
298 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
с, моль/л |
1,500 |
1,378 |
|
1,320 |
1,265 |
1,213 |
1,162 |
1,114 |
1,068 |
1,023 |
||
|
|
|
|
||||||||||
11 |
2 |
308 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
45 |
с, моль/л |
1,500 |
1,265 |
|
1,162 |
1,068 |
0,981 |
0,901 |
0,827 |
0,760 |
0,698 |
|||
|
|
|
|
||||||||||
|
3 |
318 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
с, моль/л |
1,500 |
1,068 |
|
0,901 |
0,760 |
0,641 |
0,541 |
0,456 |
0,385 |
0,325 |
||
|
|
|
|
||||||||||
|
1 |
313 |
, хв |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,200 |
1,054 |
|
0,952 |
0,874 |
0,813 |
0,763 |
0,721 |
0,685 |
0,654 |
||
|
|
|
|
||||||||||
12 |
2 |
323 |
, хв |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
с, моль/л |
1,200 |
0,952 |
|
0,813 |
0,721 |
0,654 |
0,604 |
0,563 |
0,530 |
0,502 |
|||
|
|
|
|
||||||||||
|
3 |
333 |
, хв |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,200 |
0,813 |
|
0,654 |
0,563 |
0,502 |
0,457 |
0,422 |
0,394 |
0,371 |
||
|
|
|
|
||||||||||
|
1 |
318 |
, хв |
0 |
10 |
|
15 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,300 |
1,089 |
|
1,007 |
0,822 |
0,732 |
0,660 |
0,601 |
0,552 |
0,510 |
||
|
|
|
|
||||||||||
13 |
2 |
328 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
50 |
с, моль/л |
1,300 |
0,869 |
|
0,746 |
0,653 |
0,581 |
0,523 |
0,476 |
0,436 |
0,374 |
|||
|
|
|
|
||||||||||
|
3 |
338 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
50 |
|
с, моль/л |
1,300 |
0,573 |
|
0,448 |
0,367 |
0,312 |
0,270 |
0,239 |
0,214 |
0,177 |
||
|
|
|
|
||||||||||
|
1 |
288 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
с, моль/л |
1,500 |
1,255 |
|
1,149 |
1,051 |
0,961 |
0,879 |
0,804 |
0,736 |
0,673 |
||
|
|
|
|
||||||||||
14 |
2 |
298 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
45 |
с, моль/л |
1,500 |
1,108 |
|
0,952 |
0,818 |
0,703 |
0,604 |
0,519 |
0,446 |
0,384 |
|||
|
|
|
|
||||||||||
|
3 |
308 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
с, моль/л |
1,500 |
0,897 |
|
0,694 |
0,537 |
0,415 |
0,321 |
0,248 |
0,192 |
0,148 |
||
|
|
|
|
||||||||||
|
1 |
273 |
, хв |
0 |
10 |
|
15 |
30 |
40 |
50 |
60 |
80 |
100 |
|
с, моль/л |
1,450 |
1,341 |
|
1,290 |
1,147 |
1,061 |
0,982 |
0,908 |
0,777 |
0,665 |
||
|
|
|
|
||||||||||
15 |
2 |
283 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
40 |
50 |
70 |
с, моль/л |
1,450 |
1,129 |
|
0,997 |
0,879 |
0,776 |
0,685 |
0,533 |
0,415 |
0,252 |
|||
|
|
|
|
||||||||||
|
3 |
293 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
50 |
|
с, моль/л |
1,450 |
0,652 |
|
0,437 |
0,293 |
0,197 |
0,132 |
0,088 |
0,059 |
0,027 |
||
|
|
|
|
||||||||||
|
1 |
278 |
, хв |
0 |
10 |
|
15 |
30 |
40 |
50 |
60 |
80 |
100 |
|
с, моль/л |
1,250 |
1,034 |
|
0,952 |
0,769 |
0,681 |
0,612 |
0,555 |
0,468 |
0,405 |
||
|
|
|
|
||||||||||
16 |
2 |
288 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
60 |
с, моль/л |
1,250 |
0,752 |
|
0,628 |
0,538 |
0,471 |
0,419 |
0,377 |
0,343 |
0,252 |
|||
|
|
|
|
||||||||||
|
3 |
298 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
60 |
|
с, моль/л |
1,250 |
0,404 |
|
0,301 |
0,241 |
0,200 |
0,171 |
0,150 |
0,133 |
0,092 |
||
|
|
|
|
||||||||||
|
1 |
285 |
, хв |
0 |
10 |
|
15 |
30 |
40 |
50 |
60 |
70 |
80 |
17 |
с, моль/л |
1,500 |
1,067 |
|
0,899 |
0,539 |
0,383 |
0,273 |
0,194 |
0,138 |
0,098 |
||
|
|
|
|||||||||||
2 |
295 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
40 |
50 |
60 |
|
|
|
||||||||||||
|
с, моль/л |
1,500 |
0,746 |
|
0,526 |
0,371 |
0,261 |
0,184 |
0,092 |
0,046 |
0,023 |
||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Варі- |
дос- |
Т, К |
|
|
|
Експериментальні кінетичні дані |
|
|
|
||||
ант |
лід |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
3 |
305 |
, хв |
0 |
4 |
|
8 |
12 |
16 |
20 |
24 |
28 |
32 |
|
с, моль/л |
1,500 |
0,846 |
|
0,477 |
0,269 |
0,151 |
0,085 |
0,048 |
0,027 |
0,015 |
||
|
|
|
|
||||||||||
|
1 |
215 |
, хв |
0 |
10 |
|
15 |
30 |
40 |
50 |
60 |
80 |
100 |
|
с, моль/л |
0,800 |
0,702 |
|
0,661 |
0,563 |
0,513 |
0,471 |
0,435 |
0,377 |
0,333 |
||
|
|
|
|
||||||||||
18 |
2 |
225 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
60 |
с, моль/л |
0,800 |
0,615 |
|
0,551 |
0,500 |
0,457 |
0,421 |
0,390 |
0,363 |
0,285 |
|||
|
|
|
|
||||||||||
|
3 |
235 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
35 |
40 |
60 |
|
с, моль/л |
0,800 |
0,486 |
|
0,406 |
0,349 |
0,306 |
0,272 |
0,245 |
0,223 |
0,164 |
||
|
|
|
|
||||||||||
|
1 |
288 |
, хв |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,250 |
1,082 |
|
0,968 |
0,883 |
0,818 |
0,765 |
0,721 |
0,684 |
0,652 |
||
|
|
|
|
||||||||||
19 |
2 |
298 |
, хв |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
с, моль/л |
1,250 |
0,864 |
|
0,700 |
0,604 |
0,539 |
0,491 |
0,455 |
0,425 |
0,400 |
|||
|
|
|
|
||||||||||
|
3 |
308 |
, хв |
0 |
10 |
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
1,250 |
0,584 |
|
0,438 |
0,365 |
0,320 |
0,288 |
0,264 |
0,245 |
0,230 |
||
|
|
|
|
||||||||||
|
1 |
302 |
, хв |
0 |
10 |
|
15 |
30 |
40 |
50 |
60 |
80 |
100 |
|
с, моль/л |
2,000 |
1,835 |
|
1,758 |
1,545 |
1,418 |
1,301 |
1,194 |
1,005 |
0,846 |
||
|
|
|
|
||||||||||
20 |
2 |
312 |
, хв |
0 |
10 |
|
15 |
20 |
25 |
30 |
40 |
50 |
60 |
с, моль/л |
2,000 |
1,434 |
|
1,214 |
1,028 |
0,870 |
0,736 |
0,528 |
0,378 |
0,271 |
|||
|
|
|
|
||||||||||
|
3 |
322 |
, хв |
0 |
4 |
|
8 |
12 |
16 |
20 |
24 |
30 |
40 |
|
с, моль/л |
2,000 |
1,195 |
|
0,714 |
0,426 |
0,255 |
0,152 |
0,091 |
0,042 |
0,012 |
||
|
|
|
|
||||||||||
Задача 2
При зливанні розбавлених розчинів речовин А і В (табл. 2) утворюється гідрозоль.
1.Запишіть рівняння реакції, що протікає. Зобразіть формулу міцели, що утвориться при надлишку речовини А, та формулу міцели коли у надлишку речовина В. Вкажіть знак колоїдної частинки в кожному з випадків.
2.Який з рекомендованих коагуляторів C має найбільшу коагуляційну здатність по відношенні до отриманих міцел?
3.Зобразіть графік залежності потенціалу від відстані в ПЕШ міцели згідно з теорією Штерна. Покажіть на графіку адсорбційний шар, дифузійний шар та площину, на якій виникає електрокінетичний потенціал.
4.Як змінитьтся міцела, потенціал адсорбційного шару та -потенціал при введені в отримані золі електроліту D?
|
|
|
|
Таблиця 2 |
|
|
|
|
|
Варіант |
A |
B |
C |
D |
|
|
|
|
|
1 |
NaCl |
AgNO3 |
KCl, K2SO4, Ca(NO3)2 |
CaCl2 |
2 |
AgNO3 |
KBr |
KI, K2SO4, AlCl3 |
K2CO3 |
3 |
Cu(NO3)2 |
NaOH |
NaCl, Na2CO3, CuSO4 |
Ca(NO3)2 |
4 |
Na2S |
(CH3COO)2Pb |
Na2HPO4, LiNO3, Fe2(SO4)3 |
AlCl3 |
5 |
BaCl2 |
CuSO4 |
KCl, CH3COONa, Ca(NO3)2 |
NaCl |
6 |
KCNS |
HgCl2 |
KCl, K2SO4, Ca(NO3)2 |
BaCl2 |
7 |
KOH |
AlCl3 |
KI, K2SO4, AlCl3 |
Na2S |
8 |
NH4OH |
FeCl3 |
NaCl, Na2CO3, CuSO4 |
K2SO4 |
9 |
KI |
AgNO3 |
Na2HPO4, LiNO3, Fe2(SO4)3 |
KCl |
10 |
NiCl2 |
(NH4)2S |
KCl, CH3COONa, Ca(NO3)2 |
AgNO3 |
11 |
MgCl2 |
NaOH |
KCl, K2SO4, Ca(NO3)2 |
MgSO4 |
12 |
(NH4)2S |
AgNO3 |
KI, K2SO4, AlCl3 |
NaCNS |
13 |
AlCl3 |
NaOH |
NaCl, Na2CO3, CuSO4 |
BaCl2 |
13
14 |
MnCl2 |
(NH4)2S |
Na2HPO4, LiNO3, Fe2(SO4)3 |
CaCl2 |
15 |
Hg2(NO3)2 |
KCl |
KCl, CH3COONa, Ca(NO3)2 |
BaCl2 |
16 |
Pb(NO3)2 |
H2SO4 |
KCl, K2SO4, Ca(NO3)2 |
Na2SO4 |
17 |
CuSO4 |
H2S |
KI, K2SO4, AlCl3 |
MgSO4 |
18 |
Na2SiO3 |
HCl |
NaCl, Na2CO3, CuSO4 |
FeCl3 |
19 |
Na3AsO4 |
AgNO3 |
Na2HPO4, LiNO3, Fe2(SO4)3 |
Na2S |
20 |
CoCl2 |
(NH4)2S |
KCl, CH3COONa, Ca(NO3)2 |
Ca(NO3)2 |
|
|
|
|
МЕТОДИЧНІ ВКАЗІВКИ |
|
|
|
|
||||
|
|
|
|
|
Задача 1 |
|
|
|
|
|
||
Дано: |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Таблиця 3 |
|
дослід |
Т, К |
|
|
|
Експериментальні кінетичні дані |
|
|
|
||||
1 |
300 |
, хв |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
2,000 |
1,147 |
0,887 |
0,750 |
0,661 |
0,598 |
0,550 |
0,512 |
0,481 |
|||
|
|
|||||||||||
2 |
310 |
, хв |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
2,000 |
0,832 |
0,616 |
0,511 |
0,446 |
0,401 |
0,367 |
0,341 |
0,319 |
|||
|
|
|||||||||||
3 |
320 |
, хв |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
с, моль/л |
2,000 |
0,573 |
0,414 |
0,340 |
0,296 |
0,265 |
0,242 |
0,225 |
0,210 |
|||
|
|
|||||||||||
Розв’язок: |
|
|
|
|
|
|
|
|
|
|
||
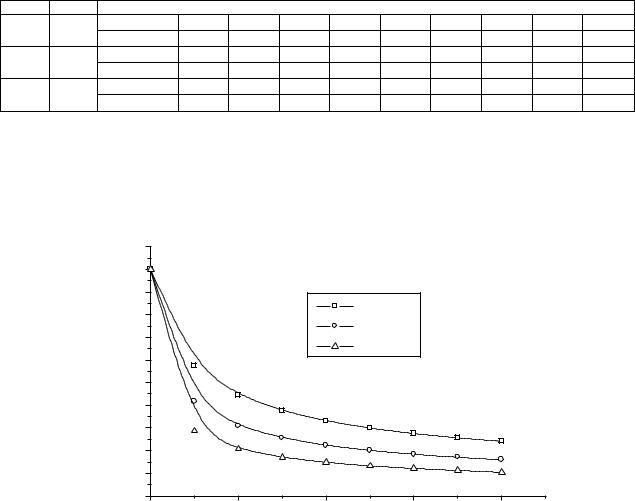
1. За даними (Табл. 3) будуємо графік залежності с=f(τ) рис.1. |
|
|
|
|
||||||||
|
|
2,2 |
|
|
|
|
|
|
|
|
|
|
|
|
2,0 |
|
|
|
|
|
|
|
|
|
|
|
|
1,8 |
|
|
|
|
|
|
|
|
|
|
|
|
1,6 |
|
|
|
T=300 K |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
1,4 |
|
|
|
T=310 K |
|
|
|
|
||
|
|
|
|
|
T=320 K |
|
|
|
|
|||
|
л |
|
|
|
|
|
|
|
|
|||
|
1,2 |
|
|
|
|
|
|
|
|
|
||
|
моль/ |
|
|
|
|
|
|
|
|
|
||
|
1,0 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
с, |
0,8 |
|
|
|
|
|
|
|
|
|
|
|
|
0,6 |
|
|
|
|
|
|
|
|
|
|
|
|
0,4 |
|
|
|
|
|
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
|
|
|
|
|
|
0,0 |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
20 |
40 |
|
60 |
|
80 |
|
|
|
|
|
|
|
|
|
, хв |
|
|
|
|
|
|
|
|
Рис. 1. Кінетичі криві при різних температурах |
|
|
|
|||||||
2. Для знаходження порядку реакції скористаємось двома методами: методом підстановки та |
||||||||||||
графічним. |
|
|
|
|
|
|
|
|
|
|
||
14
а) Метод підстановки.
Величини задані в умові підставляємо у кінетичні рівняння відповідного порядку:
кінетичне рівняння першого порядку |
k |
|
1 |
|
ln |
c |
|
|
|
||
|
|
|
|
|
|||||||
|
|
|
|
|
|
c |
|
|
|
||
|
|
1 |
|
|
|
1 |
|
||||
кінетичне рівняння другого порядку |
k |
|
|
1 |
|
|
|||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
c |
|
|
c |
|||||
(1)
(2)
|
|
|
|
|
|
|
1 |
|
1 |
|
1 |
|
|
|
|
|||
кінетичне рівняння третього порядку |
|
k |
|
|
|
|
|
(3) |
||||||||||
|
|
|
|
2 |
2 |
|
|
|||||||||||
|
2 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
c |
|
|
c |
|
|
|
|||||
Константи швидкості розраховуємо для температури 300 К і заносимо в таблицю 4 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблиця 4 |
|
Результати розрахунку констант швидкості при Т=300 К та константи k3 при 310 і 320К |
||||||||||||||||||
|
Т, К |
|
|
|
|
|
, хв. |
|
|
|
|
|
|
|
|
|||
|
|
10 |
20 |
|
30 |
|
40 |
|
|
|
|
|
50 |
|
60 |
70 |
80 |
|
k1, хв.-1 |
300 |
5,56·10-2 |
4,07·10-2 |
|
3,27·10-2 |
2,80·10-2 |
|
2,41·10-2 |
|
2,15·10-2 |
1,95·10-2 |
1,78·10-2 |
||||||
k2, хв.-1·моль-1·м3 |
300 |
3,72·10-2 |
3,14·10-2 |
|
2,78·10-2 |
2,53·10-2 |
|
2,34 10-2 |
|
2,20·10-2 |
2,08·10-2 |
1,97·10-2 |
||||||
k3, хв.-1·моль-2·м6 |
300 |
2,55·10-2 |
2,55·10-2 |
|
2,55·10-2 |
2,55·10-2 |
|
2,55 10-2 |
|
2,55 10-2 |
2,55·10-2 |
2,55·10-2 |
||||||
k3, хв.-1·моль-2·м6 |
310 |
5,97·10-2 |
5,96·10-2 |
|
5,97·10-2 |
5,97·10-2 |
|
5,97·10-2 |
|
5,98·10-2 |
5,9610-2 |
5,9910-2 |
||||||
k3, хв.-1·моль-2·м6 |
320 |
1,40·10-1 |
1,40·10-1 |
|
1,40·10-1 |
1,40·10-1 |
|
1,40·10-1 |
|
1,40·10-1 |
1,40·10-1 |
1,40·10-1 |
||||||
Як видно з приведених даних, лише константа реакції розрахована за рівнянням 3-го порядку є величиною постійною. Отже дана реакція є реакцією третього порядку.
Розраховуємо за рівнянням третього порядку константи швидкості при температурі 310 та 320 К і дописуємо в табл. 4.
Середнє значення констант: k3 (300) = 2,55·10-2 хв.-1·моль2·м-6 k3 (310) = 5,97·10-2 хв.-1·моль2·м-6 k3 (320) = 1,40·10-1 хв.-1·моль2·м-6
б) Графічний метод В цьому методі слід побудувати графіки залежності концентрації реагентів від часу в ко-
ординатах першого lnc=f(τ), другого 1/c = f(τ) та третього 1/c2=f (τ) порядків. За даними для Т=300 К розраховуємо величини для побудови графіків та заносимо в табл. 5.
Таблиця 4
Дані для побудови графіків
, хв. |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
lnc |
0,69 |
-0,56 |
-0,88 |
-1,08 |
-1,22 |
-1,33 |
-1,42 |
-1,49 |
-1,56 |
1/c, моль-1·м3 |
0,50 |
1,75 |
2,42 |
2,94 |
3,38 |
3,77 |
4,13 |
4,44 |
4,76 |
1/c2, моль-2·м6 |
0,25 |
3,05 |
5,83 |
8,65 |
11,41 |
14,24 |
17,08 |
19,75 |
22,68 |
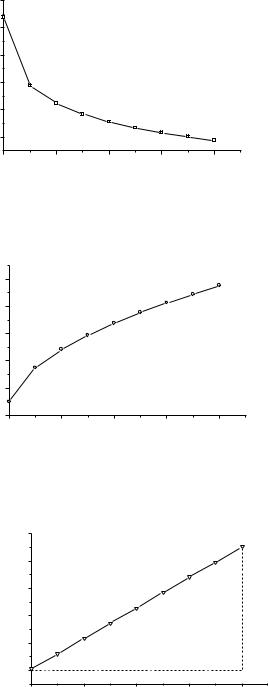
За отриманими даними будуємо графіки відповідних залежностей рис. 4-5.
15
|
1,0 |
|
|
|
|
|
0,5 |
|
|
|
|
|
0,0 |
|
|
|
|
lnc |
-0,5 |
|
|
|
|
|
-1,0 |
|
|
|
|
|
-1,5 |
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
|
|
|
|
,хв. |
|
Рис. 2. Кінетичні дані в координатах першого порядку
1/c, м3/моль-1
5
4
3
2
1
0
0 |
20 |
40 |
60 |
80 |
, хв
Рис.3. Кінетичні дані в координатах другого порядку
|
25 |
|
|
|
|
|
20 |
|
|
|
|
-2 |
15 |
|
|
|
|
/моль |
10 |
|
|
|
a |
6 |
|
|
|
||
, м |
|
|
|
|
|
2 |
|
|
|
|
|
1/c |
5 |
|
|
|
|
|
|
|
|
|
|
|
0 |
) |
b |
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
|
|
|
, хв |
|
|
Рис. 4. Кінетичні дані в координатах третього порядку
З приведених графіків видно, що лише в координатах третього порядку графічна залежність є прямою. Отже, дана реакція є реакцією третього порядку. Константу швидкості в даному випадку знаходимо за тангенсом кута нахилу прямої до осі абсцис:
k=0,5tgα
k = 0,5a/b = 0,5∙(22,68-0,25)/(80-0) =0,14 моль-2·м6
Розраховані двома методами константи швидкості однакові.
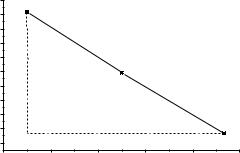
3. Розраховуємо дані для побудови графіка lnk=f(1/T) і заносимо в таблицю 5
|
|
|
|
16 |
|
|
|
|
Таблиця 4 |
|
Дані для графічного знаходження енергії активації |
|
||
|
|
|
|
|
k,хв.-1, моль-2·м6 |
T, К |
lnk |
|
1000/T, К-1 |
2,55·10-2 |
300 |
-3,669 |
|
3,333 |
5,97·10-2 |
310 |
-2,818 |
|
3,225 |
1,40·10-1 |
320 |
-1,966 |
|
3,125 |
За отриманими даними будуємо графік (рис. 5).
|
-1,8 |
|
|
|
|
|
|
-2,0 |
|
|
|
|
|
|
-2,2 |
|
|
|
|
|
|
-2,4 |
|
|
|
|
|
|
-2,6 |
|
|
|
|
|
lnk |
-2,8 |
|
|
|
|
|
-3,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-3,2 |
|
|
|
|
|
|
-3,4 |
|
|
|
|
|
|
-3,6 |
|
|
|
( |
|
|
-3,8 |
|
|
|
|
|
|
3,10 |
3,15 |
3,20 |
3,25 |
3,30 |
3,35 |
|
|
|
1/T*10-3, K-1 |
|
|
|
Рис. 5. Залежність логарифма константи швидкості від оберненої температури |
|
За тангенсом кута нахилу прямої знаходимо енергію активації даної реакції: |
|
E = -R·tgα |
(4) |
E = -8,314∙(-3,669+1,966)/(3,333-3,125) = 68,07 кДж/моль |
|
Передекспонеційний множник знайдемо з рівняння Ареніуса: |
|
k=ko·exp{-E/RT} |
(5) |
звідки |
|
kо =k·exp{E/RT} |
(6) |
kо (300) = 0,0255∙е68007/8,314*300 = 1,77·1010 |
|
kо (310) = 0,0597∙е68007/8,314*310 = 1,72 ·1010 kо (320) = 0,140∙е68007/8,314*320 = 1,77·1010
Середнє значення 1,75·1010 моль-2·м6 (розмірність така ж, як і в константи швидкості відповідного порядку).
Температурний коефіцієнт реакції Вант-Гоффа показує у скільки разів зростає швидкість реакції при підвищенні температури на 10 К:
|
|
|
|
|
|
|
wT 10 |
|
|
kT 10 |
(7) |
|
|
|
|
|
|
wT |
kT |
||||
|
|
|
|
|
|
|
|
|
|||
Підставляємо знайдені значення констант: |
|
|
|
||||||||
|
k310 |
|
0,0597 |
2,34 |
|
|
|
||||
k300 |
0,0255 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
|
k320 |
|
|
0,14 |
2,34 |
|
|
|
|||
|
0,0597 |
|
|
|
|||||||
|
|
k310 |
|
|
|
|
|
|
|
||
За правилом Вант-Гоффа при підвищенні температури на 10 К швидкість реакції зростає у 2 – 4 рази. В даному випадку швидкість зросла у 2,34 рази. Отже, дана реакція підпорядковується правилу Вант-Гоффа.
17
Задача 2
Дано:
|
|
|
Таблиця 5 |
|
|
|
|
A |
B |
C |
D |
|
|
|
|
FeSO4 |
NaOH |
NaCl, СН3СООК , Ca(NO3)2 |
ZnSO4 |
Розв’язок:
1. Рівняння реакції:
FeSO4 2NaOH Fe(OH)2 Na2 SO4 ;
Утворення колоїдного розчину при протіканні хімічної реакції можливо лише у тому випадку, коли хоча б один з продуктів реакції утворює нову фазу.
У даному випадку гідроксид заліза (II) нерозчинний у воді і утворить агрегати з m моле-
кул Fe(OH)2.
Поверхня цих новоутворених агрегатів має дуже велику надлишкову енергію і на ній з розчину будуть адсорбуватись іони добудовуючи кристалічну гратку. Цей процес підпорядковується правилу вибіркової адсорбції іонів Панета-Фаянса: на твердій поверхні переважно адсорбуються ті іони, що мають однакове з поверхнею атомне угрупування, або ізоморфні до поверхні. Іони, які добудовують кристалічну гратку носять назву «потенціалотвірні».
Агрегат разом з шаром «потенціалотвірних» іонів складають ядро міцели.
На поверхні ядра з розчину адсорбується іони протилежного до заряду ядра знаку, утворюючи адсорбційний шар «протиіонів». Ядро разом з адсорбційним шаром «протиіонів» складає заряджену частинку.
Інша частина «протиіонів» знаходиться у розчині поблизу частинки і складає дифузійний шар «протиіонів». Частинка з дифузійним шаром «протиіонів» і є міцелою.
Будова міцели залежить від того який з електролітів взятий у надлишку. Якщо у надлишку FeSO4 , то іони Fe2+ є «потенціалотвірними», а SO42– – «протиіонами»; якщо у надлишку NaOH, то іони OH– будуть «потенціалотвірними», а Na+ – «протиіонами».
а) будова міцели при надлишку речовини А (FeSO4): m[Fe(OH)2 ] – агрегат міцели
m[Fe(OH)2 ]nFe2 – ядро міцели
m[Fe(OH)2 ]nFe2 (n x)SO42 2 x – частинка міцели (зарядження позитивно)
m[Fe(OH)2 ]nFe2 (n x)SO42 2 x xSO42 – власне міцела;
b) будова міцели при надлишку речовини В (NaOH):
m[Fe(OH)2 ]nOH (n x)Na x xNa ;
частинка міцели зарядження негативно.
2.Для визначення кращого коагулятора керуємось правилом Шульце-Гарді:
-коагуляторами золю є протиіони – іони протилежного до заряду частинок знаку;
-більшу коагулюючу здатність (менший поріг коагуляції) мають іони більшого заряду;
-серед іонів однакової валентності більша коагулююча здатність у іонів з меншим радіусом гідратованого іона.
В даному випадку коагуляторами міцели а будуть аніони, оскільки мають заряд протилежний до заряду частинки. З наведених аніонів (Cl–, NO3– та CH3COO–), ацетат-аніон буде ма-
18
ти найбільшу коагулюючу здатність бо має менший радіус гідратованого іона. Економніший коагулятор СН3СООК.
Коагуляторами міцели b будуть катіони, оскільки мають заряд протилежний до заряду частинки. З наведених катіонів (Na+, K+ та Ca2+), іон кальцію буде мати найбільшу коагулюючу здатність бо має більший заряд. Економніший коагулятор Ca(NO3)2.
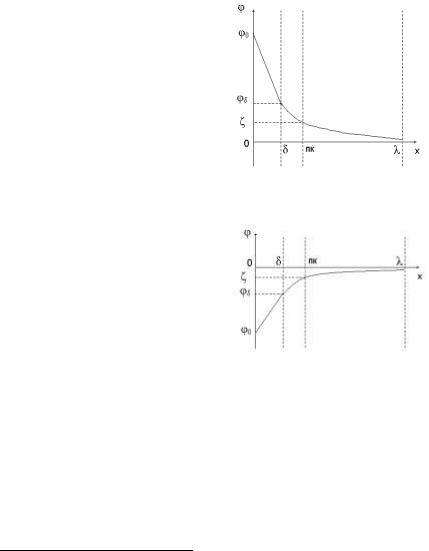
3. За теорією Штерна, ПЕШ колоїдної частинки складається з двох шарів: адсорбційного та дифузійного. Товщина адсорбційного шару (δ) приблизно рівна діаметру гідратованих іонів. Іони в адсорбційному шарі утримуються не лише електростатичними силами, а й силами специфічної адсорбції. Потенціал поверхні φо на відстані δ зменшується до потенціалу адсорбційного шару φδ за лінійним законом. Дифузійний шар ПЕШ має так звану «розмиту» будову. Його товщина (λ) залежить від іонної сили розчину та температури і може бути значною ( такою, що
на відстані λ потенціал φδ зменшується в е* разів). Концентрація іонів та потенціал частинки у дифузійному шарі зменшується з відстанню за експонентою.
Згідно з тією ж теорією, площина ковзання між частинками дисперсної фази та середовищем при їх відносному русі знаходиться в дифузійному шарі на певній відстані від поверхні. Саме до цієї поверхні «прив’язують» електрокінетичний потенціал.
З врахуванням знаку заряду «потенціалотвірних» іонів та «протиіонів» міцел А та В графіки залежності потенціалу від відстані в ПЕШ будуть наступні:
Рис. 6. Залежність потенціалу від відстані в ПЕШ для міцели а
Рис. 7. Залежність потенціалу від відстані в ПЕШ для міцели b
- товщина адсорбційного шару
- товщина дифузійного шару ПК - площина ковзання0 - потенціал поверхні
- потенціал адсорбційного шаруелектрокінетичний потенціал
1. Розглянемо як вплине додавання електроліту на будову міцел.
* е = 2,71828… – основа натурального логарифма
19
а) Електроліт D містить індиферентні до міцели а іони Zn2+ та SO42–. Їх додавання до розчину на будову міцели не вплине. Зростання іонної сили розчину приводить до стискання - шару та зменшення - потенціалу. Графік f (x) не зміниться.
b) По відношенню до міцели b електроліт D є неіндиферентним, бо містить іон Zn2+, який може реагувати з «потенціалотвірними» іонами OH– з утворенням нерозчинної сполуки Zn(OH)2. Утвориться нова міцела, будову якої можна представити наступною формулою:
m[Fe(OH)2 nZn(OH)2 ] kZn2 (k x)SO42 2 x xSO42 ;
Потенціал поверхні міцели змінить знак на протилежний. Залежність потенціалу від відстані в ПЕШ буде такою ж, як для міцели а (рис. 1).
ЛІТЕРАТУРА РЕКОМЕНДОВАНА ДО КУРСУ
1.Білий О.В. Фізична хімія. – Київ: ЦУГ, 2002. – 364 с.
2.Воюцкий С.С. Курс коллоидной химии. - М. Химия, 1975. - 545 с.
3.Гомонай В.І. Фізична та колоїдна хімія: Підручник. – Ужгород: ВАТ «Патент», 2006. – 496 с.
4.Дібрівний В.М., Сергеєв В.В., Ван-Чин-Сян Ю.Я. Курс колоїдної хімії (Поверхневі явища та дисперсні системи): Навчальній посібник. – Львів: «Інтелект Захід», 2008. – 160 с.
5.Каданер Л.І. Фізична і колоїдна хімія. - Київ: “Вища школа”. 1983, 2-е вид.-250 с.
6.Карапетьянц М.Х. Введение в теорию химических процессов: Учебное пособие для вузов. - М.: Высшая школа, 1981. -333 с.
7.Киреев В.А. Краткий курс физической химии. - М.: Высшая школа, 1991. - 456 с.
8.Кудряшов В.И., Каретников Г.С. Сборник примеров и задач по физической химии. М.: “ВШ”. 1991. - 527 с.
9.Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. - Львів: “Світ”, 1994.- 232 с.
10.Фридрихсберг Д.А. Курс коллоидной химии. - Л., «Химия», 1984.-368 с.
11.Фролов Ю.Г. Курс коллоидной химии. - М. Химия, 1982.- 400 с.
12.Яцимирський В.К. Фізична хімія: Підручник для студ. вищ. навч. закл. К.; Ірпінь: ВТФ
«Перун», 2007. – 512 с.: іл..
20
НАВЧАЛЬНЕ ВИДАННЯ
|
ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ |
|
(частина II) |
|
МЕТОДИЧНІ ВКАЗІВКИ ТА ЗАВДАННЯ |
|
ДО САМОСТІЙНОЇ РОБОТИ |
|
для студентів базового напрямку 1102 “Фармація” |
Укладачі |
Павловський Юрій Павлович |
|
Герасимчук Сергій Ігорович |
Редактор |
|
