
- •Глава 21. Теоретические представления химической кинетики
- •21.1. Элементарная теория активных столкновений для бимолекулярных реакций
- •21.2. Мономолекулярные реакции
- •21.3. Теория активированного комплекса (переходного состояния)
- •21.3.1. Поверхность потенциальной энергии
- •21.3.2. Основное уравнение теории активированного комплекса
- •21.3.3. Свободная энергия активации
- •21.3.4. Сравнение теорий активных столкновений и переходного состояния
- •21.4. Реакции в растворах
21.3.2. Основное уравнение теории активированного комплекса
При выводе основного уравнения предполагается, что протекание реакции не нарушает распределения молекул по состояниям и можно использовать статистически равновесное распределение Максвелла–Больцмана.
Рис. 21.6.Схема
движения частицы по поверхности
потенциальной
энергии
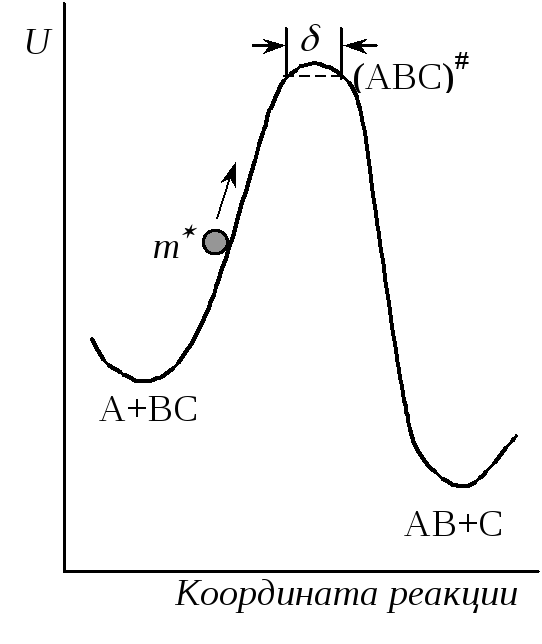
Предположение об адиабатности процесса позволяет прибегнуть к механической аналогии, представив ход реакции как движение некоторой частицы с эффективной массой m*по поверхности потенциальной энергии (рис. 21.6). Если частица обладает достаточной кинетической энергией, то она может достичь перевальной точки и затем скатиться с возрастающей скоростью на другую сторону барьера. Для реакции А + ВС это значит, что относительная кинетическая энергия при сближении частиц достаточна, чтобы преодолеть силы отталкивания и образовать активированный комплекс, который распадается на продукты реакции.
С этой точки зрения скорость протекания
элементарного процесса определяется
скоростью, с которой частица m*
пересекает вершину потенциального
барьера, которую можно выразить какой-то
средней величиной. Для упрощения расчетов
вершина перевала представляется в виде
плоского участка пути реакции длиною. Это соответствует
допущению, что переходное состояние
существует не в одной точке с фиксированными
координатамиr1иr2, а в некотором интервале этих расстояний.
Движение частицыm* на плоском участкеможно считать
одномерным, а ее средняя скорость![]() тогда будет равна скорости теплового
движения молекулы с массойm* вдоль
одной координаты:
тогда будет равна скорости теплового
движения молекулы с массойm* вдоль
одной координаты:
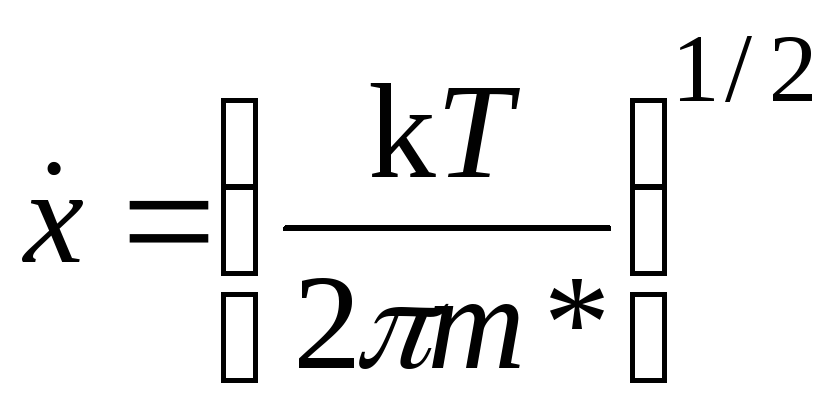 . (21.30)
. (21.30)
Средняя продолжительность жизни активированного комплекса равна тогда
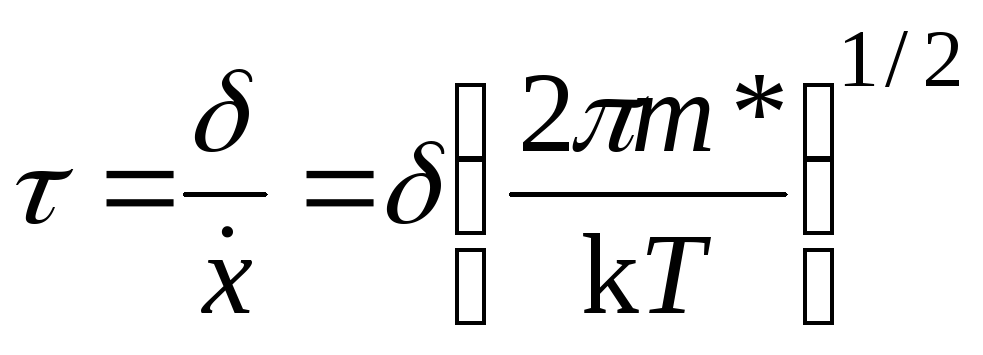 . (21.31)
. (21.31)
Концентрация активированных комплексов c#на интервалеравна числу возникающих активированных комплексов или числу элементарных актов реакции за время, а скорость реакции – числу элементарных актов за единицу времени:
 . (21.32)
. (21.32)
Согласно основному постулату химической кинетики скорость бимолекулярной реакции
А + В (АВ)#С + D
равна
![]() . (21.33)
. (21.33)
Сравнивая два последних уравнения, получим выражение для константы скорости реакции:
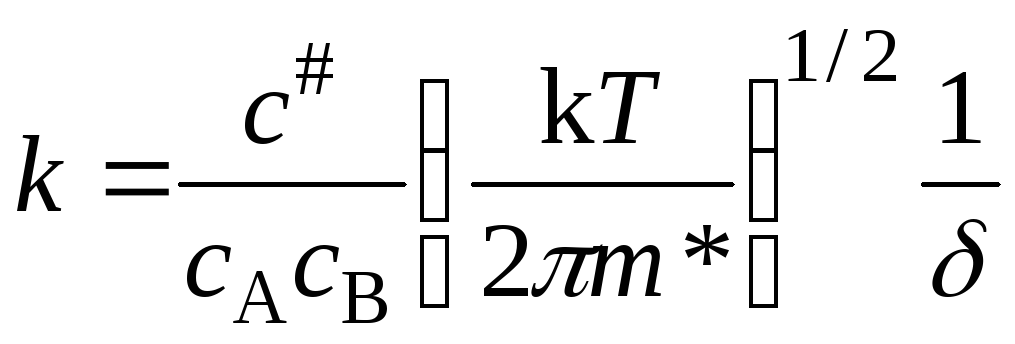 . (21.34)
. (21.34)
Согласно теории, к реагирующей системе применима статистика Максвелла – Больцмана, поэтому константа скорости элементарной реакции А + В С + D, протекающей в отсутствии равновесия, мало отличается от константы скорости, вычисленной в предположении существования химического равновесия как с конечными продуктами, так и с промежуточными активными комплексами. При этих условиях уравнение реакции можно представить в виде А + ВL(АВ)#С + D, а выражение (21.34) для константы скорости записать через концентрации, соответствующие равновесному состоянию:
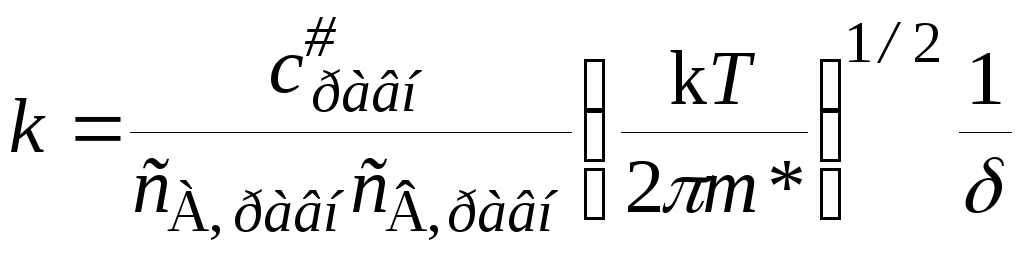 . (21.35)
. (21.35)
Отношение равновесных концентраций заменим константой равновесия
![]() . (21.36)
. (21.36)
Величина Kвычисляется методами статистической механики, которые дают возможность выразить константу равновесия через статистические суммы по состояниюQна единицу объема (см. гл. 14):
![]() (21.37)
(21.37)
где Eo– энергия активации при абсолютном нуле температуры.
Суммы по состояниям исходных веществ
QAиQBобычно
определяются на основании молекулярных
характеристик. Сумму по состояниям
активированного комплекса![]() разбивают на два сомножителя, один из
которых соответствует одномерному
поступательному движению частицыm*через вершину перевала. Статистическая
сумма поступательного движения в
трехмерном пространстве объемаVравна
разбивают на два сомножителя, один из
которых соответствует одномерному
поступательному движению частицыm*через вершину перевала. Статистическая
сумма поступательного движения в
трехмерном пространстве объемаVравна
![]() . (21.38)
. (21.38)
Для определения Qпостдля одной степени свободы надо извлечь из этого выражения кубический корень, причем в нашем случаеV3/2будет соответствовать пути реакции:
![]() , (21.39)
, (21.39)
и
![]() , (21.40)
, (21.40)
где Q#– сумма по состояниям активированного комплекса для всех остальных видов энергии, т.е. двух степеней свободы поступательного движения в обычном пространстве, электронной, колебательной, вращательной энергий.
Подставляя уравнение (21.40) в (21.37), получаем
![]() . (21.41)
. (21.41)
Введем обозначение
![]() . (21.42)
. (21.42)
K#можно условно назвать константой равновесия между исходными веществами и активированным комплексом, хотя в действительности такого равновесия нет. Тогда константа скорости
![]() . (21.43)
. (21.43)
Подставляя уравнение (21.43) в (21.34) с учетом выражений (21.36) и (21.35), получим основное уравнение теории активированного комплексадля константы скорости реакции:
![]() . (21.44)
. (21.44)
Это уравнение получено в предположении адиабатного протекания процесса. При неадиабатных процессах существует возможность “скатывания” частицы с вершины барьера в долину исходных веществ. Эта возможность учитывается введением трансмиссионного коэффициента(коэффициента прохождения)и в общем случае константа скорости определяется выражением:
![]() . (21.45)
. (21.45)
Очевидно, что равен или меньше единицы, но путей его теоретического расчета нет.
