
Pavlovich-_obschy_praktikum
.pdfС. А. Павлович К. Д. Пяткин
МЕДИЦИНСКАЯ
МИКРОБИОЛОГИЯ
ПРАКТИКУМ
МИНСК "Вышэйшая школа" 1993
ББК 52.64я73
П12 УДК 579.61 (075.8) Рецензенты: кафедра микробиологии Винницкого медицинского института (зав, кафедрой Г.К. Палий, д-р мед. наук), И.А. Сытник, д-р мед. наук (Тернопольский медицинский институт).
Павлович С.А., Пяткин К.Д.
П 12 Медицинская микробиология; Практикум. - Мн.: Выш, шк., 1993. - 200 с: ил. ISBN 5-339-00740-5.
Состоит из двух разделов — общеприкладной медицинской микробиологии и клинической микробиологии. В первом разделе изложены основные методы микробиологических исследований, способы специфической терапии и профилактики инфекционных болезней, во втором - методы их лабораторной диагностики.
Для студентов лечебного и стоматологического факультетов медицинских институтов.
БК 52.64я73 П 4*08040506 - 009 , 55-93 М304 (03) – 93 © С.А. Павлович, К. Л. Пяткин, 1993
ISBN 5-339-00740-5
ПРЕДИСЛОВИЕ
Предлагаемый практикум по микробиологии является как бы продолжением учебного пособия «Медицинская микробиология в графах» С.А. Павловича (1986) и учебника К.Д. Пяткина и Ю.С. Кривошеина (1980). Он дополняет их специальными методическими указаниями, которые помогают студентам овладеть техникой микробиологических исследований и выполнить лабораторные работы, включая самостоятельное приобретение практических навыков, необходимых врачу.
Практикум состоит из двух частей - общеприкладной и медицинской микробиологии. Все его темы построены по определенному плану в соответствии с программой по микробиологии и требованиями четырехтомного издания S. Bergey. Manual of systematic Bacteriology (1984-1990), в котором царство Procaryotae по структуре и химическому составу клеточной стенки подразделяется на четыре раздела: 1. Gracilicutes. 2. Firmicutes. 3. Tenericutes. 4. Mendosicutes. В практикуме устранено дублирование лабораторных работ, проводимых на кафедрах физики и гистологии (устройство микроскопов и техника микроскопирования), биологии (основы общей генетики, структура и функция генов), нормальной и патологической физиологии (группы крови и резус-фактор, парааллергия), инфекционных болезней и фармакологии (клиника и лечение, побочное действие химиопрепаратов и антибиотиков и др.).
Для лучшего усвоения предмета после каждой темы приведены основные теоретические и практические вопросы, а также задания для самостоятельной работы. С той же целью подробному описанию лабораторной диагностики отдельно взятой инфекционной болезни предшествует перечень экспресс-методов идентификации возбудителя, серологических реакций и аллергических тестов, позволяющих в сжатые сроки установить природу болезни.
Авторы выражают глубокую благодарность заведующему кафедры микробиологии Винницкого медицинского института доктору медицинских наук, профессору Г.К. Палию и заведующему кафедры микробиологии Тернопольского медицинского института доктору медицинских наук, профессору И.А. Сытнику за ценные замечания и предложения, учтенные при подготовке рукописи к издаданию.
Авторы также благодарят профессора Е.А. Капитанова и кандидатов медицинских наук П.С. Кульговеню, Л.В. Тышкевич и Брызгунову за помощь, оказанную при подготовке рукописи.
С.А. Павлович
2
РАЗДЕЛ ПЕРВЫЙ. ОБЩЕПРИКЛАДНАЯ МЕДИЦИНСКАЯ МИКРОБИОЛОГИЯ
УСТРОЙСТВО И ОСНАЩЕНИЕ МИКРОБИОЛОГИЧЕСКИХ ЛАБОРАТОРИЙ, ПРАВИЛА РАБОТЫ В НИХ
Различают бактериологические, вирусологические, иммунологические и специальные лаборатории, предназначенные для диагностики карантинных инфекций. В каждой из них имеются: 1) препараторская для подготовки лабораторной посуды, приготовлена питательных сред и проведения других вспомогательных работ 2) автоклавная; 3) целый ряд боксированных комнат с бактерицидными лампами для взятия материала и проведения микробиологических исследований; 4) вивариум для содержания подопытных животных. Лаборатория оборудуется приточно-вытяжной вентиляцией и противопожарными устройствами.
Помещения лабораторий должны быть удобны для влажной убороки и дезинфекции, в частности панели окрашиваются светло; масляной краской, полы покрываются линолеумом, а столы специальной эмалью.
Основным оборудованием (бактериологических лабораторий являются микроскопы для оптической и другой микроскопии, термостаты, холодильники, аппараты для стерилизации (автоклав, cyхожаровой шкаф), центрифуга, дистилляционный aппарат.
В вирусологических лабораториях создаются боксы с предбоксниками, разделенные стеклянной перегородкой. Кроме обычного оборудования, они оснащаются гомогенизатором, измельчающим ткани, магнитной мешалкой, центрифугой с охлаждением для очистки и концентрации вирусов, холодильником для хранения вирусов при температуре -20 - 70°С, аппаратом для вакуумного высушивания вирусов.
Иммунологические лаборатории оснащаются посудой и приборами, необходимыми для проведения серологических и аллергических реакций.
Персонал микробиологических лабораторий обеспечивается халатами, косынками и шапочками, марлевыми масками, клеенчатыми передниками, нарукавниками, резиновыми перчатками, противочумными костюмами для индивидуальной защиты. В процессе микробиологических исследований должен соблюдаться строгий санитарнопротивоэпидемический режим, исключающий внутрилабораторное заражение работающих. При случайном попадании исследуемого материала или культуры микроорганизмов на руки, стол, халат или обувь необходимо немедленно провести их дезинфекцию.
После окончания работы питательные среды с посевами ставят в термостат, музейные культуры - в сейфы-холодильники. Столы протирают дезинфицирующим раствором и тщательно моют руки.
После вскрытия трупов животных инструменты и шприцы кипятят в течение 40 мин в лизоле. Все отработанные материалы и трупы сжигают или автоклавируют.
Контрольные вопросы
1. Типы лабораторий. 2. Оснащение лабораторий. 3. Обеспечение персонала лабораторий. 4. Режим работы микробиологической лаборатории.
Задания для самостоятельной работы
Знакомство с помещениями кафедры микробиологии (бактериологическая и вирусологическая лаборатории, препараторская, автоклавная, моечная и др.), с правилами охраны труда и техники безопасности персонала.
3
МИКРОСКОПЫ И МЕТОДЫ МИКРОСКОПИИ
Микробиологические лаборатории при изучении микроорганизмов используют методы оптической и электронной микроскопии.
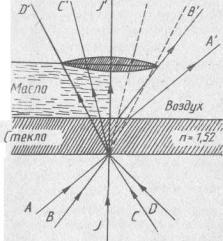
Микроскопия в проходящем свете. Проводится главным образом при помощи иммерсионных или погружных объективов, имеющих по сравнению с сухими небольшое фокусное расстояние и высокую разрешающую способность (около 0,2 мкм). При иммерсионной микроскопии объектив погружается в кедровое, персиковое, вазелиновое масло, показатель преломления которых близок к показателю преломления стекла (1,52). В таком случае пучок света, вышедший за пределы предметного стекла, не рассеивается и лучи, не меняя направления, попадают в объектив (рис. 1).
При использовании иммерсионного объектива вначале центрируют оптическую часть микроскопа. Если тубус микроскопа раздвижной, его устанавливают на длину 160 мм, затем поднимают конденсор до уровня предметного столика, открывают диафрагму, устанавливают объектив х8 и при помощи плоского зеркала освещают поле зрения. На предметное стекло с окрашенным препаратом наносят каплю масла, в которую под контролем глаза осторожно погружают объектив. Затем, поднимая тубус, смотрят в окуляр и вначале макро-, а потом микровинтом устанавливают четкое, изображение объекта. По окончании работы поднимают тубус, снимают препарат, салфеткой удаляют масло с фронтальной линзы объектива, отводят его в сторону и опускают к предметному столику.
Рис. 1. Ход лучей (обозначен буквами) при прохождении через иммерсионное масло и воздух.
Микроскопия в темном поле зрения. Проводят при боковом освещении и обычно применяют с целью изучить подвижность бактерий или обнаружить патогенные спирохеты, поперечник которых может быть на порядок меньше 0,2 мкм. Чтобы получить яркое боковое освещение, обычный конденсор заменяют специальным параболоидом-конденсором, в котором центральная часть нижней линзы затемнена, а боковая поверхность зеркальная. Этот конденсор задерживает центральную часть параллельного пучка лучей, образуя темное поле зрения. Краевые лучи проходят через кольцевую щель, попадают на боковую зеркальную поверхность конденсора, отражаются от нее и концентрируются в его фокусе. Если на пути луча нет какихлибо частиц, он преломляется, падает на боковую зеркальную поверхность, отражается от нее и выходит из конденсора. Если луч встречает на своем пути микробы, то свет отражается от них и попадает в объектив - клетки ярко светятся.
Источником искусственного света служит осветитель ОИ-7 или лампа 100 - 150 Вт в металлическом футляре. Для бокового освещения необходим параллельный пучок света, поэтому применяется только плоское зеркало микроскопа.
Обычно исследование в темном поле зрения проводится под сухой системой (объектив х 40), При этом небольшую каплю материала помещают на предметное стекло и накрывают покровным, не допуская образования пузырьков воздуха. На верхнюю линзу конденсора наносят иммерсионное масло, которое должно заполнить пространство между ним и предметным стеклом. При микроскопии иммерсионной системой используют специальный объектив с диафрагмой, который задерживает лучи, беспрепятственно проходящие через гомогенную среду.
4
Фазово-контрастная и аноптральная микроскопии. Основаны на том, что оптическая длина пути света в любом веществе зависит от показателя преломления. Это свойство используют в целях увеличения контрастности изображения прозрачных объектов, какими являются микробы, т.е. для изучения деталей их внутреннего строения. Световые волны, проходя через оптически более плотные участки объекта, отстают по фазе от световых волн, не проходящих через них. При этом интенсивность света не меняется, а только изменяется фаза колебания, не улавливаемая глазом и фотопластинкой. Для повышения контрастности изображения фазовые колебания при помощи специальной оптической системы превращаются в амплитудные, хорошо воспринимаемые глазом. Препараты в световом поле зрения становятся более контрастными - положительный контраст; при отрицательном фазовом контрасте на темном фоне виден светлый объект. Вокруг изображения нередко возникает ореол.
Более четкое изображение малоконтрастных живых микробов (вирусов) достигается при помощи аноптрального микроскопа. Одной из важных деталей этого микроскопа является линза объектива, расположенная вблизи "выходного" зрачка. На линзу объектива нанесен слой копоти или меди, поглощающей не менее 10 % света, в результате чего фон поля зрения становится коричневым, а микроскопируемые объекты приобретают различные оттенки - от белого до золотисто-коричневого.
Люминесцентная (флюоресцентная) микроскопия. Основана на способности некоторых клеток и красителей светиться при попадании на них ультрафиолетовых и других, коротковолновых лучей света.
Люминесцентные микроскопы представляют собой обычные, световые микроскопы, снабженные ярким источником света и набором светофильтров, которые выделяют коротковолновую часть спектра, возбуждающую люминесценцию. Между зеркалом микроскопа и источником света устанавливается сине-фиолетовый светофильтр (УФС-3, ФС-1 и пр.). На окуляр надевают желтый светофильтр (ЖС-3 или ЖС-18).
Различают собственную (первичную) и наведенную (вторичную) флюоресценцию. Поскольку большая часть микробов не обладает собственной флюоресценцией, они обрабатываются красителями, способными флюоресцировать (вторичная люминесценция). В качестве флюорохромов используют аурамин (для обработки микобакотерий туберкулеза), акридин желтый (гонококки), корифосфин (коринебактерии дифтерии), флюоресцеинизотиоцианат (для мечения антител).
Мазок для люминесцентной микроскопии готовят обычным способом, фиксируя в ацетоне 5-10 мин, и наносят на него флюорохром на 20 - 30 мин. Готовый препарат 15-20 мин промывают проточной водой, покрывают покровным стеклом и микроскопируют.
Люминесцентная микроскопия имеет ряд преимуществ: дает цветное изображение и значительную контрастность; позволяет обнаружить живые и погибшие микроорганизмы, прозрачные и непрозрачные объекты, а также установить локализацию бактерий, вирусов и их антигенов в пораженных клетках организма.
Электронная микроскопия. Широко применяется в микробиологии и вирусологии для изучения деталей строения бактерий и вирусов. В электронном микроскопе вместо света используется поток электронов в безвоздушной среде, на пути которых находится анод. Источником электронов является электронная пушка (вольфрамовая нить, разогреваемая до 2500 - 2900°С). Оптические линзы заменены электромагнитами. Между вольфрамовой нитью и анодом возникает электрическое поле в 30 000 - 50 000 В, что сообщает электронам большую скорость и они, проходя через отверстие анода, попадают в первую электромагнитную линзу (конденсор). Электронныелучи на выходе из конденсора собираются в плоскости исследуемого объекта. Они отклоняются под разными углами засчет различной толщины и плотности препарата и попадают в объективную электромагнитную линзу, снабженную диафрагмой. Электроны, отклонившиеся под небольшим углом при встрече с объектом, проходят через диафрагму; электроны, отклонившиеся под большим углом, задерживаются, в результате чего обеспечивается контрастность изображения. Линза объектива дает промежуточное увеличенное изображение, которое наблюдается через смотровое окно. Проекционная линза может
5
увеличивать изображение во много раз. Это изображение принимается на флюоресцирующий экран и фотографируется. Разрешающая способность электронных микроскопов 1,00-0,14 нм.
Приготовление препаратов. В электронном микроскопе вместо предметных стекол применяют очень тонкие пленки-подложки, незначительно поглощающие электроны. Пленки крепятся на опорные сетки. Материалом для приготовления пленок служат коллодий, оксид алюминия и кварц. Исследуемый материал, тщательно очищенный от различных примесей, наносят на пленку, на которой после испарения жидкости остается тончайший слой. Высушенный препарат устанавливают для микроскопирования.
Микроскопированию также могут быть подвергнуты срезы тканей, клеток, микроорганизмов, полученные с помощью ультрамикротома. Контрастирование препаратов осуществляют с помощью электроноплотных (задерживающих электроны) веществ: напыление тяжелыми металлами, обработка препаратов фосфорно-вольфамовой кислотой, уранилацетатом, солями осмиевой кислоты др.
Контрольные вопросы
1. Методика микроскопии с использованием иммерсионной системы. 2. Микроскопирование в темном поле и его практическое использование. 3. Фазово-контрастная микроскопия и ее назначение. 4. Люминесцентный метод микроскопии и его феимущества. 5. Электронный микроскоп, его разрешающая способность. 6. Объекты, изучаемые в электронном микроскопе, и принципы приготовления препаратов.
Задания для самостоятельной работы
1.Освоение методики микроскопии окрашенных препаратов иммерсионным объективом.
2.Демонстрация методов фазово-контрастной и люминесцентной миксроскопии.
3.Демонстрация электронного микроскопа.
МЕТОДИКА ПРИГОТОВЛЕНИЯ МАЗКОВ-ПРЕПАРАТОВ ИЗ МАТЕРИАЛА (КУЛЬТУР) И СПОСОБЫ ИХ ОКРАШИВАНИЯ
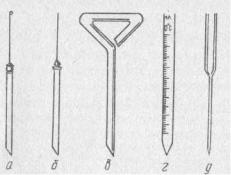
Мазки-препараты готовят из патологического материала (например, из гноя, мокроты, фекалий), колоний бактерий и грибков, выросших на пластинчатой среде в чашках Петри, или из культур этих и других микробов. Делают мазки на предметных стеклах, как правило, бактериальной петлей (диаметр 3x2 мм) из нихромовой проволоки, конец которой укрепляют зажимом в специальном петле-держателе или впаивают в стеклянную палочку (рис. 2). Кроме того, для изготовления мазков необходимы газовая горелка или спиртовка, ванночка с подставкой (мостик) для стекол, промывалка с водой, флакон с физиологическим раствором, красители, фильтровальная бумага, банка с дезинфицирующим раствором для обезвреживания отработанных препаратов, пипеток, материалов и рабочего стола.
Этапы приготовления мазка. 1. Подготовив исследуемые материалы и культуры микробов, в пламени горелки обжигают бактериальную петлю. При взятии чистой культуры из пробирок и колб стерилизуют также верхнюю часть петледержателя, которую вводят в горлышко пробирки или колбы. При этом пробирку с культурой берут большим и указательными пальцами левой руки, а бактериальную петлю держат правой, как писчую ручку. Пробку из ваты зажимают мизинцем правой руки и
Рис. 2. Бактериальная петля (а), бактериальная игла (б), микробиологический шпатель (в), градуированная пипетка (г), пастеровская пипетка (д)
6
извлекают ее из пробирки. Края горлышка пробирки стерилизуют в пламени горелки и почти одновременно обжигают петлю, которую быстро вводят внутрь пробирки, охлаждают и прикасаются к налету на скошенном пительном агаре или же погружают ее в бульонную культуру. Затем петлю извлекают, быстро обжигают край пробирки, закрывают пробкой, проведенной через пламя, и ставят в штатив.
2.Налет чистой культуры микробов или колонию эмульгируют в капле воды на предметном стекле и круговыми движениями петли равномерно распределяют на площади диаметром 1,0 - 1,5 см. Точно так же готовят мазок из бульонной культуры, гноя, мокроты других материалов, которые, естественно, не взвешиваются в воде. Хорошо приготовленные тонкие мазки имеют округлую форму и размер 10-15-копеечной монеты (крышки спиртовки), быстро высыхают при комнатной температуре, более толстые высушивают в термостате или при подогревании над пламенем горелки, не допуская свертывания белка бактерий и нарушения их структуры.
3.Высушенные мазки фиксируют 5 - 6 с в пламени спиртовки для того, чтобы убить микробов, которые в таком состоянии лучше воспринимают красители, закрепить их на предметном стекле предотвратить смыв.
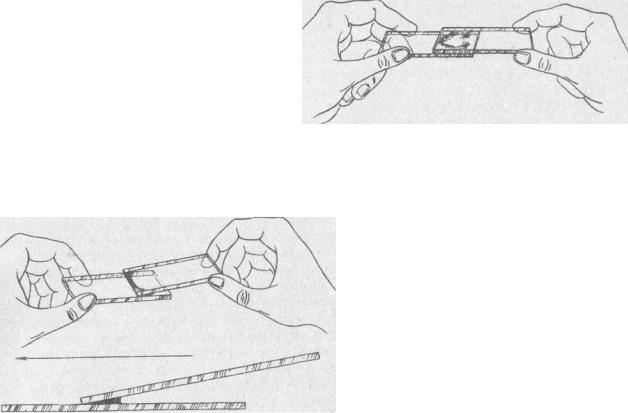
Для приготовления мазков из гноя и мокроты, вязких консистенций пользуются двумя предметными стеклами. На середину одного из них стерильной петлей наносят небольшое количество материала, который покрывают вторым стеклом так, чтобы оставалась свободной треть первого и второго стекол. Раздвигая стекла в стороны (рис. 3), получают два больших мазка одинаковой толщины.
Рис. 3. Приготовление мазка из гноя и мокроты
Мазки из крови готовят следующим образом. Стерильной иглой для инъекций делают укол на
предварительно продезинфицированном безымянном пальце левой руки. Первую каплю крови удаляют ватой, а вторую наносят на край хорошо обезжиренного предметного стекла. Мазки делают узким шлифованным стеклом, установленным под углом в 45° (рис. 4), продвигая его вдоль предметного стекла влево, не доходя до края (мазок имеет желтоватый цвет и
просвечивается).
Рис. 4. Техника приготовления мазка из крови (стрелка показывает направление движения шлифованного стекла)
Препараты-отпечатки из внутренних органов трупов, мяса,
колбасных изделий получают, прикасаясь предметным стеклом к поверхности разрезов, выполненных стерильным скальпелем.
Сделанные таким образом препараты из гноя, мокроты, крови, поверхности органов, которые легко деформируются при высокой температуре, обрабатывают фиксаторами:
метиловым спиртом -5 мин; этиловым спиртом - 10 - 15 мин; смесью Никифорова (равные объемы этилового спирта и эфира) - 10 - 15 мин; ацетоном - 5 мин; парами осмиевой кислоты и формалина -10 - 20 с.
4. Окрашивают фиксированные мазки кислыми, щелочными и нейтральными анилиновыми красителями: первые содержат группы SO3H, COOH; вторые - аминогруппы; третьи не имеют кислотных радикалов и щелочных групп. Наиболее широкое применение нашли следующие красители: красные (основной и кислый фуксины); синие (метиленовый и
7
толуидиновый синие); фиолетовые (генцианновый и метиловый фиолетовые); желтокоричневые (везувин и хризоидин).
При простом способе окраски мазка, когда используется один краситель, чаще других применяется водный фуксин Пфейффера окрашивание которым длится 1-2 мин и метиленовый синий Леффлера (3-5 мин). После окрашивания краситель сливают, препарат промывают водой и высушивают между листками фильтровальной бумаги. На сухой мазок наносят каплю масла и микроскопируют с использованием иммерсионного объектива оптического микроскопа.
Способность мазка воспринимать красители называется тинкториалъными
свойствами.
Прижизненную окраску бактерий осуществляют метиленовым синим, нейтральным красным и другими малоядовитыми красителями в разведении 1:10 000. На предметном стекле смешивают каплю исследуемого материала с раствором красителя, накрывают покровным стеклом. Микроскопируют объективом х 40.
Приготовление растворов фуксина и метиленового синего.
Феноловый фуксий Циля: основной фуксин - 1 г; спирт 96 % - 10 мл; фенол кристаллический - 5 г; глицерин - несколько капель, вода дистиллированная - 100 мл. Фуксин с кристаллами фенола и несколькими каплями глицерина растирают в ступке до гомогенной массы, добавляя малыми порциями спирт. Затем, не прекращая помешивания, постепенно доливают дистиллированную воду. Через 48 ч выдерживания при комнатной температуре раствор фильтруют и сохраняют.
Если необходимо, из него готовят водный фуксин Пфейффера, добавляя к 1 мл 9 мл дистиллированной воды.
Насыщенный спиртовой раствор метиленового синего: метиленовый синий - 10 г;
спирт 96 % - 100 мл. Прибавив к 30 мл этого раствора 1 мл 1 % натрия гидроксида или калия гидроксида и 100 мл дистиллированной воды, получают щелочной раствор метиленового синего Леффлера, а при разбавлении насыщенного раствора только дистиллированной водой в соотношении 1:10- водно-спиртовой раствор.
Контрольные вопросы
Этапы приготовления мазков из культур бактерий, выращенных на жидкой и плотной питательных средах. 2. Приготовление мазков из крови и препаратов-отпечатков. 3. Какие красители используются в микробиологической практике? 4. Техника простого метода окраски препараторов водным фуксином Пфейффера и метиленовым синим Леффлера. 5. Что подразумевают под термином "тинкториальные свойства"? 6. В каких целях используется прижизненная окраска микроорганизмов?
Задания для самостоятельной работы
1. Демонстрация основных форм бактерий: кокки, палочковидные бактерии и бациллы, вибрионы, спириллы, спирохеты. 2. Приготовление препаратов-мазков из культуры стафилококка, окраска водно-спиртовым раствором метиленового синего. 3. Приготовление мазков из культуры кишечной палочки, окраска фуксином Пфейффера. 4. Просмотр препаратов-мазков с прижизненной окраской бактерий.
СПЕЦИАЛЬНЫЕ МЕТОДЫ ОКРАСКИ
При сложных методах окраски применяют два-три контрастных по цвету красителя, что позволяет дифференцировать микробы и выявить некоторые особенности их строения. К таким методам относят окраску по Граму, Цилю-Нельсену, Нейссеру, Романовскому-Гимзе.
Метод Грама (1884год). Из-за неодинакового содержания пептидогликана (ПГ) в оболочках разных прокариот метод дает возможность подразделять их на грамположительные (фиолетовые, 90 % ПГ) и грамотрицательные (розовые, 5-20 % ПГ).
В соответствии с этим, во-первых, в царстве прокариот выделяют четыре раздела
(Bergey S. Manual of systematic Bacteriology, 1984): 1.Graciiieutes (тонкостенные,
8
грамотрицательные). 2. Firmicutes (толстостенные, грамположительные). 3. Tenericutes (лишенные стенок). 4. Mendosicutes (дефектные стенки, отсутствие пептидогликана).
Во-вторых, окраска по Граму позволяет также установить родовую и видовую принадлежность многих возбудителей инфекционных болезней. Например, известно, что все болезнетворные кокки (кроме гонококка и менингококка), бациллы и клостридии являются грамположительными, а энтеробактерии, вибрионы, трепонемы - грамотрицательными.
Для окраски по Граму необходимо подготовить:
1)феноловый раствор генцианового фиолетового: генцианвиолет - 1 г; спирт 96% - 10
мл; фенол кристаллический - 2 г; вода дистиллированная-100 мл;
2)раствор Люголя (калия иодид – 2 г; иод кристаллический - 1 г, вода дистиллированная - 300 мл. Вначале готовят концентрированный раствор калия иодида, в нем растворяют иод, затем прибавляют дистиллированную воду;
3)спирт 96 %;
4)фуксин Пфейффера.
Техника окраски. 1. Фиксированный мазок 1-2 мин окрашивают раствором гешщанвиолета, а по методу Синева его покрывают пропитанной тем же красителем полоской фильтровальной бумаги, на которую наносят 2-3 капли воды. 2. Слив генцианвиолет (сняв полоску бумаги), мазок 1 мин обрабатывают раствором Люголя и, не промывая водой, сливают его. 3.Обесцвечивают спиртом в течение 0,5 мин, промывают водой. 4.Окрашивают 1-2 мин фуксином Пфейффера, краситель смывают водой. 5.Препарат высушивают фильтровальной бумагой и микроскопируют иммерсионной системой.
Окраска по Цилю—Нельсену. Применяется для выявления кислото- и спиртоустойчивых микобактерий туберкулеза, лепры и некоторых актиномицетов, которые изза большого количества в клеточных оболочках липидов, воска и оксикислот непроницаемы для разведенных растворов красителей. Окрашивание их достигается при помощи фенолового фуксина Циля с подогреванием над пламенем горелки до закипания и отхождения паров.
Окрашенные с применением термокислотной обработки кислотоустойчивые бактерии не обесцвечиваются слабыми растворами минеральных кислот и спирта.
Техника окраски. 1. Фиксированный мазок покрывают полоской фильтровальной бумаги, на которую наносят фуксин Циля, и несколько раз подогревают над пламенем горелки до появления паров, подливая краситель. Далее бумагу снимают и препарат промывают водой. Препарат обрабатывают (обесцвечивают) 5% раствором серной кислоты и промывают водой.
На мазок наливают водно-спиртовой раствор метиленовогоинего, спустя 3-5 мин промывают водой и высушивают.
Кислоустойчивые бактерии окрашиваются в интенсивно красный цвет, остальные виды микробов, обесцвечивающиеся в процессе обработки препарата кислотой, - в светло-синий цвет.
Окраска по Романовскому-Гимзе. Осуществляется сложным красителем (в его состав входят метиленовый синий, эозин и азур), в результате он окрашивает бактерии (спирохеты), простейшие и форменные элементы крови в различные цвета и оттенки. Так, под его воздействием цитоплазма простейших приобретает голубой цвет, а ядра - красный; боррелии окрашиваются в сине-фиолетовый цвет, а трепонемы и лептоспиры - в слабо-розовый; эритроциты - в розовый цвет, ядра лейкоцитов - в фиолетовый, а их цитоплазма - в голубой (базофильная зернистость - в синий, эозинофильная - в красный, нейтрофильная - в сиреневый).
Техника окраски. Обработанные в жидком фиксаторе предметные стекла с мазками укладывают на два стеклянных валика в чашках Петри вниз к донышку и в щель сбоку подливают разведенный в 10 - 20 раз свежеприготовленный краситель, который в этой
9
замкнутой камере долго не высыхает. Окрашивание длится от 60 мин до нескольких часов, после чего мазки промывают водой высушивают на воздухе.
Метод серебрения по Морозову. Применяется для выявления спирохет и вирусных включений.
Для окраски препарата по Морозову необходимы три раствора: №1- 1 мл ледяной уксусной кислоты, 2 мл 40 % формалина, 100 мл стиллированнойводы; №2 - 5 г танина, 1 мл жидкого фенола, ) мл дистиллированной воды; № 3 - свежеприготовленный 5 % раствор нитрата серебра (азотнокислое серебро), к которому добавлено несколько капель аммиака до легкой опалесценции.
Техника окраски. Высушенный на воздухе мазок фиксируют створом № 1 в течение 1 мин, промывают водой, затем на препарат ливают раствор № 2 (протравливание), подогревают его до появления паров и тщательно промывают водой. Окраску серебрением осуществляют раствором № 3 при подогревании до появления темнокоричневого цвета. Препарат промывают водой, высушивают.
Контрольные вопросы
1. Специальные методы окраски микроорганизмов. 2. Техника окраски по Граму. 3. Какие разделы прокариот, роды и виды бактерий окрашиваются грамположи:ьно, а какие грамотрицательно? 4. Метод и техника окраски по Цилю—Нельсену, для идентификации каких бактерий он применяется? 5. Техника окраски по Романовскому—Гимзе. Цели использования. 6. Техника окраски по Морозову. Цели использования.
Задания дня самостоятельной работы
1. Приготовление мазков из смеси культур стафилококка и кишечной палочки. Окраска по Граму. 2. Окраска готовых мазков из мокроты больного туберкулезом по Цилю - Нельсену.
3. Микроскопия мазков с микобактериями лепры (демонстраций). 4.Микроскопия трепонем, окрашенных по Романовскому-Гимзе и серебрением по Морозову.
СТРУКТУРА И МОРФОЛОГИЯ МИКРООРГАНИЗМОВ
В целях определения видовой принадлежности микробов изучают не только их форму, но и отдельные элементы структуры.
Строение и методы окраски бактериальной клетки
Бактерии имеют низкую степень дифференциации и состоят из нуклеоида, цитоплазмы, клеточной стенки, цитоплазматической мембраны. Некоторые из них имеют жгутики, капсулы и эндоспоры.
Нуклеоид. Содержит дезоксирибонуклеиновую кислоту (НК), локализован в центральной части клетки. Нуклеоид на разных этапах развития бактерий может находиться в виде нитей, тяжей, узловатой тонкой сети или грубых скоплений. Бактерии, как правило, гаплоидны, содержат один нуклеоид, имеющий форму кольца с линейным расположением в ней генов (в логарифмической стадии размножения могут быть 2, 4, 8 и более нуклеидов).
Для обнаружения нуклеоида бактерий используют микрохимическую реакцию Робиноу и Фельгена с применением слабого кислотного гидролиза. При этом освобождающаяся дезоксирибоза переходит в альдегиды, вступающие в реакцию с бесцветной фуксинсернистой кислотой специального реактива Шиффа. Нуклеоид окрашивается в красно-фиолетовый цвет. Он также выявляется npи электронно-микроскопических исследованиях ультратонких срезов бактерий.
Цитоплазма. Представляет собой дисперсную смесь коллоидов состоящую из воды, белков, углеводов, липидов, минеральных соединений. В ней находятся рибосомы, экстрахромосомные ДНК структуры, или плазмиды, включения гликогена, гранулезы, капелек жира, кристаллов оксалатов, жидкой серы, скоплений пигмента.
10
