
Лагун, Жаворонок (2012)_Молек.выявл.антибиотикорезистентности
.pdf
Лагун Л.В.1, Жаворонок СВ.2 1 Гомельский государственный медицинский университет, Гомель, Беларусь
белорусская медицинская академия последипломного образования, Минск, Беларусь
Молекулярнотенетическая технология выявления резистентности энтеробактерий кбета-лактамным антибиотикам на основе геноиндикации бета-лактамаз расширенного спектра1
УДК 579.25:616.61 -002.3]:575
Поступила в редакцию 26.03.2012 г.
Контакты:
e-mail: llagun@mail.ru
Резюме
В статье представлена информация о геноиндикации р-лактамаз расширенного спектра различных классов у возбудителей с использованием полимеразной цепной реакции (ПЦР). Бета-лактамазная активность расширенного спектра у клинических изолятов энтеробакте рий - возбудителей пиелонефритов - опосредована наличием генов CTX-M.
Наличие генов бета-лактамаз других типов (ТЕМ, SHV), как правило, не связано с расшире нием бета-лактамазной активности.
Ключевыеслова:(3-лактамазырасширенногоспектра,геноиндикация, возбудители пиело нефритов.
1Работа выполнена при поддержке Белорусского республиканского фонда фундаментальных исследова ний в рамках гранта БРФФИ Б08М-128.
74
Оригинальные исследования / Молекулярная генетика Ш
• ВВЕДЕНИЕ
Энтеробактерии, главным образом Escherichia coli, а также Proteus |
Неблагоприятное |
mirabilis и Klepsiella pneumoniae, рассматриваются как возбудители |
течение заболевания |
ряда заболеваний внутренних органов, в том числе пиелонефрита, ши- |
обычно связывается |
роко распространенного среди взрослых и детей, характеризующегося |
с недостаточной |
большой длительностью течения, значительной потерей трудоспособ- |
антибактериальной |
ности и возможным неблагоприятным исходом [1-7]. |
эффективностью |
В последнее время резистентность энтеробактерии к ряду антибио- |
используемых |
тиков, особенно р-лактамным, приобретает все большее распростра- |
в ходе его лечения |
нение. Продукция (3-лактамаз расширенного спектра (БЛРС) - один из |
препаратов. |
наиболее распространенных и клинически значимых механизмов ре |
|
зистентности энтеробактерии к современным р-лактамным антибио |
|
тикам. |
|
Термин «р-лактамазы расширенного спектра» (от англ. extended- |
|
spectrum p-lactamases - ESBL) объединяет большое число бактери |
|
альных ферментов, которые отличаются способностью расщеплять |
|
оксиимино-р-лактамы (цефалоспорины III-IV поколений и азтреонам), |
|
наряду с пенициллинами и ранними цефалоспоринами, и проявляют |
|
чувствительность к ингибиторам: клавулановой кислоте, сульбактаму и |
|
тазобактаму [8,9]. |
|
Стандартные методы определения чувствительности бактерий к ан |
|
тимикробным препаратам не всегда позволяют выявить истинную ре |
|
зистентность БЛРС-продуцирующих энтеробактерии к антибиотикам. |
|
Это служит основанием для использования более эффективных мето |
|
дов выявления устойчивости бактериальной флоры к антибиотикам. |
|
Различные фенотипические методы, применяемые в настоящее время |
|
для обнаружения продукции БЛРС, основаны на эффекте подавления |
|
их активности в отношении оксиимино-р-лактамов в присутствии кла |
|
вулановой кислоты [10,11]. |
|
К сожалению, традиционные микробиологические методы не обе |
|
спечивают детекции БЛРС у 100% штаммов энтеробактерии. Ситуация |
|
существенно затрудняется в достаточно часто встречающихся случаях |
|
наличия у микроорганизмов нескольких детерминант устойчивости |
|
одновременно. |
|
Успех в решении этой задачи в значительной степени определяет |
|
ся использованием молекулярно-генетических методов исследования, |
|
основанных на использовании полимеразной цепной реакции (ПЦР). |
|
Их применение позволяет не только выявить наличие генов р-лактамаз, |
|
но и определить классы БЛРС, выявить мутации в различных генах, свя |
|
занных с формированием антибиотикорезистентности [12-14]. |
|
Из изложенного следует, что оптимальная эффективная стратегия |
|
борьбы с антибиотикорезистентностью может быть достигнута путем |
|
отслеживания фенотипов антибиотикорезистентности клинических |
|
изолятов, перекрестной проверки с целью скрининга качества те |
|
стирования, сбора сведений о генах, приводящих к определенному |
|
фенотипу, оценки значимости этих фенотипов, определения тактики |
|
рациональной и эффективной антибиотикопрофилактики и антибио- |
|
тикотерапии. |
|
«Лабораторная диагностика» № 2 (02), 2012 |
75 |
|
Молекулярно-генетическая технология выявления резистентности энтеробактерий |
|
к бета-лактамным антибиотикам на основе геноиндикации бета-лактамаз расширенного спектра |
|
• ЦЕЛЬ |
i |
Разработать молекулярно-генетическую технологию определения |
|
генов антибиотикорезистентности энтеробактерий (БЛРС различных |
J |
классов - ТЕМ, ОХА, SHV, СТХ-М) у возбудителей пиелонефритов. |
|
• МАТЕРИАЛЫ И МЕТОДЫ |
|
Исследование выполнено на материале 115 клинических изолятов |
|
энтеробактерий (70 - Escherichia coli, 35 - Proteus spp., 10 - Klebsiella |
|
pneumoniae), выделенных в 2005-2008 гг. из мочи госпитализирован |
|
ных пациентов с острыми и хроническими пиелонефритами в Гомель |
|
ской областной клинической больнице. |
г |
С использованием метода «двойных дисков» осуществлен феноти- |
|
пический скрининг продукции бета-лактамаз расширенного спектра |
• |
для исследуемых штаммов микроорганизмов с различными профилями |
|
резистентности к антибиотикам. |
|
Для выявления генов БЛРС различных классов (ТЕМ, ОХА, SHV, |
|
СТХ-М) проведена полимеразная цепная реакция с электрофоретиче- |
Ь |
ской детекцией продуктов амплификации. Определена групповая при |
|
надлежность БЛРС классов ТЕМ и СТХ-М в мультиплексной ПЦР в реаль |
ном времени. Для тестирования отобраны 49 культур энтеробактерий с подтвержденным БЛРС-фенотипом (Е. coli - 29 штаммов, К. pneumo niae - 5 штаммов, Proteus spp. - 15 штаммов).
Выделение бактериальной ДНК
Три-четыре колонии из суточной культуры исследуемого микроор ганизма, выращенной на Мюллер-Хинтон агаре, переносили в центри фужную пробирку, содержащую 500 мкл стерильной деионизированной воды, и суспендировали с помощью шейкера. Микробные клетки осаж дали центрифугированием в течение 1 мин при 10 000 об/мин. Супернатант удаляли, добавляли 100 мкл ТЕ-буфера и ресуспендировали осадок шейкером. Пробирки инкубировали в твердотельном термостате в тече ние 20 мин при 99°С. После термостатирования образцы повторно под вергали центрифугированию в течение 1 мин при 10 000 об/мин. Супернатант в объеме 75 мкл переносили в полистироловые микропробирки и замораживали до проведения ПЦР.
Геноиндикация БЛРС класса ОХА
Определению ОХА-карбапенемаз с БЛРС-активностью (ОХА-23, ОХА-40, ОХА-58) было подвергнуто 49 культур энтеробактерий с под твержденным БЛРС-фенотипом.
Реакционную смесь для амплификации участков генов карбапенемаз групп ОХА-23, ОХА-40, ОХА-58 готовили в пересчете на необходимое количество реакций.
Использовали три пары праймеров:
• OXA-58-fwd (5'-GGGCTTGTGCTGAGCATAGT-3') и OXA-58-rev (5'-CGTAGAGCAATATCATCACCAGC-3');
• OXA-40-fwd (5'-GATGAAGCTCAAACACAGGGTG-3') и OXA-40-rev (5'-TTTCCATTAGCTTGCTCCACC-3');
• OXA-23-fwd (5'-TTTCTTTCTGGTTGTACGGTTCA-3') и OXA-23-rev (5'-CATTTCTGACCGCATTTCCA-3').
76
|
Оригинальные исследования / Молекулярная генетика Ш |
|
|
В качестве контрольных штаммов использовали культуры микроор |
Отдельно вносили |
ганизмов, полученные в НИИ антимикробной химиотерапии (Смоленск, |
2 мкл образца ДНК |
|
Российская Федерация): |
исследуемых |
|
• |
A. baumanii RESORT 547 (позитивный контроль, ОХА-23); |
и контрольных |
• |
A. baumanii RESORT 797 (позитивный контроль, ОХА-58); |
штаммов (общий объем |
• |
Е. coli ATCC 25922 (негативный контроль). |
реакции составлял |
|
Амплификация осуществлялась на термоциклере Rotor Gene 3000 |
25 мкл). |
согласно протоколу. Для идентификации продуктов амплификации проводился анализ кривых плавления в режиме 72-94°С (ГС/10 с) с детекцией флуоресценции по SYBR Green I.
Сравнению подлежали кривые плавления опытных образцов с кри выми плавления позитивных контрольных штаммов.
Геноиндикация БЛРС класса ТЕМ
Для выявления бета-лактамаз класса ТЕМ с БЛРС-активностью вы полнялся анализ мутаций в позициях 104,164,237-240ТЕМ (3-лактамаз. Метод основан на амплификации 3 коротких (50-80 п.н.) фрагментов гена ЫаТЕМ, соответствующих областям кодонов 104, 164 и 237-240, с использованием 3 пар праймеров и 4 зондов, меченых различ ными флуорофорами (FAM, R6G, ROX, Су5). Идентификация мутаций в интересующих участках гена осуществлялась на основании оценки температур плавления (Тт) зондов. В качестве контрольных об разцов использовались штаммы с известными мутациями в генах ЫаТЕМ.
Реакционную смесь готовили в пересчете на необходимое коли чество реакций. Для постановки ПЦР вначале в пробирки помещали нижнюю смесь, затем поверх ее наносили каплю расплавленного вос ка и после его застывания - верхнюю смесь. После этого в каждую пробирку для постановки ПЦР добавляли 5 мкл образца ДНК иссле дуемых или контрольных штаммов. В качестве контрольных штаммов использовали культуры микроорганизмов, полученные в НИИ анти микробной химиотерапии (Смоленск, Российская Федерация):
•Е. coli 197 (позитивный контроль, ТЕМ-1 В);
•Е. coli J53.2 (позитивный контроль, ТЕМ-3:104К, 238S);
•Е. coli J53 (позитивный контроль, ТЕМ-10:164S, 240К);
•Е. coli J53 (позитивный контроль, ТЕМ-11:164Н);
•К. pneumoniae 3151 (позитивный контроль, ТЕМ-68:238S, 240К);
•Е. coli ATCC 25922 (негативный контроль).
Общий объем реакционной смеси составлял 25 мкл. Амплификацию проводили на термоциклере Rotor Gene 3000 в ва
рианте «горячего старта».
Для идентификации продуктов амплификации анализировали кри вые плавления в режиме 45-80°С (ГС/10 с), с детекцией флуоресцен ции по FAM, R6G, ROX, Су5 в автоматическом режиме. Сравнивали кри вые плавления опытных образцов с кривыми плавления позитивных контрольных штаммов.
Данный метод позволяет идентифицировать одновременно все известные мутации (7 полиморфизмов в 5 кодонах), связанные с БЛРСактивностью ТЕМ, в одной пробирке за 2 часа.
«Лабораторная диагностика» № 2 (02), 2012 |
77 |
Молекулярно-генетическая технология выявления резистентности энтеробактерий к бета-лактамным антибиотикам на основе геноиндикации бета-лактамаз расширенного спектра
|
|
Геноиндикация БЛРС класса SHV |
|
|
Амплификация с использованием пары праймеров SHV-1R и SHV-1F |
|
выполнялась на термоциклере Rotor Gene 3000, с последующей детекци |
|
|
ей продуктов амплификации в гель-электрофорезе. Проводилось сопо |
|
|
ставление ампликонов контрольных и опытных образцов ДНК по молеку |
|
|
лярной массе. В качестве контролей использовали штаммы из коллекции |
|
|
НИИ антимикробной химиотерапии (Смоленск, Российская Федерация): |
|
|
• |
Е. coll ATCC 25922 (негативный контроль); |
|
• К. pneumoniae ATCC 700603 (позитивный контроль, SHV-18); |
|
|
• Е. coli DH5a CTA-2 (позитивный контроль, SHV-2); |
|
|
• |
Е. coli DH5a CTA-8 (позитивный контроль, SHV-8); |
|
• |
Е. cloacae RESORT 555 (позитивный контроль, SHV-5). |
|
|
Для типирования БЛРС класса SHV использовалась мультиплексная |
|
ПЦР с последующей оценкой температур плавления зондов, позволя |
|
|
ющая выявлять точечные мутации, придающие расширенный спектр |
|
|
бета-лактамазной активности в кодонах 179 и 238-240 Ыа5т/-генов. Диф |
|
|
ференциация мутаций, соответствующих аминокислотным заменам в |
|
Сравнению подлежали |
кодонах D179-^G/N/A, G238^S/A и Е240^>К, осуществлялась с помо |
|
кривые плавления |
щью двух зондов, меченых различными флуорофорами: R6G (кодон 179) |
|
опытных образцов |
и FAM (кодоны 238-240). |
|
с кривыми плавления |
|
Идентификация продуктов амплификации проводилась на основе |
позитивных |
анализа кривых плавления в режиме 45-85°С (ГС/10 с), с детекцией |
|
контрольных штаммов. |
флуоресценции по FAM и R6G в автоматическом режиме. |
|
Геноиндикация БЛРС класса СТХ-М
В качестве контролей были использованы следующие штаммы микроорганизмов: Е. coli ТОРЮ/Sty (СТХ-М-5, позитивный контроль); Е. coli RESORT 1224 (СТХ-М-3, позитивный контроль); Е. coli RESORT 333 (СТХ-М-14, позитивный контроль); С. amalonaticus Rio-2 (CTX-M-8, пози тивный контроль); Е. coli ATCC 25922 (негативный контроль).
Для ПЦР-амплификации генов СТХ-М применялся общий для всех типов СТХ-М прямой праймер CTX-M-Fext и два обратных праймера: CTX-M(1-2)-Rnest, специфичный для генов СТХ-М-1- и СТХ-М-2-род- ственных ферментов, и CTX-M-R1c, специфичный для генов СТХ-М-8/25- и СТХ-М-9-родственных ферментов.
|
|
Структура праймеров: |
|
• |
CTX-M-Fext (5'-TTTGCGATGTGCAGTACCAGTAA-3'); |
|
• |
CTX-M-R1 с (5'-CCGCTGCCGGTCTTATC-3'); |
|
• |
CTX-M0 -2)-RNest (5'-TGATCTCAACGCGCTGATTTA-3'). |
|
|
Реакционную смесь готовили в пересчете на необходимое коли |
|
чество реакций. Вначале вносили в пробирки для ПЦР нижнюю смесь, |
|
|
затем поверх ее каплю расплавленного воска и после его застывания - |
|
Общий объем смеси - |
верхнюю смесь. После этого в каждую пробирку для ПЦР добавляли |
|
25 мкл. |
2,5 мкл образца ДНК исследуемых или контрольных штаммов. |
|
|
|
Амплификация была проведена на термоциклере Rotor Gene 3000 в |
|
варианте «горячего старта». |
|
|
|
Детекция продуктов амплификации ДНК контрольных и опытных |
|
штаммов выполнялась с использованием гель-электрофореза. Для |
|
|
определения групп СТХ-М генов было проведено сопоставление и диф- |
|
ференцировка ампликонов контрольных и опытных образцов ДНК по молекулярным массам, приведенным в табл.
78
Оригинальные исследования / Молекулярная генетика 11
Таблица Размер ампликонов для генов СТХ-М различных кластеров
СТХ-М группа (кластер) |
Длина ПЦР-продукта, п.н. |
|
|
СТХ-М-1 |
97 |
|
|
СТХ-М-2 |
97 |
|
|
СТХ-М-8/25 |
518 |
|
|
СТХ-М-9 |
518 |
|
|
Дополнительно для дифференциации представителей генетиче ских кластеров СТХ-М-1 и СТХ-М-2, СТХ-М-8/25 и СТХ-М-9 выполнял ся анализ температур плавления ПЦР-продуктов (СТХ-М-1 - 82,8°С, СТХ-М-2 - 84,3°С, СТХ-М-8/25 - 89,3°С, СТХ-М-9 - 90,7°С) с детекцией флуоресценции по SYBR Green I.
• РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Геноиндикация БЛРС класса ОХА
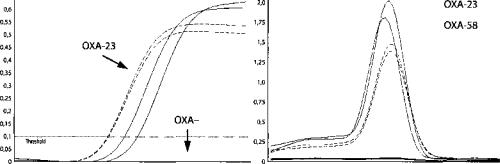
Результаты определения ОХА-БЛРС представлены на рис. 1. Выяв лены гены БЛРС ОХА-23 (ампликон размером 723 пар нуклеотидов) и ОХА-58 (ампликон размером 723 пар нуклеотидов) у соответствующих контрольных штаммов A. baumanii. Ни в одном из представителей 49 ис следованных штаммов, как и в негативном контроле, Е. coli ATCC 25922 бета-лактамазы расширенного спектра класса ОХА обнаружены не были (ОХА-).
Из полученных результатов следует, что выявленная скрининговым фенотипическим методом БЛРС-активность исследуемых штаммов не была обусловлена наличием ОХА-генов.
Norm. Fluoro. |
dF/dT |
0,65 I |
I |
5 |
10 |
15 |
20 |
25 |
30 |
Cycle |
Threshold ?5 |
8Q |
g5 |
gQ |
deg |
|
|
|
А |
|
|
|
|
|
В |
|
|
Рис. 1. Кривые амплификации (А) и плавления (В) участков генов ЫаОХА-23 (723 п.н.) |
|
|
|||||||||
и ЫаОХА-58 (738 п.н.) |
|
|
|
|
|
|
|
|
|
|
|
«Лабораторная диагностика» № 2 (02), 2012 |
|
|
|
|
|
|
79 |
||||
Молекулярнотенетическая технология выявления резистентности энтеробактерий к бета-лактамным антибиотикам на основе геноиндикации бета-лактамаз расширенного спектра
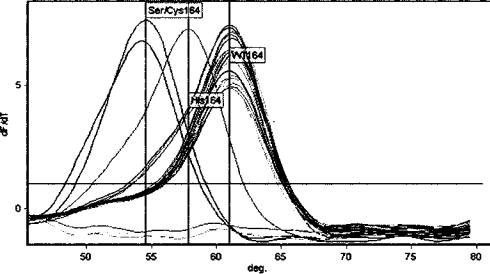
Рис. 2. Анализ кривых плавления для идентификации БЛРС-мутаций в 164 позиции гена Ыа
Геноиндикация БЛРС класса ТЕМ
Результаты определения мутаций в 164 позиции гена ЫаТЕМ/ придаю щими БЛРС-активность, представлены на рис. 2.
При анализе кривых плавления выявлены нуклеотидные замены в этой позиции гена ЫаТЕМ только для контрольных штаммов Е. coli J53 (ТЕМ-10: 164S), Е. coli J53 (ТЕМ-11: 164Н). У 34 из 49 исследуемых штам мов также амплифицировался участок гена ЫаТЕМ/ однако нуклеотидных замен в 164 позиции, придающих БЛРС-активность, установлено не было (WT, дикий тип).
Результаты определения мутаций в 237-240 позициях гена ЫаТЕМ, придающих БЛРС-активность, представлены на рис. 3.
При анализе кривых плавления нуклеотидные замены в этой пози ции гена ЫаТЕМ выявлены только для трех контрольных штаммов: Е. coli J53.2 (ТЕМ-3:238S), Е. coli J53 (ТЕМ-10:240К), К. pneumoniae 3151 (ТЕМ-68: 238S, 240К).
У 38 из 49 исследуемых штаммов также амплифицировался данный участок гена ЫаТЕМ, однако нуклеотидных замен в позициях 237-240, придающих БЛРС-активность, выявлено не было (WT, дикий тип).
Результаты определения мутаций в 104 позиции гена ЫаТЕМ, придаю
щими БЛРС-активность, представлены на рис. 4. |
|
|
|||||
При анализе кривых плавления выявлены |
нуклеотидные |
заме |
|||||
ны в |
этой |
позиции гена |
ЫаТЕМ |
только для контрольного штамма |
|||
Е. coli |
J53.2 |
(ТЕМ-3: 104К). |
У 38 |
из 49 |
исследуемых штаммов |
также |
|
амплифицировался участок |
гена |
ЫаТЕМ, |
однако |
нуклеотидных |
замен |
||
в 104 позиции, придающих БЛРС-активность, выявлено не было (WT, ди кий тип).
80

Оригинальные исследования / Молекулярная генетика Ш
Рис. 3. Анализ кривых плавления для идентификации БЛРС-мутаций в 237-240 позициях гена ЫаТ[
Рис. 4. Анализ кривых плавления для идентификации БЛРС-мутаций в 104 позиции гена Ыат,
«Лабораторная диагностика» № 2 (02), 2012 |
81 |
Молекулярно-генетическая технология выявления резистентности энтеробактерий кбета-лактамным антибиотикам на основе геноиндикации бета-лактамаз расширенного спектра
Таким образом, выявленные у 38 исследуемых изолятов гены ЫаТЕМ не имели нуклеотидных замен, придающих расширенную бета-лакта- мазную активность (WT, дикий тип), что позволило отнести их к генети
|
ческой группе ТЕМ-1. |
|
Геноиндикация БЛРС класса SHV |
|
ПЦР-детекция бета-лактамаз SHV-типа осуществлена для 29 штам |
|
мов Е. coli, 15 штаммов Proteus spp. и 5 штаммов К. pneumoniae, у кото |
|
рых с помощью метода «двойных дисков» ранее был определен БЛРС- |
|
фенотип. Также в исследование включены 5 штаммов К. pneumoniae и |
|
15 штаммов E.coli без БЛРС-активности. |
|
У всех представителей позитивных контролей (Е. coli DH5a CTA-2, |
|
Е. coli DH5a CTA-8, E. cloacae RESORT 555) выявлен продукт амплифи |
|
кации размером около 260 п.н. Аналогичный ампликон обнаружен и у |
|
всех опытных БЛРС-позитивных штаммов К. pneumoniae и 4-х штаммов |
|
К. pneumoniae без определяемой фенотипическими методами БЛРС- |
|
активности. У всех исследованных штаммов Proteus spp. и Е. coli (неза |
|
висимо от наличия или отсутствия фенотипически определяемой БЛРС- |
|
активности) гены blaSHV не детектировались. Не выявлены продукты |
|
амплификации и в негативном контроле Е. coli ATCC 25922. |
Большинство БЛРС |
Проведенное исследование позволило установить наличие |
класса SHV являются |
Ыа5НУ-генов как у БЛРС-позитивных, так и БЛРС-негативных штаммов |
производными SHV-1, К. pneumoniae. Данный факт можно объяснить присутствием у БЛРС-
детерминирующие |
негативных штаммов плазмидно-кодируемой пенициллиназы SHV-1, |
их гены отличаются |
не обладающей расширенным спектром активности в отношении бета- |
от гена blaSHV-1 |
лактамных антибиотиков. Большинство БЛРС класса SHV являются про- |
единичными |
изводными SHV-1, детерминирующие их гены отличаются от гена blaSHV-1 |
точечными мутациями |
единичными точечными мутациями в 149,156,179, 238 и 240 позициях, |
в 149,156,179,238 |
а единичные аминокислотные замены расширяют спектр ферментатив- |
и 240 позициях, |
ной активности. |
а единичные |
Анализ кривых плавления зондов не выявил точечных мутаций в |
аминокислотные |
анализируемых кодонах (179, 238-240) Ыа5НУ-генов исследуемых штам- |
замены |
мов клебсиелл (WT, дикий тип). |
расширяют спектр |
Таким образом, обнаруженные у 5 штаммов К. pneumoniae blaSHV- |
ферментативной |
гены относятся к генетической группе SHV-1 (плазмидно-кодируемые |
активности. |
пенициллиназы SHV-1, не обладающие расширенным спектром актив |
|
ности в отношении бета-лактамных антибиотиков). |
|
Геноиндикация БЛРС класса СТХ-М |
|
У14 штаммов Е. coli, 8 штаммов P. mirabilis и 5 штаммов К. pneumoniae |
|
выявлен продукт амплификации длиной около 97 п.н. с температу |
|
рой плавления около 82,8-83,0°С. Аналогичный ПЦР-продукт ампли- |
|
фицировался для позитивного контроля Е. coli RESORT 1224 (СТХ-М-3, |
|
генетическая группа СТХ-М-1). У 2 штаммов Е. coli обнаружен продукт |
|
амплификации длиной 518 п.н. с температурой плавления около 91 °С. |
|
Аналогичный ПЦР-продукт амплифицировался для позитивного кон |
|
троля Е. coli RESORT 333 (СТХ-М-14, генетическая группа СТХ-М-9). |
|
У контрольного штамма энтеробактерий Е. coli ТОРЮ/Sty (СТХ-М-5, |
|
генетическая группа СТХ-М-2) выявлен продукт амплификации длиной |
|
97 п.н. с температурой плавления 84,5°С. Для штамма С. amalonaticus |
82

Оригинальные исследования / Молекулярная генетика 11
Norm. Fluoro.
0,9 |
|
|
|
|
|
, . - " • " " |
|
0,85 |
|
|
|
|
|
/ |
|
0,8 |
|
|
|
|
/ |
|
|
0,75 |
|
|
|
|
|
|
|
0,7 |
|
|
|
|
|
_ |
|
0,65 |
СТХ-М+ |
|
|
|
|
|
|
0,6 |
|
|
|
|
|
|
|
0,55 |
|
|
|
|
|
" |
|
0,5 |
|
|
< |
|
|
|
|
0,45 |
|
|
|
|
|
||
0,4 |
|
|
|
|
|
||
0,35 |
|
|
|
|
|
|
|
0,3 |
|
|
|
|
|
|
|
0,25 |
|
|
|
|
стх-м- |
||
0,2 |
|
|
|
|
|||
0,15 |
|
|
|
|
|
1 |
|
0,1 |
|
|
|
|
|
|
|
Threshold |
|
|
|
|
t |
||
0,05 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
15 |
20 |
|
25 |
|
|
5,0
4,5
4,0
3,5
3,0
2,5
2,0
1,5
1,0
0,5
СТХ-М-1 |
|
СТХ-М-2 |
|
|
|
|
/ |
_ |
СТХ-М-8 |
|
|
|
|
|
|
||
|
|
А |
|
СТХ-М-9 |
|
|
|
|
|
||
/ |
|
/ ^ |
|
f ч |
|
// |
|
\ |
/ |
^ |
|
|
|
||||
/ |
1 |
|
|||
1 |
' |
|
/ |
|
^ |
1 / |
^ |
|
|||
/ |
|
\ |
|||
/ |
|
\ |
|
|
\ |
^Ц^—~" 1Г_1ГГ-С'Л |
"* " * |
|
|
||
/
Threshold |
. — - _ _ |
|
|
|
deg |
Рис. 5. Кривые амплификации (А) и плавления (В) участков генов Ыас т х .м контрольных и опытных штаммов
Rio-2 (СТХ-М-8) характерен продукт амплификации длиной 518 п.н. с температурой плавления 89,5°С. Не выявлены продукты амплификации в негативном контроле Е. coli ATCC 25922 (рис. 5).
Проведенное исследование позволило установить присутствие Ыастх.м-генов двух генетических кластеров (СТХ-М-1 и СТХ-М-9) среди штаммов Е. coli, P. mirabilis и К. pneumoniae с подтвержденной фенотипической БЛРС-активностью.
• выводы
1.Показано, что определяемая скрининговым фенотипическим мето дом БЛРС-активность исследуемых штаммов не обусловлена нали чием ОХА-генов.
2.Выявлено присутствие Ыастх-генов двух генетических кластеров (СТХ-М-1 и СТХ-М-9) среди штаммов Е. coli, P. mirabilis и К. pneumoniae
сподтвержденной фенотипической БЛРС-активностью.
3.Обнаружение генов SHV и ТЕМ не является однозначным свидетель ством БЛРС-активности и требует анализа наличия точечных мута ций в позициях, увеличивающих спектр активности в отношении цефалоспоринов III-IV поколений.
4.Разработанная технология молекулярно-генетического исследова ния, базирующаяся на обнаружении нуклеотидных замен в генах SHV и ТЕМ с использованием зондовых методик и анализа кривых плавления, может быть использована в качестве подтверждающего метода в лабораториях молекулярной генетики для выявления рас ширенной бета-лактамазной активности, обусловливающей антибиотикорезистентность.
5.Полученные результаты исследования заслуживают повседневного использования как в работе лечебных учреждений и лабораторий клинической микробиологии, так и для проведения референтных исследований в лабораториях молекулярной генетики.
«Лабораторная диагностика» № 2 (02), 2012
