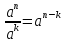- •Теплотехника теплотехника
- •1.Основные понятия и определения
- •Вопросы тестов
- •2. Первый закон термодинамики
- •Вопросы тестов
- •3.Термодинамические процессы с идеальным газом.
- •Изохорный процесс.
- •Изобарный процесс.
- •Изотермический процесс.
- •Адиабатный процесс.
- •Политропный процесс.
- •Вопросы тестов
- •4. Второй закон термодинамики
- •Вопросы тестов
- •5.Влажный воздух
- •Вопросы тестов
- •6.Водяной пар
- •Процесс парообразования в hs -диаграмме
- •Вопросы тестов
- •Теплопередача
- •6.Теплопроводность
- •Вопросы тестов
- •7. Конвективный теплообмен
- •7.1. Продольное обтекание тонкой пластины.
- •7.2. Турбулентное течение теплоносителя внутри трубы.
- •Вопросы тестов
- •8. Теплообмен излучением
- •Теплообмен излучением системы тел в прозрачной среде
- •Вопросы тестов
- •9. Теплопередача
- •Вопросы тестов
- •10. Основы теплового расчета теплообменников
- •Вопросы тестов
Теплотехника теплотехника
Составитель Бадах Вячеслав Фёдорович весна 2013.
|
Если
Если
|
1.Основные понятия и определения
Термодинамика рассматривает закономерности взаимного превращения двух форм существования энергии: в виде работы и в виде теплоты.
Под рабочим телом понимают вещество, с помощью которого в тепловых машинах реализуются рабочие процессы.
Мера измерения количества вещества - моль. 1 моль = 6,0221023 штук молекул.
Число
Авагадро NА=6,0221023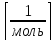 - число молекул в одном моле вещества.
- число молекул в одном моле вещества.
Молярная масса вещества
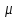 – масса одного моля вещества
– масса одного моля вещества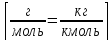 :
:
Водород H2 2;
Азот N2 28;
Воздух 29;
Кислород O2 32
Диоксид углерода CO2 44;
Диоксид серы SO2 64.
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
Давление измеряется в
паскалях 1Па = 1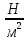 . 1МПа
= 106Па.
. 1МПа
= 106Па.
Температура – физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
Температура измеряется
в градусах Кельвина Т
= t
+ 273,15
 .
.
Удельный
объем –
отношение объема вещества к его массе
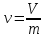 ,
,
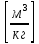 .
.
Абсолютное давление p, удельный объем v и абсолютная температура Т однозначно определяют термодинамическое состояние однофазного тела и называются термодинамическими параметрами состояния.
Уравнение состояния идеального газа Клапейрона – Менделеева:
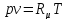 (1.1),
(1.1),
где
р – давление, Па,
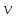 - удельный объем
- удельный объем
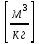 ,
Rμ
=
,
Rμ
=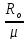 - газовая
постоянная данного газа,
- газовая
постоянная данного газа,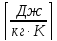 ,Ro
= 8,314
,Ro
= 8,314
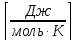 -универсальная
газовая постоянная.
-универсальная
газовая постоянная.
Например,
для кислорода
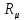 =
=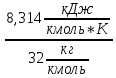 =
=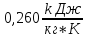 .
(1.2)
.
(1.2)
Уравнение состояния содержит три параметра: давление, удельный объём и температуру. Два из них независимы, а третий определяется по уравнению (1.1).
Для
любого процесса 1-2:,
p1 v1=Rμ
v1=Rμ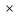 T1,
T1,
p2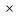 v2=Rμ
v2=Rμ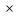 T2.
T2.
Разделив
левую часть первого уравнения на левую
часть второго уравнения, а правую часть
первого уравнения на правую часть
второго уравнения и сократив Rμ,
получим:
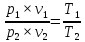 (1.3)
(1.3)
Смесь идеальных газов Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
рсм = р1 + р2 + р3 + . . .рn = ∑ рi , (1.4)
где р1 , р2 , р3 . . .рn – парциальные давления.
Состав смеси задается
долями объемными ri
=
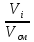 и массовыми gi
=
и массовыми gi
=
 .
.
где Vi;Vсм–объемы компонентов и смеси; mi;mсм–массы компонентов и смеси;.
Так как V1 +V2 = Vсм и m1 + m2 = mсм , то r1 + r2 = 1 , g1 + g2 = 1. .
Молярная
масса смеси:
μсм
= μ1
r1
+ μ2
r2.
μсм
=
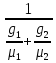
где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь
между объемными и массовыми долями: g1
= r1∙ ;g2
= r2∙
;g2
= r2∙ .
.
Теплоемкость газа. Теплоёмкостью тела называется количество теплоты, необходимое для изменения его температуры на 1 К.
Истинная теплоемкость
рабочего тела определяется отношением
количества подведенной (отведенной) к
рабочему телу теплоты в данном
термодинамическом процессе к вызванному
этим изменениям температуры тела:
c
=
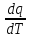
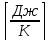 (1.5)
(1.5)
q
=
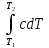 = ccp
= ccp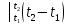 .
(1.6)
.
(1.6)
Различают
следующие удельные теплоемкости:
массовую: c
=
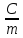
 ;
;
молярную:
μc
=
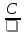
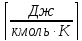 ,
где
,
где
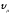 – количества вещества [кмоль];
– количества вещества [кмоль];
объемную:
c =
=

 .
Связь между этими теплоемкостями:
.
Связь между этими теплоемкостями:
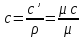
где
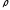 – плотность вещества,
– плотность вещества,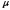 – молярная (молекулярная) масса,
[кг/кмоль].
– молярная (молекулярная) масса,
[кг/кмоль].
Различают теплоемкости
при постоянном давлении cp
=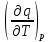 и при постоянном объеме
и при постоянном объеме
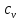 =
=
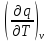 .
.
Связь между изобарной и изохорной теплоемкостями дается уравнением Майера: Для идеальных газов ср - сv = Rµ. Для реальных газов ср - сv > Rµ.
Показатель адиабаты k
=
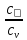 .
Для одноатомных rазов k
=1,67,
для двухатомных
k
=1,40,
для трехатомных и более k
=1,33.
.
Для одноатомных rазов k
=1,67,
для двухатомных
k
=1,40,
для трехатомных и более k
=1,33.

 , тоa
, тоa d=b
d=b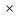 c.
c.
 =
= .
.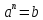 ,
то
,
то
 .
.
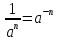 .
.