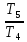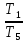3 КУРС / Теплотехника / Теплотех. 3.Устан.Термодин.цикл5 40вар. 8нояб. 2012
.docxРАСЧЕТ ТЕРМОДИНАМИЧЕСКОГО ЦИКЛА
Исходные данные. Рабочее тело совершает прямой термодинамический цикл, состоящий из следующих друг за другом процессов: процесс 1-2 - изобарный, р = const;
2-3 - адиабатный, рvk = const;
3-4 - изотермический, рv = const;
4-5 - политропный, рvn = const;
5-1 - изохорный, v = const.
Заданы некоторые параметры состояния в узловых точках цикла
|
p1 |
v1 |
v2 |
р3 |
v4 |
n |
Рабочее тело |
μ |
|
МПа |
м3/кг |
м3/кг |
МПа |
м3/кг |
- |
- |
кг/кмоль |
|
1,00 |
0,156 |
0,250 |
0,100 |
0,350 |
1,10 |
О2 |
32 |
n - показатель политропы, μ - молярная масса газа
Требуется определить: 1.Недостающие значения параметров состояния в узловых точках;
2.Полную работу цикла;
3.Теплоту, подведённую к рабочему телу;
4.КПД цикла.
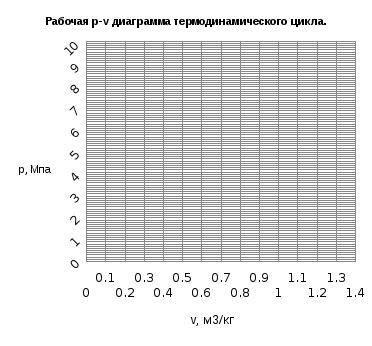
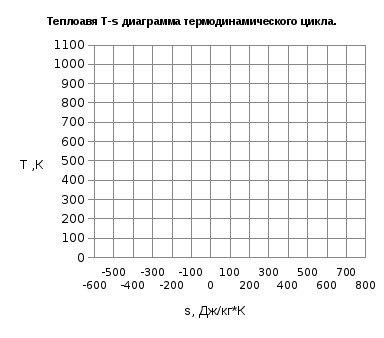
Построить графики цикла в p-v и T-s диаграммах.
Расчёт термодинамического цикла выполняется в следующем порядке.
Вначале рассчитываются характеристики рабочего тела. Газовая постоянная рабочего тела определяется через универсальную газовую постоянную и молярную массу рабочего тела по формуле
R
=
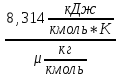 ,
(1).
,
(1).
Удельные
массовые изохорная сv
и изобарная сp
теплоемкости
определяются по соотношениям
молекулярно-кинетической теории: сv=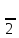 R,
(2), сp=сv+
R,
(3). где
i
-
число степеней свободы молекулы
идеального газа (для одноатомного газа
i=3,
двухатомного - i=5,
трехатомного и более - i=6).
R,
(2), сp=сv+
R,
(3). где
i
-
число степеней свободы молекулы
идеального газа (для одноатомного газа
i=3,
двухатомного - i=5,
трехатомного и более - i=6).
Показатель адиабаты к равен к=сp/сv ,(4).
При расчётах удобно использовать таблицу, в левой части которой записываются параметры состояния давление p, удельный объём v, температуру T и энтропия s, а в правой – количество теплоты, работа процесса и изменения внутренней энергии и энтропии.
В каждой узловой точке выполняется уравнения состояния Клапейрона pv = R T, (5),
поэтому при наличии в точке двух известных параметров третий рассчитывается по этому уравнению.
Для,
точки 1: p1v1
= Rо
T1.
p1=1,00
Мпа, v1
= 0,156
 .
тогда
Т1=
.
тогда
Т1=
 =
=
 =
=
 К = 600 К.
К = 600 К.
Рассчитанные значения параметров состояния округляются до того же количества значащих цифр, какое было в исходных данных.
Параметры состояния в двух соседних точках связаны между собой уравнением термодинамического процесса, проходящего между ними.
Например, из точки 1 в точку 2 рабочее тело пришло в результате изобарного процесса, при котором р = const, тогда p2 = p1= 1,00 Мпа.
Удельный объём в точке 3 определяется из соотношения p2v2k =p3v3k, (6), и так далее.
|
Точка |
р |
v |
T |
s |
Изменение энтропии |
Процесс |
Количество теплоты |
Изменение внутренней энергии |
Работа процесса |
|
|
|
МПа |
м3/кг |
K |
кДж/кг*К |
Δs |
q, |
ΔU |
A |
||
|
1 |
1,00 |
0,156 |
p*v/R |
s1=0 |
кДж/кг*К |
|
кДж/кг |
кДж/кг |
кДж/кг |
|
|
Δs12=cpln
|
Изобарный p = const |
q12=ΔU12+A12 |
ΔU12=cv(T2–T1) |
А12=R(T2–T1) |
||||||
|
2 |
p1=p2 |
0,250 |
p*v/R |
s2= s1+Δs12 |
||||||
|
0 |
Адиабатный pvk = const |
0 |
ΔU23=cv(T3–T2) |
А23= - ΔU23 |
||||||
|
2а |
pvk=const |
0,400 |
|
|
||||||
|
2б |
pvk=const |
0,700 |
||||||||
|
3 |
0,100 |
pvk=const |
p*v/R |
s3= s2+Δs23 |
||||||
|
Δs34=Rln |
Изотермический pv = const |
q34=A34 |
0 |
A34=RT3ln |
||||||
|
3а |
pv=const |
0,700 |
|
|
||||||
|
4 |
pv=const |
0,350 |
T4=T3 |
s4= s3+Δs34 |
||||||
|
Δs45=cv |
Политропный pvn= const |
q45=ΔU45+A45 |
ΔU45=cv(T5–T4) |
А45= |
||||||
|
4а |
pvn= const |
0,250 |
|
|
||||||
|
5 |
pvn= const |
v5=v1 |
p*v/R |
s5= s4+Δs45 |
||||||
|
Δs51=cvln |
Изохорный v = const |
q51=ΔU51 |
ΔU51=cv(T1–T5) |
0 |
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
∑Δs = 0 |
|
q подв. |
∑ΔU = 0 |
Ац |
|
Для более точного изображения на диаграммах графиков процессов необходимо рассчитать промежуточные точки 2а, 2б, 3а и 4а (выделены курсивом). Значения удельных объёмов в промежуточных точках выбираются произвольно примерно посередине процессов.
После
расчёта параметров состояния p,
v
и T
строится рабочая диаграмма цикла в p-
v
координатах. На этой диаграмме работа
в процессе 1-2 равна площади под кривой
процесса
(ограниченной кривой 1-2, перпендикулярами
из точек 1 и 2 на горизонтальную ось и
этой осью). На стадии расширения рабочего
тела работа всегда положительна, а на
стадии сжатия - всегда отрицательна.
Далее
определяется изменение энтропии Δs
и строится
тепловая диаграмма цикла в T-s
координатах.
При
изображении цикла на T-s
диаграмме по вертикальной оси откладывается
абсолютная температура Т
в градусах Кельвина, а по горизонтальной
- удельная энтропия s
в
кДж/кг*К.
Так как важна не сама энтропия, а её
изменение, то точку 1 наносят на диаграмму
с координатами Т=Т1
и s1=0.

Точка 2 будет иметь координаты Т=Т2 и s2= s1 + Δs12,
точка 3: Т=Т3 и s3= s2 + Δs23, и так далее.
На T-s диаграмме количество подведённого в процессе 1-2 тепла равно площади под кривой процесса (ограниченной кривой 1-2, перпендикулярами из точек 1 и 2 на горизонтальную ось и этой осью).
Для определения КПД цикла рассчитываются количество теплоты, работа и изменения внутренней энергии и энтропии в каждом процессе по формулам, приведённым в таблице.
Для каждого процесса выполняется первый закон термодинамики, выражаемый уравнением q=ΔU+A,(7),
поэтому вначале удобно рассчитать внутреннюю энергию ΔU, затем работу А, а количество подведённого тепла равно их сумме.
Работа термодинамического цикла равна алгебраической (с учётом знака) сумме работ процессов, составляющих цикл
АЦ = А12+А23+А34+А45+А51 (8).
Количество
подведённой в цикле теплоты
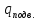 определяется суммированием только
положительных чисел
в столбце
q.
определяется суммированием только
положительных чисел
в столбце
q.
На завершающем этапе вычисляется коэффициент полезного действия цикла.
К.п.д. означает долю совершенной работы по отношению к подведенной теплоте:
=
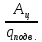 (9)
(9)
Работу выполнить на листах формата А4.
Титульный лист, таблица и диаграммы для результатов расчётов прилагаются. При необходимости откорректировать формат осей.
Дж
= Н
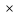 м Па =
м Па =
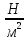 ;
1
МПа = 106
Па
;
1
МПа = 106
Па
 = м3
= м3
При
выполнении расчётов значения величин
подставлять в формулы ОБЯЗАТЕЛЬНО
с указанием размерности, например R0=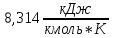 .
.
МИНОБРНАУКИ
РОССИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ СЕРВИСА И ЭКОНОМИКИ
ИНСТИТУТ СЕРВИСА АВТОТРАНСПОРТА, КОММУНАЛЬНОЙ
И БЫТОВОЙ ТЕХНИКИ
Кафедра «Машины и оборудование бытового
и жилищно-коммунального назначения»
К У Р С О В А Я Р А Б О Т А
по дисциплине
«Термодинамика и тепломассобмен»
Работу выполнил:
cтудент группы 151000.62
2 курса очного отделения ИСАКиБТ _______________________________ Фамилия, имя, отчество (полностью)
Работу проверил:
доцент кафедры МОБиЖКН к.т.н. ______________ Бадах В.Ф
Санкт-Петербург
2012 г.
|
Точка |
р |
v |
T |
s |
Изменение энтропии |
Процесс |
Количество теплоты |
Изменение внутренней энергии |
Работа процесса |
|
|
|
МПа |
м3/кг |
K |
кДж/кг*К |
Δs |
q, |
ΔU |
A |
||
|
1 |
|
|
|
|
кДж/кг*К |
|
кДж/кг |
кДж/кг |
кДж/кг |
|
|
|
Изобарный p = const |
|
|
|
||||||
|
2 |
|
|
|
|
||||||
|
|
Адиабатный pvk = const |
|
|
|
||||||
|
2а |
|
|
|
|
||||||
|
2б |
|
|
||||||||
|
3 |
|
|
|
|
||||||
|
|
Изотермический pv = const |
|
|
|
||||||
|
3а |
|
|
|
|
||||||
|
4 |
|
|
|
|
||||||
|
|
Политропный pvn= const |
|
|
|
||||||
|
4а |
|
|
|
|
||||||
|
5 |
|
|
|
|
||||||
|
|
Изохорный v = const |
|
|
|
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Варианты индивидуальных заданий |
||||||||
|
Вариант |
p1 |
v1 |
v2 |
p3 |
v4 |
n |
Рабочее тело |
μ |
|
|
МПа |
м3/кг |
м3/кг |
МПа |
м3/кг |
|
|
кг/кмоль |
|
3 |
1,10 |
0,148 |
0,248 |
0,100 |
0,349 |
1,12 |
Аг |
40 |
|
4 |
1,00 |
0,158 |
0,248 |
0,088 |
0,325 |
1,11 |
СО2 |
44 |
|
5 |
0,90 |
0,155 |
0,234 |
0,095 |
0,348 |
1,10 |
S02 |
64 |
|
6 |
1,10 |
0,153 |
0,225 |
0,110 |
0,356 |
1,15 |
NН3 |
17 |
|
7 |
1,11 |
0,149 |
0,249 |
0,100 |
0,349 |
1,12 |
N2 |
28 |
|
8 |
1,00 |
0,151 |
0,215 |
0,105 |
0,351 |
1,10 |
NН3 |
17 |
|
9 |
0,80 |
0,152 |
0,216 |
0,103 |
0,352 |
1,12 |
S02 |
64 |
|
10 |
1,10 |
0,148 |
0,248 |
0,150 |
0,350 |
1,15 |
Аг |
40 |
|
11 |
0,85 |
0,150 |
0,214 |
0,090 |
0,356 |
1,16 |
СО2 |
44 |
|
12 |
1,01 |
0,156 |
0,250 |
0,100 |
0,350 |
1,10 |
N2 |
28 |
|
13 |
1,05 |
0,153 |
0,253 |
0,106 |
0,358 |
1,12 |
О2 |
32 |
|
14 |
0,85 |
0,149 |
0,255 |
0,105 |
0,345 |
1,10 |
Аг |
40 |
|
15 |
0,90 |
0,155 |
0,236 |
0,095 |
0,348 |
1,10 |
NН3 |
17 |
|
16 |
0,83 |
0,149 |
0,228 |
0,089 |
0,339 |
1,16 |
О2 |
32 |
|
17 |
1,00 |
0,155 |
0,225 |
0,098 |
0,348 |
1,18 |
СО2 |
44 |
|
18 |
1,10 |
0,145 |
0,229 |
0,100 |
0,350 |
1,17 |
О2 |
32 |
|
19 |
1,00 |
0,153 |
0,253 |
0,090 |
0,355 |
1,12 |
N2 |
28 |
|
20 |
0,85 |
0,149 |
0,215 |
0,100 |
0,345 |
1,10 |
NН3 |
17 |
|
21 |
1,00 |
0,166 |
0,250 |
0,100 |
0,350 |
1,10 |
О2 |
32 |
|
22 |
0,85 |
0,159 |
0,250 |
0,090 |
0,353 |
1,15 |
N2 |
28 |
|
23 |
1,10 |
0,128 |
0,248 |
0,100 |
0,349 |
1,12 |
Аг |
40 |
|
24 |
1,00 |
0,168 |
0,258 |
0,088 |
0,365 |
1,14 |
СО2 |
44 |
|
25 |
0,90 |
0,165 |
0,255 |
0,095 |
0,348 |
1,10 |
S02 |
64 |
|
26 |
1,10 |
0,173 |
0,253 |
0,110 |
0,356 |
1,15 |
NН3 |
17 |
|
27 |
1,11 |
0,179 |
0,249 |
0,100 |
0,349 |
1,12 |
N2 |
28 |
|
28 |
1,00 |
0,171 |
0,251 |
0,105 |
0,351 |
1,10 |
NН3 |
17 |
|
29 |
0,80 |
0,182 |
0,253 |
0,103 |
0,352 |
1,12 |
S02 |
64 |
|
30 |
1,10 |
0,198 |
0,248 |
0,150 |
0,350 |
1,15 |
Аг |
40 |
|
31 |
0,85 |
0,190 |
0,240 |
0,090 |
0,356 |
1,16 |
СО2 |
44 |
|
32 |
1,01 |
0,186 |
0,250 |
0,100 |
0,350 |
1,10 |
N2 |
28 |
|
33 |
1,05 |
0,193 |
0,253 |
0,106 |
0,358 |
1,12 |
О2 |
32 |
|
34 |
0,85 |
0,189 |
0,255 |
0,105 |
0,345 |
1,10 |
Аг |
40 |
|
35 |
0,90 |
0,175 |
0,256 |
0,095 |
0,348 |
1,10 |
NН3 |
17 |
|
36 |
0,83 |
0,169 |
0,248 |
0,089 |
0,339 |
1,16 |
О2 |
32 |
|
37 |
1,00 |
0,167 |
0,250 |
0,098 |
0,348 |
1,18 |
СО2 |
44 |
|
38 |
1,10 |
0,168 |
0,249 |
0,100 |
0,350 |
1,17 |
О2 |
32 |
|
39 |
1,00 |
0,183 |
0,253 |
0,090 |
0,355 |
1,12 |
N2 |
28 |
|
40 |
0,85 |
0,149 |
0,255 |
0,100 |
0,345 |
1,10 |
NН3 |
17 |

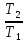
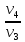
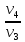
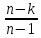 ln
ln