
Руководство по иммунофармакологии / 013306
.pdf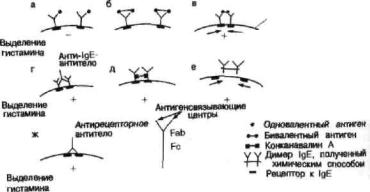
20 |
Глава 2 |
|
|
|
на один рецептор приходится один цвет, что |
валентных антигенов. Ключом к пониманию |
|||
свидетельствует об одновалентности IgE-pe- |
стимуляции тучных клеток и базофилов, ве- |
|||
цептора. |
|
|
роятно, является представление о поперечном |
|
В другой серии экспериментов определялось |
сшивании двух соседних Fc-e-рецепторов на |
|||
время |
восстановления флюоресценции после |
мембране. Для доказательства этого могут быть |
||
облучения лазером мембран тучных клеток, |
применены разные методы, схематически |
|||
несущих флюоресцеин-IgE и родамин-IgE. |
представленные на рис. 8. Бивалентные или |
|||
Иммобилизация флюоресцеин-IgE антителами |
многовалентные антигены вызывают попереч- |
|||
предотвращала восстановление зеленой флю- |
ное сшивание соседних IgE-молекул через их |
|||
оресценции и не влияла на красную. Это иссле- |
Fab-фрагменты (рис. 8, в), вызывая агрегацию |
|||
дование подтверждает положение об однова- |
Fc-рецепторов клеточных мембран. Анти-IgE, |
|||
лентной природе связывания IgE-рецептор и |
антитела класса IgG к Fc-e-тяжелых цепей IgE, |
|||
отвергает любое взаимодействие типа рецептор- |
агрегируют рецепторы, как показано на рис. 8, г. |
|||
рецептор. |
Скорость |
восстановления |
Fc- и Fab'-фрагменты этого анти-IgE, будучи |
|
флюоресценции в облученной зоне мембраны |
одновалентными, не активны. Лектин-конка- |
|||
может быть использована для определения |
навалин А активирует тучные клетки и базо- |
|||
коэффициента диффузии рецептора в мембране. |
филы, присоединяясь к IgE-связанным угле- |
|||
Он оказался равным 2-10- |
см2/сн, что очень |
водам и сшивая соседние молекулы иммуно- |
||
близко к значению коэффициента для |
глобулина (см. рис. 8,д). Димеры IgE, полу- |
|||
липидного маркера в той же мембране-8-10-9 |
ченные химическим путем, вызывают попереч- |
|||
см2/сн; это указывает на жидкую природу |
ное сшивание IgE-рецепторов. Очень изящно |
|||
мембран тучных клеток при физиологической |
была показана возможность активации тучных |
|||
температуре. |
|
|
клеток при агрегации Fc-рецепторов даже в |
|
|
|
|
|
отсутствие IgE. Это было достигнуто с по- |
|
|
|
|
мощью антител (IgG) к очищенным Fc-рецеп- |
Активациямембранногорецептора |
торам. Действие этих антител схематически |
|||
представлено на рис. 8, ж. Но если IgE занимает |
||||
Простое связывание молекулы IgE с Fc-e-pe- |
рецепторы (т.е. места, на которые направлено |
|||
действие антирецепторных антител), тем самым |
||||
цептором тучной клетки или базофильного |
маскируя их, то антирецепторные антитела не |
|||
лейкоцита не активирует клетку и не приводит к |
могут вызвать поперечное сшивание Fc-e- |
|||
выделению гистамина или других активных |
рецепторов. |
|||
веществ. Для активации необходимо присо- |
Модель поперечного сшивания рецепторов |
|||
единение специфического антигена к IgE, фик- |
при активации тучных клеток и базофилов |
|||
сированному на клетке. |
|
рождает ряд интересных вопросов. Во-первых, |
||
Не активируют клетку и одновалентные |
если мембрана жидкая и Fc-e-рецепторы дви- |
|||
антигены: выделение гистамина и других фар- |
гаются в ней свободно, то предусматривается |
|||
макологически |
активных веществ происходит |
(моделью) определенная частота рецепторных |
||
только под действием бивалентных и много- |
событий, которые могут быть соотнесены со |
|||
Мембранатучной клетки
Поперечное сшивание
Рис. 8. Различные способы поперечного
сшивания Fсe-рецепторов тучных клеток Антитело или базофилов.
Тучные клетки и базофильные лейкоциты |
21 |
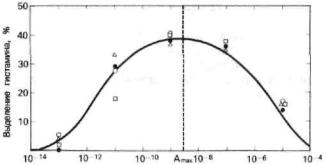
Рис. 9. Зависимость «концентрация-эффект» для выделения гистамина базофилами под действием бивалентного бензилпенициллоилового гаптена (БП02).
Базофилы несут IgE-антитела к БПО. Следует отметить что выделение гистамина после достижения максимума снижается при более высоких концентрациях гаптена
[Dembo и соавт.-J. Immunol., 1978, 121, 354]. |
|
|
|
Концентрация бивалентного гаптена (М) |
|
|||||||||
спонтанным выделением гистамина, что наб- |
секреции |
гистамина |
количеству |
поперечных |
||||||||||
людается как у тучных клеток, так и у базо- |
сшивок согласуется не со всеми фактами; в ряде |
|||||||||||||
филов. Во-вторых, какова связь между обра- |
ситуаций картина представляется гораздо более |
|||||||||||||
зованием поперечных связей и клеточной ак- |
сложной. Во-первых, базофилы некоторых |
|||||||||||||
тивацией, оцениваемой по секреции гистамина? |
людей неспособны выделять гистамин, несмотря |
|||||||||||||
На рис. 9 показана кривая доза-ответ для |
на образование поперечных сшивок (см. ниже). |
|||||||||||||
гистамина, выделяемого базофилами при их |
Это может быть связано с отсутствием |
|||||||||||||
стимуляции двухвалентным гаптеном бензил- |
сопряжения Fc-рецепторов со вторичными |
|||||||||||||
пенициллоилом (БПО)2. Гаптен является двух- |
посредниками (они будут описаны ниже), |
|||||||||||||
валентным, а базофилы несут IgE к гаптену |
которые необходимы для переноса информации |
|||||||||||||
БПО. Так как на каждой молекуле IgE су- |
от поперечного сшивания к секреторным |
|||||||||||||
ществует два места для распознавания антигена |
процессам. Во-вторых, количественные и |
|||||||||||||
(см. главу 1), то антитело взаимодействует с |
качественные |
характеристики |
|
выделения |
||||||||||
двумя группами БПО. По мере повышения |
гистамина различаются в зависимости от типа |
|||||||||||||
концентрации |
(БПО)2 |
|
увеличивается |
лиганда, вызывающего образование поперечных |
||||||||||
количество поперечных связей между молеку- |
сшивок. Например, хотя димеры IgE, вы- |
|||||||||||||
лами IgE, причем они имеют вид IgE БПО-БПО |
зывающие |
образование поперечных |
сшивок |
|||||||||||
• IgE. Увеличению количества поперечных |
только двух Fc-6-рецепторов, представляются |
|||||||||||||
связей соответствует усиление ответа клеток, |
достаточным сигналом к клеточной активации, |
|||||||||||||
но до определенного максимума, поскольку |
тримеры и более высокие олигомеры иммуно- |
|||||||||||||
количество IgE, фиксированного клеткой, ог- |
глобулина служат более эффективным сигналом |
|||||||||||||
раничено. |
Если |
повышение |
концентрации |
для тучных клеток и базофилов. Антигены и |
||||||||||
(БПО)2 |
продолжается, то выделение гистамина |
анти-IgE способны образовывать мультире- |
||||||||||||
снижается вследствие уменьшения количества |
цепторные агрегаты. В настоящее время связь |
|||||||||||||
поперечных связей при избытке (БПО)2. При- |
между размером рецепторного агрегата и выз- |
|||||||||||||
чина заключается в том, что вместо перекрест- |
ванным им ответом определена неточно, однако |
|||||||||||||
ных связей типа IgE-БПО-БПО-IgE в условиях |
имеются указания на наличие влияния размера |
|||||||||||||
избытка (БПО)2 |
образуются связи типа IgE- |
агрегата. У тучных клеток крыс время |
||||||||||||
БПО-БПО, которые не вызывают секреции |
инактивации, вызванной поливалентным анти- |
|||||||||||||
гистамина. |
Термодинамическая |
модель |
геном овальбумином, невелико (tj/2 |
= 300 с), а |
||||||||||
связывания IgE-(BnO)2 может быть создана, что |
время полужизни инактивации после стиму- |
|||||||||||||
четко |
соответствует |
экспериментальным |
ляции димером IgE и анти-IgE составляет 1000 и |
|||||||||||
данным и свидетельствует в пользу концепции |
3500 с соответственно. Видимо, скорость |
|||||||||||||
о пропорциональности секреции гистамина ко- |
инактивации |
определяется размером |
агрегатов |
|||||||||||
личеству образовавшихся поперечных сшивок. |
IgE, |
образующихся |
при |
использовании |
||||||||||
Минимальным сигналом к активации тучных |
конкретного лиганда. Более того, показаны |
|||||||||||||
клеток служит простое двухмерное связывание |
различия |
в |
медикаментозном |
подавлении |
||||||||||
двух IgE-рецепторов (см. рис. 8). |
|
|
секреции гистамина, вызванной антигеном, и |
|||||||||||
Однако концепция о пропорциональности |
секреции гистамина, индуцированной анти-IgE. |
|||||||||||||
3-1134 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 Глава 2
Секрециягистамина
В этом разделе рассматриваются основные этапы активации тучных клеток и базофилов, которая происходит после поперечного сшивания Fc-e-рецепторов и приводит к секреции гистамина.
Кальций
Секреция гистамина тучными клетками и базофилами после антигенной стимуляции зависит от наличия внеклеточного кальция. Оптимальная концентрация кальция-1 мМ. Определенная секреция гистамина наблюдается в отсутствие внеклеточного кальция при стимуляции тучных клеток антигеном и не подавляется хелатами (веществами, связывающими кальций), такими как EDTA (этилендиаминтетрауксусная кислота) или EGTA [ди- (2-аминоэтокси)-этантетрауксусная кислота].
Зависимость от кальция антигениндуцированного выброса гистамина можно сравнить с участием кальция в сопряжении мембранного возбуждения с мышечным сокращением. Получен ряд данных, которые в своей совокупности свидетельствуют в пользу гипотезы о повышении уровня свободного кальция в цитозоле при агрегации FC-e-рецепторов; увеличение же концентрации кальция в тучных клетках приводит к возрастанию секреции гистамина.
Кальциевый ионофор А23187 может быть использован для переноса иона из внешней среды с высокой концентрацией кальция (1 мМ) внутрь клетки, где концентрация иона низка (0,1 мкМ); таким образом, его внутриклеточная концентрация повышается. В тучных клетках и базофилах А23187 вызывает кальцийзависимую секрецию гистамина. Сходные результаты получены при использовании другого ионофора, иономицина, что подтверждает роль вхождения кальция в тучные клетки и базофилы при индукции секреции гистамина. В клетках, стимулированных антигеном, ионофоры могут вызвать ограниченную секрецию гистамина и в отсутствие внеклеточного кальция. Это объясняется высвобождением кальция из внутренних депо тучных клеток и базофилов.
С помощью химических методов можно повысить проницаемость клеточных мембран для ионов и небольших молекул. После этого концентрацию внутриклеточного кальция можно контролировать извне кальциевыми буфер-
ными растворами. При использовании такого экспериментального подхода было показано, что секреция гистамина индуцируется возрастанием уровня внутриклеточного кальция с 0,1 мкМ до 1 мкМ.
Более прямые доказательства роли внутриклеточного кальция в активации тучных клеток были получены при введении кальция внутрь клеток через микропипетки. При этом отмечалась дегрануляция тучных клеток, но не определялась секреция гистамина. Слияние тучных клеток с липосомами или фосфолипидными комплексами, нагруженными кальцием, приводило к повышению уровня внутриклеточного кальция и секреции гистамина.
Таким образом, полученные данные свидетельствуют о том, что искусственное повышение концентрации кальция в тучных клетках вызывает секрецию гистамина. Следующий вопрос таков: обусловлена ли секреция гистамина поперечным сшиванием Fc-e-рецеп- торов, которое приводит к повышению внутриклеточного уровня кальция? Как уже отмечалось, для индуцированной антигеном секреции гистамина требуется внеклеточный кальций. Поперечное сшивание Fc-e-рецепторов приводит к повышению проницаемости мембраны для кальция, который движется в клетку по градиенту концентрации. Известно, что редкоземельный элемент лантан блокирует кальциевые каналы мембраны. Лантан и другие редкоземельные элементы подавляют секрецию гистамина, причем это подавление отменяется при увеличении концентрации внеклеточного кальция. Вероятно, антигенная стимуляция обусловливает открытие кальциевых каналов мембран тучных клеток и базофилов, которые блокируются лантаном. Следовательно, поперечное сшивание Fc-e-рецепторов открывает кальциевые каналы; поэтому существует возможность определения движения кальция внутрь клетки. Действительно, поток радиоактивного кальция [45Са] через мембраны тучных клеток при поперечном сшивании Fc-e- рецепторов гораздо выше, чем в покоящихся клетках. Другими словами, агрегация рецепторов вызывает увеличение проницаемости мембран тучных клеток для кальция. Применение флюоресцентных индикаторов кальция, таких как quin и fura, позволяет определить временные и количественные изменения концентрации внутриклеточного свободного кальция [Ca2+]i вследствие агрегации Fc-e-рецепторов. Уровень [Са2+]i составляющий в покое 100 нМ, при агрегации рецеп-
|
|
|
|
|
Тучные клетки и базофильные лейкоциты |
23 |
||
торов возрастает до 1,2 мкМ; это увеличение |
контролем кальция находятся многие метабо- |
|||||||
зависит от внеклеточного кальция и блоки- |
лические процессы клетки, поэтому его уровень |
|||||||
руется лантаном. В экспериментах с индика- |
в большинстве клеток постоянно под- |
|||||||
торами внутриклеточного кальция показано, |
держивается. Ионофор А23187 совместно с |
|||||||
что после стимуляции увеличение [Ca2+]i |
кальцием вызывает 100% выделение гистамина |
|||||||
обусловлено (отчасти) высвобождением иона из |
из клеток. Такая величина секреции редко |
|||||||
внутриклеточного депо, поскольку оно |
достигается при поперечном сшивании Fc-e- |
|||||||
наблюдается и при отсутствии внеклеточного |
рецепторов. Возможной причиной ограничения |
|||||||
кальция. |
|
|
|
|
выделения гистамина в этом случае является |
|||
Несмотря на все доказательства входа |
наличие |
различных лимитирующих секрецию |
||||||
кальция в тучные клетки и базофилы, сти- |
механизмов: нормализация мембранной про- |
|||||||
мулированные поперечным сшиванием Fc-e- |
ницаемости, секвестрация и удаление кальция, |
|||||||
рецепторов, |
электрофизиологические |
методы |
высвобождающегося в ходе секреторного про- |
|||||
не обнаруживают наличия кальциевого канала, |
цесса в клетках. |
|
|
|||||
управляемого рецептором. При поперечном |
При стимуляции рецепторов тучных клеток |
|||||||
сшивании рецепторов выявляется деполяриза- |
и базофилов в бескальциевой среде выделяется |
|||||||
ция мембран, однако она не сопровождается |
небольшое количество гистамина. При добав- |
|||||||
секреторным ответом. Антагонисты кальция, в |
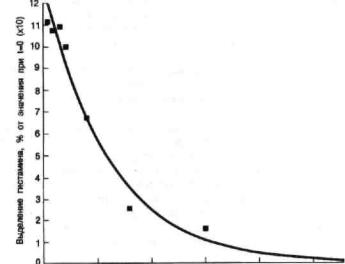
лении кальция в разное время после рецептор- |
|||||||
определенных концентрациях |
блокирующие |
ного взаимодействия секреция быстро умень- |
||||||
потенциалзависимые кальциевые каналы, не |
шается при увеличении интервала времени |
|||||||
подавляют секрецию гистамина. Однако не- |
между образованием перекрестных связей и |
|||||||
смотря на эти отрицательные данные, в пользу |
добавлением кальция (рис. 10). Такая инакти- |
|||||||
гипотезы свидетельствует обнаружение выде- |
вация клеток, называемая десенситизацией, |
|||||||
ляемого из клеток RBL белка, который об- |
возникает в результате развития устойчивости |
|||||||
ладает свойствами кальциевого канала, управ- |
клеток, стимулированных оптимальной кон- |
|||||||
ляемого Fc-8-рецептором. Этот белок, связы- |
центрацией антигена в бескальциевой среде, ко |
|||||||
вающий хромогликат, описан в главе 23. Таким |
второй антигенной стимуляции в среде, со- |
|||||||
образом, возникает парадокс, объяснить |
держащей кальций. Однако эти клетки остаются |
|||||||
который можно двояко: либо мы пока не- |
чувствительными к ионофорам, что сви- |
|||||||
способны определить кальциевые каналы, либо |
детельствует о связи рефрактерности, вызван- |
|||||||
каналов нет, а существуют другие причины |
ной антигеном, с уменьшением мембранной |
|||||||
того, что изменения [Са2+ ]; после стимуляции |
проницаемости для кальция. Прямые измерения |
|||||||
зависят от внеклеточного кальция. Возможным |
потока |
радиоактивного |
кальция |
[45Са] |
||||
объяснением |
может |
служить |
наличие |
показывают повышение проницаемости кле- |
||||
кальциевого переносчика, управляемого ре- |
точных мембран тучных клеток после попе- |
|||||||
цептором. |
|
|
|
|
речного сшивания Fc-e-рецепторов с последу- |
|||
В настоящее время неизвестно, каким об- |
ющим возвращением к исходному состоянию. |
|||||||
разом кальций участвует в процессе секреции. |
Время снижения клеточной проницаемости на |
|||||||
Имеются данные о зависимости секреции ги- |
50% составляет около 5 мин. Таким образом, |
|||||||
стамина от кальмодулина - белка, связыва- |
тучные клетки и базофилы ограничивают свою |
|||||||
ющего внутриклеточный кальций. Вероятно, |
секреторную активность только за счет вре- |
|||||||
кальцийкальмодулин активирует киназу (см. |
менного повышения кальциевой проницаемости |
|||||||
ниже) и другие ферменты, инициирующие сек- |
после перекрестного связывания рецепторов. |
|||||||
рецию. |
|
|
|
|
При |
исследовании инактивации |
тучных |
|
|
|
|
|
|
клеток, несущих IgE к двум различным анти- |
|||
Инактивация секреторного процесса |
|
генам, выявлено, что рефрактерность, возни- |
||||||
После обсуждения роли увеличения концент- |
кающая после образования перекрестных связей |
|||||||
рецепторов первым антигеном, не уменьшает |
||||||||
рации свободного внутриклеточного кальция в |
ответа на второй. Инактивация специфична |
|||||||
сопряжении |
процессов |
поперечного сшивания |
только для поперечно сшитых рецепторов. |
|||||
Fc-e-рецепторов и секреции гистамина необ- |
Однако это справедливо при поперечном |
|||||||
ходимо рассмотреть вопросы кальциевого го- |
сшивании лишь небольшой фракции Fc-e- |
|||||||
меостаза. При обработке клеток кальциевыми |
рецепторов. При агрегации большой фракции |
|||||||
ионофорами |
вхождение кальция становится |
Fc-e-рецепторов клетка становится нечувстви- |
||||||
неконтролируемым, и |
клетки |
гибнут. Под |
|
|
|
|
||
'*
24 Глава 2
Рис. 10. Инактивация тучных клеток.
Клетки, стимулированные в нулевое время комплексом антиген-антитело, не способны выделять гистамин даже в присутствии внеклеточного кальция. Выделение гистамина уменьшается при увеличении интервала времени между стимуляцией и добавлением кальция. Вероятно, эта инактивация связана с закрытием кальциевых каналов.
5 |
10 |
15 |
20 |
25 |
30 |
Время (в минутах) между стимуляцией и добавлением Са2*
тельной к эффектам связывания остальных ре- |
даны лишь частично или не даны совсем. |
|||
цепторов. Смысл неспецифической инактивации |
В этой связи следует также отметить су- |
|||
неясен, но предполагается, что количество |
ществование клеточных механизмов, предназ- |
|||
мембранных кальциевых каналов, доступных |
наченных не только для прерывания каль- |
|||
для управления рецепторами, ограничено, при- |
циевого сигнала, но и для ограничения секреции |
|||
чем число рецепторов превышает количество |
гистамина. Это предположение основывается на |
|||
каналов. Таким образом, при поперечном |
следующем наблюдении: кальциевый сигнал |
|||
сшивании большой фракции рецепторов, когда |
пропорционален количеству поперечно сшитых |
|||
открыты и инактивированы все кальциевые |
IgE-рецепторов, а секреторный ответ достигает |
|||
каналы, агрегация оставшихся рецепторов не- |
своего максимума (обычно меньше объема |
|||
способна вызвать ответ из-за отсутствия до- |
полной секреции), когда перекрестно связана |
|||
ступных каналов. Прямых доказательств этой |
относительно небольшая часть рецепторов. |
|||
гипотезы пока нет, и основанием для нее служит |
Метаболизмфосфолипидов |
|
||
неконкретизированное |
предположение |
о |
|
|
необратимости инактивации кальциевых кана- |
|
|
||
лов или крайне низкой скорости восстановления |
Обмен фосфатидилинозитола |
|
||
инактивированных каналов. |
|
В последние годы повышенное внимание уде- |
||
В том же контексте следует рассмотреть и |
||||
другое положение относительно кальция и |
ляется мембранным фосфолипидам |
тучных |
||
клеточного ответа. Выше уже упоминалось о |
клеток, а также возможной роли их изменений |
|||
существовании определенной популяции лиц с |
при сопряжении Fc-e-рецепторов с секрецией |
|||
базофилами, не выделяющими гистамин. Такие |
гистамина. В настоящее время получены четкие |
|||
базофилы имеют обычный набор IgE-pe- |
доказательства того, что различные фос- |
|||
цепторов, но даже полное сшивание этих ре- |
фолипидные метаболиты инозитола |
являются |
||
цепторов не приводит к секреции. Получены |
вторичными мессенджерами в процессе пере- |
|||
косвенные доказательства несопряженности |
дачи сигнала. В первых исследованиях на туч- |
|||
IgE-рецепторов и кальциевых каналов. Таким |
ных клетках, где проводилось измерение |
|||
образом, хотя увеличение концентрации сво- |
включений 32Р- или [3Н]-инозитола в фосфати- |
|||
бодных ионов кальция в тучных клетках и |
дилинозитол, фосфатидилхолин и др., было |
|||
базофилах, видимо, вызывает секрецию, ответы |
установлено, что стимуляция тучных клеток |
|||
на многие вопросы, касающиеся взаимосвязи |
поперечным сшиванием Fc-e-рецепторов при- |
|||
Fc-e-рецепторов и кальциевых каналов. |
|
|
|
|
Тучные клетки и базофилъные лейкоциты |
25 |
водит к распаду фосфатидилинозитола. Кривые доза-эффект, а также временные характеристики процессов обмена фосфатидилинозитола и стимулированной секреции гистамина тесно коррелируют.
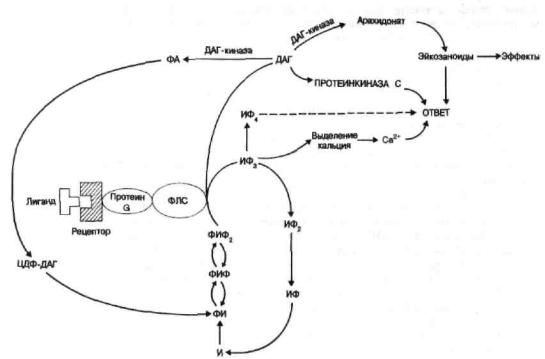
Благодаря этим исследованиям наши знания о метаболизме фосфоинозитида в клетках значительно расширились; схема метаболизма представлена на рис. 11. Фосфатидилинозитол является мембранным фосфолипидом, который под действием АТФ-зависимой специфической киназы превращается в 4-монофосфат и 4,5- дифосфат (ФИФ2). Стимуляция мембранного рецептора активирует фосфолипазу С, вероятно, через ГТФ-связывающий регуляторный белок. Фосфолипаза С превращает ФИФ2 в инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол. ИФ3 быстро распадается, превращаясь в инозитол-1,4-дифосфат (ИФ2). Как показывают недавно полученные данные, в некоторых системах ИФ2 вызывает высвобождение кальция из внутриклеточных депо, а
диацилглицерол активирует фермент протеинкиназу С. Таким образом, инициированный стимуляцией рецепторов обмен фосфоинозитида приводит к повышению уровня внутриклеточного кальция и активации протеинкиназы С. В ряде клеток наблюдается синергизм кальциевого сигнала и активности протеинкиназы С при осуществлении специфического ответа клетки.
Что же служит доказательством участия этих механизмов в передаче сигнала от поперечно сшитых Fc-e-рецепторов к механизмам секреции гистамина? Недавние исследования, выполненные на клеточной линии крысиного базофильного лейкоза (RBL), подтвердили ранее полученные данные о стимуляции обмена фосфатидилинозитола при поперечном сшивании Fc-e-рецепторов, а также о пропорциональности скорости гидролиза инозитолового фосфолипида количеству образовавшихся поперечных сшивок. Однако, помимо увеличения продукции ИФ2 и ИФ3, отмечается по-
Рис. 11. Метаболизм фосфоинозитида в клетках.
И-инозитол; ФА - фосфатидиловая кислота; ДАГ-диацилглицерол; ЦДФ-ДАГ- цитидиндифосфодиацилглицерол; ФЛС-фосфолипаза С; ФИФ2 - фосфатидилинозитол-4,5-дифосфат; ФИФ- фосфатидилинозитол-4-фосфат; ФИ - фосфатидилинозитол; ИФ3- инозитол-1,4,5-трифосфат; ИФ2-инозитол-1,4-дифосфат; ИФ-инозитол-4-фосфат и инозитол-1-фосфат; ИФ4- инозитол-1,3,4,5- тетрафосфат.
26 |
Глава 2 |
|
|
|
|
|
|
|
|
|
вышенное |
образование других полифосфатов |
стимулов и достаточно выраженной секреции |
||||||||
инозитола, включая ИФ4, и пока неясно, какие |
гистамина. Синергизм наблюдается также |
|||||||||
из них участвуют (если это имеет место) в |
между ТФА (активация киназы С) и попереч- |
|||||||||
передаче сигнала. Другой проблемой является |
ным сшиванием Fc-e-рецепторов, однако он |
|||||||||
кальциевая |
зависимость |
фосфоинозитидного |
имеет более сложный характер, поскольку он |
|||||||
обмена. Как указывалось в ранних исследо- |
отмечается лишь при кратковременной экспо- |
|||||||||
ваниях, обмен фосфатидилинозитола в тучных |
зиции клеток с низкой концентрацией ТФА (3 |
|||||||||
клетках, стимулированных поперечным сши- |
нм). При более длительной экспозиции клеток с |
|||||||||
ванием Fc-e-рецепторов, не зависит от вне- |
30 нм ТФА сигнал, вызванный поперечным |
|||||||||
клеточного кальция. Этот момент весьма важен, |
сшиванием рецепторов, подавляется. Это |
|||||||||
ибо если фосфат инозитола предположительно |
свидетельствует о том, что в подобных условиях |
|||||||||
генерирует кальциевый сигнал (высвобождение |
ТФА подавляет кальциевый и, возможно, |
|||||||||
кальция ИФ3 из внутриклеточных депо), то |
инозитолфосфатный |
сигналы. |
Возможна |
|||||||
образование фосфата инозитола само по себе не |
неоднозначная интерпретация результатов этих |
|||||||||
должно зависеть от кальция. Однако недавние |
экспериментов: 1) протеинкиназа С способна |
|||||||||
исследования на клетках RBL показали, что |
как подавлять, так и стимулировать кальциевый |
|||||||||
гидролиз |
фосфолипидов инозитола после |
сигнал; 2) ТФА может действовать посредством |
||||||||
стимуляции клеток в значительной степени |
механизмов, отличных от активации киназы С. |
|||||||||
зависит от кальция и лишь в определенных |
|
|
|
|
|
|||||
условиях |
является |
кальцийнезависи-мым |
Метилирование фосфолипидов |
|
|
|||||
процессом. Стало быть, теперь не вполне ясно, |
Помимо изменения обмена мембранного фос- |
|||||||||
участвуют ли фосфаты инозитола в фор- |
||||||||||
мировании кальциевого сигнала в тучных |
фатидилинозитола при стимуляции в результате |
|||||||||
клетках и базофилах. Неясно также, какая форма |
поперечного |
сшивания |
Fc-e-рецепторов |
|||||||
фосфата |
инозитола |
является |
активной |
возможна инициация метилирования некоторых |
||||||
молекулой, если данный механизм действи- |
мембранных фосфатидов. Показано, что после |
|||||||||
тельно работает. Требует своего объяснения и |
образования поперечных сшивок между Fc-e- |
|||||||||
другой фактор-высокая степень зависимости |
рецепторами мембранный фосфатидилсе-рин |
|||||||||
секреции гистамина от внеклеточного кальция. |
декарбоксилируется, превращаясь в фос- |
|||||||||
Если, как отмечалось выше, источником |
фатидилэтаноламин. Мембраны содержат два |
|||||||||
увеличения [Са2+];, активирующего клетки, |
метилтрансферазных фермента, для которых |
|||||||||
служит внеклеточный кальций, то непонятно, |
кофактором является 8-аденозил-Ь-метионин. |
|||||||||
каким образом фосфаты инозитола индуцируют |
Одна из метилтрансфераз локализуется на |
|||||||||
вход внеклеточного кальция в клетку. В |
внутренней поверхности мембранного бислоя, а |
|||||||||
настоящее |
время |
единственно определенным |
вторая - на наружной. Первый фермент ме- |
|||||||
действием ИФ3, как сейчас полагают, является |
тилирует фосфатидилэтаноламин до фосфати- |
|||||||||
высвобождение внутриклеточного кальция. |
дил-1Ч-монометилэтаноламина, являющегося |
|||||||||
|
Не более ясна и роль протеинкиназы С, |
субстратом для второй метилтрансферазы, ко- |
||||||||
фермента, активируемого диацилглицеролом- |
торая во внешнем слое мембраны превращает |
|||||||||
продуктом распада ФИФ2. Диацилглицерол в |
его в фосфатидилхолин (рис. 12). Фосфатидил- |
|||||||||
качестве активатора протеинкиназы С может |
холин может служить субстратом для фосфо- |
|||||||||
быть заменен форболовым эфиром 12-0-тет- |
липазы А2, которая превращает его в лизо- |
|||||||||
радеканоилфорбол-13-ацетатом (ТФА). Сам по |
фосфатидилхолин и арахидоновую кислоту. |
|||||||||
себе ТФА вызывает очень медленное выделение |
Реакции метилирования предшествуют секреции |
|||||||||
гистамина из тучных клеток и практически не |
гистамина и по времени совпадают с входом |
|||||||||
влияет на гистаминовую секрецию RBL. |
кальция в тучные клетки. Кроме того, |
|||||||||
Следовательно, |
только |
одна |
активация |
ингибиторы |
метилтрансфераз |
предупреждают |
||||
протеинкиназы С не является достаточным |
секрецию гистамина и вход кальция в клетки, |
|||||||||
условием для запуска процесса секреции гис- |
хотя кривые «доза-эффект» для этих инги- |
|||||||||
тамина. Однако введение в клетку очень не- |
биторов не исключают возможности отсутствия |
|||||||||
большого |
количества кальция (с |
ионофором |
связи между угнетением метилтрансфераз-ной |
|||||||
А23187, не приводящим к секреции гистамина) |
активности, с одной стороны, и подавлением |
|||||||||
совместно с активацией протеинкиназы С, ин- |
секреции гистамина и движения кальция-с |
|||||||||
дуцированной ТФА, приводит к синергизму |
другой. Основная трудность здесь за- |
|
||||||||

Тучные клетки и базофильные лейкоциты |
27 |
Рис. 12. Образование фосфатидилхолина.
ФЛА2-фосфолипаза А2; ФЛС-фосфолипаза С; ФС-фосфатидилсерин; ФЭ-фосфатидилэтаноламин; ФХфосфатидилхолин; МТП-метилтрансфераза II; ДАГЛ - диацилглицерол-липаза; ФСД-фосфатидил серии декарбоксилаза, — — торможение, + — активация. Для наглядности показана раздельная активация перекрестным связыванием Fc-рецептора протеина G, имеющего отношение как к ФЛС, так и к аденилатциклазе. Это разные белки, но, вероятно, они активируются одним и тем же перекрестным связыванием.
ключается в понимании того, каким образом |
с (3-адренорецептором. Показано, что коклюш- |
||||
данная система генерирует сигнал для клетки, |
ный токсин, который тормозит активацию |
||||
поскольку все, казалось бы, свидетельствует в |
ферментов через ГТФ-связывающий белок, |
||||
пользу |
образования фосфатидилхолина во |
подавляет выделение гистамина из тучных |
|||
внешней части мембраны и в то же время сам |
клеток. |
Негидролизуемый |
аналог |
ГТФ, |
|
фосфолипид составляет значительную часть |
Gpp(NH)p, |
стимулирует выделение гистамина |
|||
мембраны. Имеются указания на возможность |
при его введении в проницаемые тучные клетки |
||||
увеличения подвижности мембраны, однако |
в присутствии кальция. Хотя ГТФ-регулятор- |
||||
это не дает решения вопроса относительно |
ный белок, участвующий в секреции гистамина, |
||||
механизма передачи сигнала. |
не был выделен, в пользу его существования |
||||
|
|
свидетельствуют данные |
эксперимента на |
||
|
|
крысиных базофильных лейкоцитах. Свойства |
|||
ГТФ-связывающие белки |
этого белка отличаются от свойств Ni и Ns ГТФ- |
||||
Как отмечалось выше, для превращения ФИФ2 |
регуляторных протеинов, участвующих в |
||||
сопряжении тормозящих и |
стимулирующих |
||||
в ИФ3 |
необходима активация фосфолипазы С, |
рецепторов с аденилатциклазой в других сис- |
|||
которая возможна при поперечном сшивании |
темах. Недавно было показано, что белок G |
||||
Fc-e-рецепторов через ГТФ-связывающий бе- |
тучных клеток, участвующих в процессе экзо- |
||||
лок по механизму, аналогичному активации |
цитоза (см. ниже), отличается от белка G, |
||||
аденилатциклазы при связывании Р-агониста |
активирующего фосфолипазу С. |
|
|||
28 |
Глава 2 |
|
|
|
|
|
|
|
|
|
|
|
Активацияпротеаз |
|
|
|
|
ПГЕ2; взаимодействие последнего с этими ре- |
|||||||
Помимо кальциевого и фосфолипидного мета- |
цепторами приводит к подавлению выделения |
|||||||||||
гистамина, стимулированного комплексом ан- |
||||||||||||
болизма, рассматриваемого в контексте пере- |
тигенIgE. Подавление секреции гистамина |
|||||||||||
дачи сигнала с рецептора на секреторный про- |
ПГЕ2 обсуждается ниже. |
|
|
|
||||||||
цесс, для полноты изложения необходимо ска- |
|
|
|
|
|
|
||||||
зать и об активации протеаз. Уже давно из- |
Циклическиенуклеотиды |
|
|
|
||||||||
вестно, что протеазы активируются при сти- |
|
|
|
|
|
|
||||||
муляции тучных клеток. Кроме того, протеазы |
Первоначальные наблюдения подавления ад- |
|||||||||||
вызывают секрецию гистамина. Ингибиторы |
реналином антигенстимулированной секреции в |
|||||||||||
протеаз подавляют секрецию гистамина, но |
легких были затем подтверждены на ба-зальных |
|||||||||||
только в случае их присутствия во время по- |
лейкоцитах человека. В последующие годы идеи |
|||||||||||
перечного сшивания Fc-e-рецепторов. Таким |
относительно роли циклических нуклеотидов в |
|||||||||||
образом, протеазы предположительно являются |
секреции гистамина развивались в разных |
|||||||||||
необходимым |
компонентом |
в |
процессе |
направлениях. Подавление секреции гистамина |
||||||||
секреции гистамина и активируются при по- |
в легких человека и морских свинок при |
|||||||||||
перечном сшивании Fc-e-рецепторов. Более то- |
активации |
р-адренорецепторов |
оказалось |
|||||||||
го, протеазы могут участвовать в активации |
недостоверным. Для подавления секреции в |
|||||||||||
секреции гистамина (см. выше). Однако, как и в |
базофилах |
требуются |
достаточно |
высокие |
||||||||
случае с фосфолипидным метилированием, |
концентрации изопреналина, а количественные |
|||||||||||
непонятно, каким образом протеазы активируют |
характеристики, например рА2, свидетельствуют |
|||||||||||
секреторный процесс. |
|
|
|
|
об отсутствии на них Р-адренорецепторов. С |
|||||||
|
|
|
|
|
|
|
другой |
стороны, |
хотя |
аго-нисты |
р- |
|
Продуктылипоксигеназы |
|
|
|
адренорецепторов не влияют на секрецию |
||||||||
|
|
|
|
|
|
|
гистамина тучными клетками (у крыс), |
|||||
Кроме гистамина, тучные клетки, стимулиро- |
применение [3Н]-дигидроалпренолола в ра- |
|||||||||||
ванные комплексом антиген-IgE, продуцируют |
диолигандном связывании показало наличие на |
|||||||||||
другие активные вещества, в том числе |
клетках р-адренорецепторов. |
|
|
|
||||||||
медленно действующее вещество анафилаксии |
Кроме агонистов р-адренорецепторов, дру- |
|||||||||||
(МДВ-А) и простагландины, особенно ПГD2. В |
гие вещества, повышающие уровень цикличе- |
|||||||||||
настоящее время МДВ-А идентифицировано как |
ского аденозин-3',5'-монофосфата, подавляют |
|||||||||||
смесь двух или более метаболитов арахи- |
секрецию гистамина, вызванную поперечным |
|||||||||||
доновой кислоты по липоксигеназному пути- |
сшиванием Fc-e-рецепторов. Отмечена актив- |
|||||||||||
лейкотриенов D4 и С4 |
(см. главу 10). Таким |
ность холерного эндотоксина, теофиллина, ди- |
||||||||||
образом, при активации мембранной фосфо- |
бутирила цАМФ и аденозинфосфоротиоат. |
|||||||||||
липазы А2 поперечным сшиванием Fc-e-рецеп- |
Теофиллин в высоких концентрациях (1 мМ) |
|||||||||||
торов |
может |
образовываться |
арахидоновая |
является ингибитором фосфодиэстеразы и, по- |
||||||||
кислота, которая превращается в nrD2 и лей- |
давляя ферментативное разрушение цАМФ, |
|||||||||||
котриены. Эти метаболиты, как и гистамин, |
вызывает повышение уровня внутриклеточного |
|||||||||||
опосредуют некоторые эффекты воспаления, но |
цАМФ. При более низких концентрациях (10 |
|||||||||||
в отличие от гистамина они не хранятся в клетке |
мкМ) теофиллин выступает как конкурентный |
|||||||||||
в готовом виде. Арахидоновая кислота может |
антагонист аденозина и подавляет секрецию |
|||||||||||
также |
образовываться |
при |
|
действии |
гистамина. В тучных клетках крыс и морских |
|||||||
диацилглицероллипазы |
на |
диацилглицерол, |
свинок |
аденозин |
потенцирует |
|
анти- |
|||||
продукт распада фосфатидилинозитола (см. рис. |
генстимулированное |
выделение гистамина. |
||||||||||
12). Препараты, подавляющие липоксиге-назу, |
Механизм этого усиления неизвестен, однако |
|||||||||||
такие |
как 5,8,11,14-эйкозатетраеновая |
кислота |
следует отметить существенную разницу между |
|||||||||
(ЭТЕК), угнетают и секрецию гистамина, |
тучными клетками и базофилами, поскольку в |
|||||||||||
поэтому, как полагают, продукты ли- |
базофилах аденозин, напротив, подавляет |
|||||||||||
поксигеназы могут не только выделяться (в |
секрецию гистамина. Было постулировано, что |
|||||||||||
качестве фармакологически активных веществ), |
аденозин участвует в патогенезе аллергических |
|||||||||||
но и участвовать в процессах, ведущих к секре- |
реакций, потенцируя секрецию гистамина; од- |
|||||||||||
ции гистамина. Ингибиторы циклооксигеназы |
нако в пользу этого положения представлены |
|||||||||||
не влияют на секрецию гистамина, но тучные |
достаточно скудные доказательства. |
|
|
|||||||||
клетки |
и базофилы имеют |
рецепторы для |
При прямых измерениях уровня цАМФ в |
|||||||||
