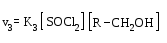- •Специфика органической химии
- •Теория гибридизации
- •Типы гибридных орбиталей
- •Первое валентное состояние атома углерода Гибридизация sp3
- •Мезомерный эффект (эффект сопряжения) [±m]
- •Понятие сопряжения
- •Эффекты сопряжения
- •Правило Морковникова
- •Донорно-акцепторные связи. Семиполярные связи
- •Водородная связь
- •Названия ненасыщенных и ароматических углеводородов
- •Номенклатура гетероциклических соединений
- •Номенклатура июпак для производных различных классов органических соединений
- •Изомерия органических соединений
- •Структурная изомерия
- •Изомерия положения
- •Геометрическая изомерия (зеркальная, цис- транс- изомерия)
- •Оптическая изомерия
- •Устройство поляриметра
- •Диастереомеры
- •Номенклатура стереоизомеров
- •Номенклатура Кана, Ингольда, Прелога (кип)
- •Номенклатура стереоизомеров Потапова в.М., Терентьева а.П. И сотрудников
- •2(Ρ),3-диоксипропаналь
- •3(Ρ),4-дихлорпентен-4-аль
- •Классификация органических реакций и реагентов
- •По способу разрыва (образования) химических связей.
- •Классификация реакций по типу превращений в органических веществах
- •Свободные радикалы
- •Понятие о граничных структурах
- •Алканы (парафины)
- •Физические свойства
- •Промышленная переработка алканов (нефти)
- •Некоторые лабораторные способы получения алканов
- •Нитрование алканов
- •Строение малых циклов (циклопропан, циклобутан)
- •Некоторые закономерности реакции отщепления
- •Дегидратация спиртов (отщепление воды)
- •Дегалогенирование дигалогенпроизводных
- •Восстановление алкинов (ацетиленов)
- •Расщепление четвертичных аммонийных солей по Гофману
- •Присоединение галогенов
- •Строение диенов
- •Химические свойства диенов
- •Реакции присоединения
- •Механизм реакции [ae] для сопряженных диенов
- •Некоторые аспекты применения сопряженных диенов
- •Алкины (ацетилены)
- •Способы получения ацетилена
- •Некоторые способы получения гомологов ацетилена
- •Общая характеристика реакционной способности ацетиленов
- •Физические свойства ацетилена
- •Химические свойства
- •Реакции присоединения
- •Реакции нуклеофильного присоединения к ацетиленам
- •Некоторые свойства виниловых эфиров
- •Ароматические углеводороды
- •Признаки ароматичности
- •Направление реакций ароматических соединений
- •II стадия:
- •Мнемоническое правилосмещения электронной плотности под действием заместителя в ядре
- •Нуклеофильное замещение в ароматических системах (snAr)
- •Механизм реакции snAr
- •Галогенпроизводные углеводородов
- •Методы получения галогенпроизводных
- •Замещение водорода на галоген в условиях радикальных процессов (прямое галогенирование алканов)
- •Галогенирование непредельных углеводородов
- •Получение галогенпроизводных из непредельных углеводородов
- •Общая характеристика реакционной способности галогенпроизводных
- •Важнейшие реакции галогенпроизводных
- •Образование металлорганических соединений
- •Содержание
Галогенпроизводные углеводородов
Методы получения галогенпроизводных
Замещение водорода на галоген в условиях радикальных процессов (прямое галогенирование алканов)
Реакции с хлором протекают очень бурно, неуправляемо, поэтому галогенируют только метан или этан.

Реакция протекает с выделением тепла порядка 29 ккал/моль.
Бромирование проводят при освещении и нагревании. Процесс более управляемый, т.к. легче замещается атом водорода у третичного углерода. Поэтому, в большем количестве образуются третичные галогенпроизводные.
Прямое йодирование алкенов не идет вследствие обратимости процесса:
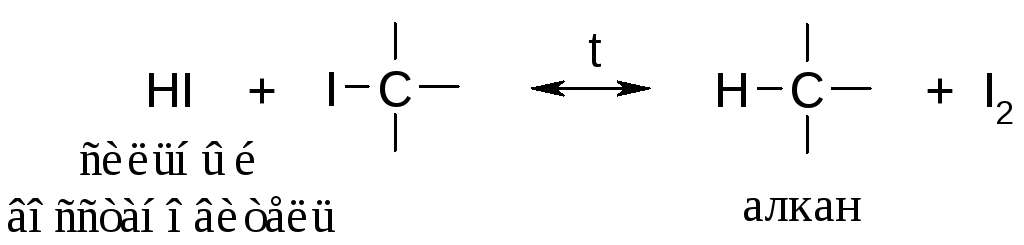
Прямое фторирование вообще не проводят, т.к. разрываются углерод-углеродные связи и образуется тетрафторметан CF4. Процесс носит названиефторонолиза; говорят, вещество горит во фторе.
Галогенирование непредельных углеводородов
При низких температурах галоген присоединяется к непредельным соединениям количественно:
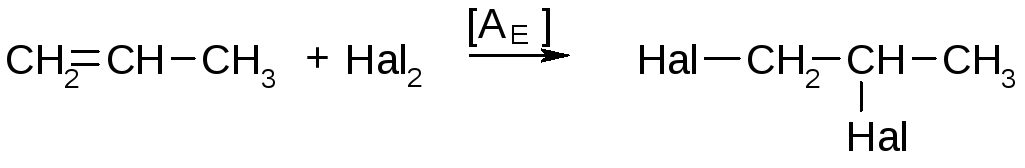
Hal=Cl,Br,I.
При повышенных температурах (450600С) реакция присоединения не идет, а идет реакция замещенияα-водородных атомов по радикальному механизму, например:
![]()
Разветвленные алкены реагируют при более низких температурах:
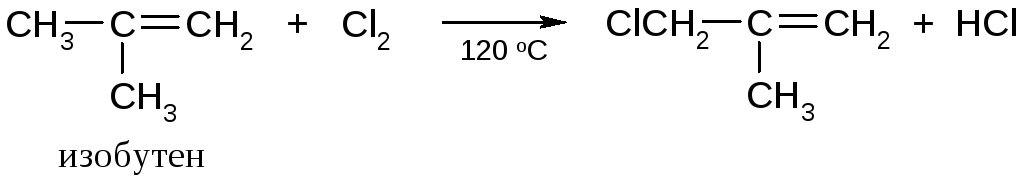
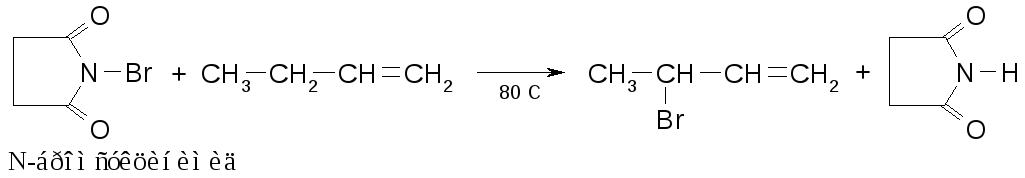
Бромирование по α-углеродному атому можно проводить N-галогенимидами дикарбоновых кислот:
Галогенирование ароматических соединений
Может протекать как в ядро, так и вбоковую цепь:
EMBED ISISServer

Реакция бромирования протекает по такому же типу при несколько более высоких температурах. Йодируют ароматические соединения в ядро [SEAr] с использованием специальных составов, содержащих катион йода:

Реакции по α-углеродному атому проводят у ароматических соединений при меньших температурах, чем у алканов (α-положение более реакционноспособно).
Получение ароматических галогенпроизводных из анилина и его производных
Разработал Зондмайер:

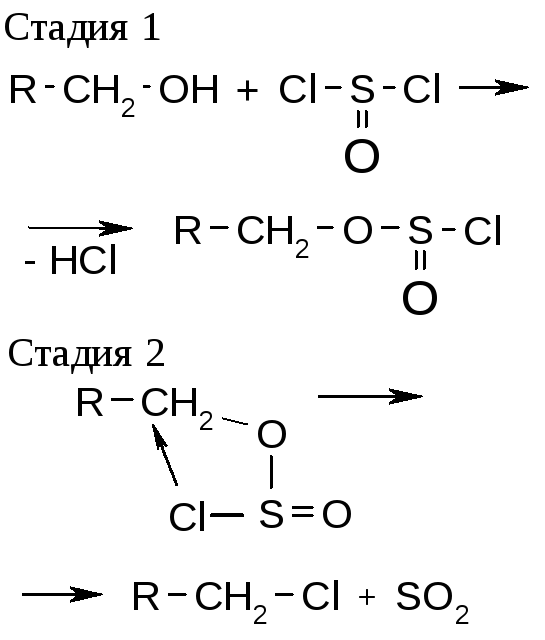
Получение галогенпроизводных из эфиров сульфокислот
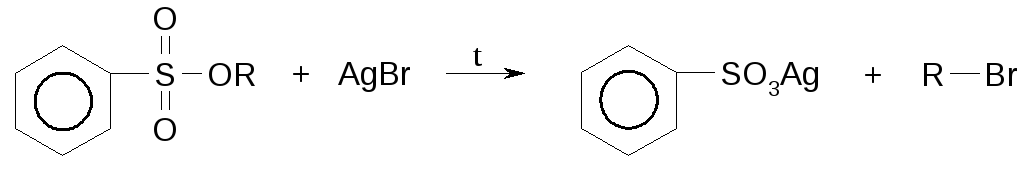
Обмен галогена на галоген
Филькештейн обнаружил, что в галогенпроизводных можно обменивать галогены, например:
![]()
Очень легко заместить на йодхлор или бром, т.к.йодистый натрийрастворим в ацетоне, аNaClилиNaBrне растворимы.
Легкость замещения галогена на галоген падает в ряду: I → Br → Cl.
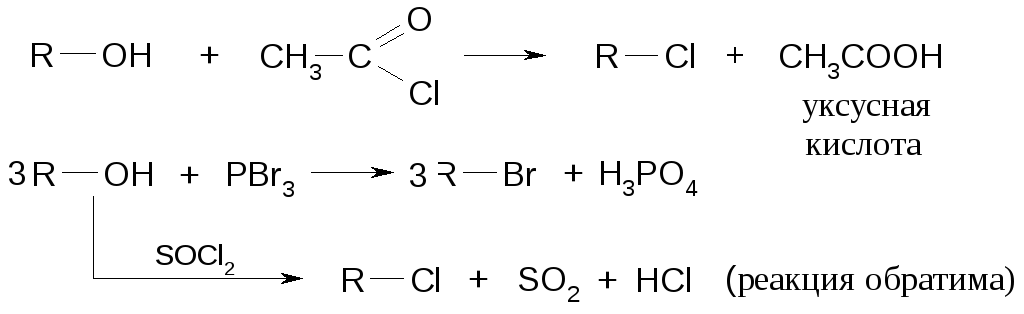
Замещение гидроксильных групп спиртов
При кипячении спиртов с концентрированными галогенводородными кислотами получают галогенпроизводные по обратимому процессу.
![]()
Легче идет реакция с HI, труднее сHCl.
Из спиртов наиболее реакционоспособны третичные.
В лабораторных условиях вместо концентрированных кислот используют галоген-ангидриды фосфорной или серной кислот и карбоновых кислот.
Закономерности реакций нуклеофильного замещения у насыщенного атома водорода
|
№ п/п |
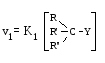
SN1мономолекулярный |
SN2 бимолекулярный |
SNi |
|
1. Механизм |
|
|
|
|
2. Кинетика |
Мономолекулярное замещение (скорость реакции зависит от концентрации одного компонента - субстрата) |
Бимолекулярное замещение (в кинетическом уравнении – концентрации и реагента и субстрата) |
Реакция характерна только для замещения гидроксильных групп спиртов. |
|
3. Стереохимия |
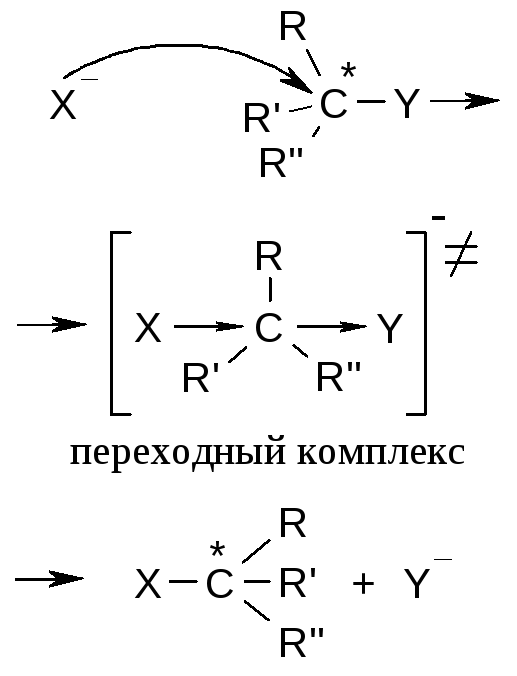
SN1правило: рацемизация (или частичное обращение конфигурации) |
SN2правило: обращение конфигурации (подход реагента с противоположной стороны по отношению к уходящей группе) |
SNiправило: полное сохранение конфигурации (атака со стороны уходящей группы) |
|
4. Влияние растворителя |
Реакция облегчается полярными растворителями, как нуклеофильного (вода, спирты), так и электрофильного характера: бензол с акцепторными группами
|
Умеренное влияние растворителя; реакции способствуют растворители, связывающие электрофильную часть молекулы (облегчают подход и уход заряженной частицы - апротонные, нуклеофильные растворители). Например, простые эфиры, нитрилы, амины. |
Растворители не влияют на скорость и стереохимию процесса. |
|
5. Влияние эффектов заместителей |
Относительно слабое влияние пространственных эффектов, но сильное влияние эффектов сопряжения C2H5 v=1 CH3Br v=0,8 (CH3)2CHBr v=11,6 (CH3)3CBr v=1,2·106 |
Преобладающее влияние пространственных эффектов
C2H5v=1 CH3Br v=145 (CH3)2CHBr v=0,078 (CH3)3CHBr v=0,00051 |
Слабое влияние пространственных эффектов, значительное влияние полярных эффектов |
|
Относительная скорость реакции |
При прочих равных условиях скорости реакций нуклеофильного замещения, как правило, уменьшаются в ряду: третичные > вторичные > первичные. | ||
|
6. Влияние характера замещающих групп |
Скорость реакции тем быстрее, чем беднее энергией уходящая группа (чем стабильнее уходящая группа). Это обусловлено энергией связи CYв первую очередь иCXво вторую очередь. Для галогенов самая богатая энергией группаClˉ, самая беднаяIˉ. | ||
|
7. Влияние характера реагентов |
Предпочтительнее реакция с более электроотрицательным реагентом, имеющим значительное сродство к электрону. |
Предпочтительнее реакция с более нуклеофильным реагентом (способность образовывать связи с атомом углерода нуклеофильность). |
Нет влияния |
|
8. Побочные реакции |
Отщепления по механизму E1, перегруппировки углеродного скелета |
Отщепления по механизму E2
|
Нет
|
Примечания:
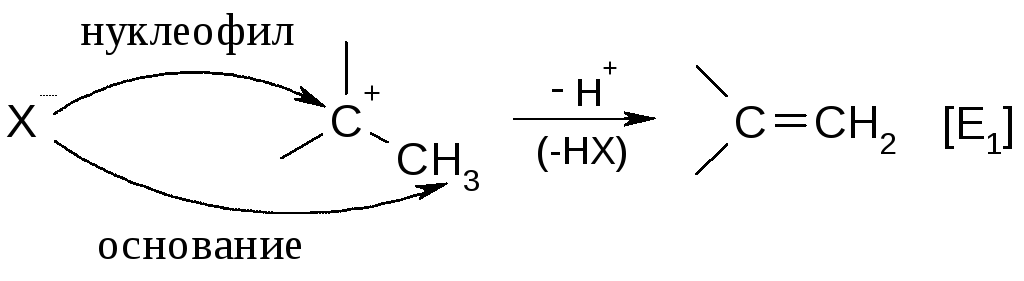
Как следует из графы 8 таблицы, реакции SNиEявляются конкурирующими. Например, после образования карбокатиона [SN1] возможны два пути дальнейшего процесса – образование продукта замещения (Х-нуклеофил), или продукта отщепления (Х-основание):
Подобная реакция возможна и по бимолекулярному механизму [SN2]:
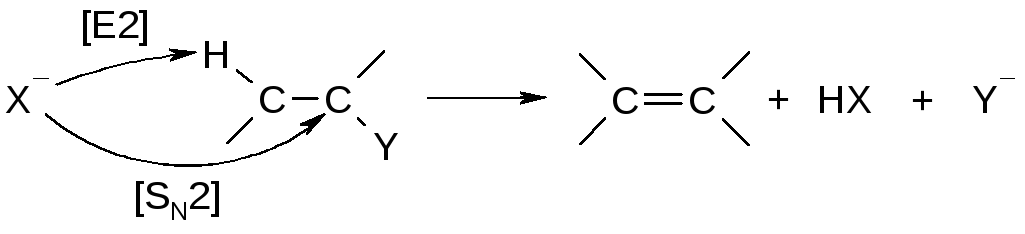
Для перегруппировки необходимо образование первичного или вторичного карбокатиона:
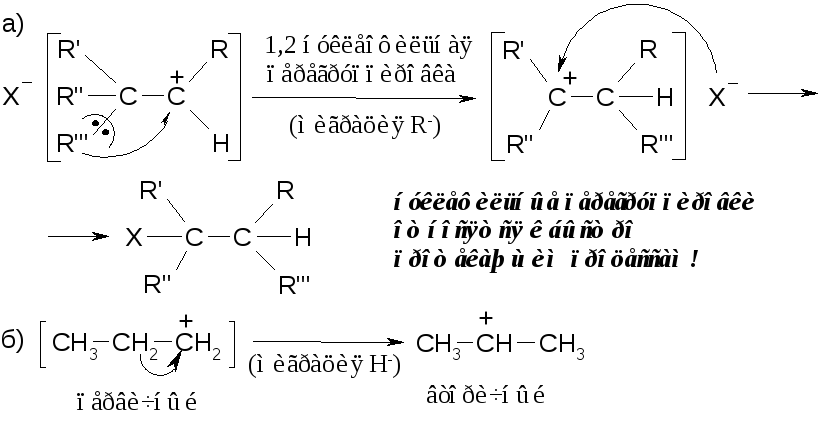
Практически нет реакций, которые бы протекали исключительно по одному из представленных механизмов SN1,SN2. Поэтому можно говорить лишь опреимущественномпротекании реакции по тому или иному механизму. Так, первичные производные реагируютв основном по механизмуSN2, третичныепо механизмуSN1, вторичныелибо поSN1, либо поSN2 (в зависимости от строения молекулы).