- •Специфика органической химии
- •Теория гибридизации
- •Типы гибридных орбиталей
- •Первое валентное состояние атома углерода Гибридизация sp3
- •Мезомерный эффект (эффект сопряжения) [±m]
- •Понятие сопряжения
- •Эффекты сопряжения
- •Правило Морковникова
- •Донорно-акцепторные связи. Семиполярные связи
- •Водородная связь
- •Названия ненасыщенных и ароматических углеводородов
- •Номенклатура гетероциклических соединений
- •Номенклатура июпак для производных различных классов органических соединений
- •Изомерия органических соединений
- •Структурная изомерия
- •Изомерия положения
- •Геометрическая изомерия (зеркальная, цис- транс- изомерия)
- •Оптическая изомерия
- •Устройство поляриметра
- •Диастереомеры
- •Номенклатура стереоизомеров
- •Номенклатура Кана, Ингольда, Прелога (кип)
- •Номенклатура стереоизомеров Потапова в.М., Терентьева а.П. И сотрудников
- •2(Ρ),3-диоксипропаналь
- •3(Ρ),4-дихлорпентен-4-аль
- •Классификация органических реакций и реагентов
- •По способу разрыва (образования) химических связей.
- •Классификация реакций по типу превращений в органических веществах
- •Свободные радикалы
- •Понятие о граничных структурах
- •Алканы (парафины)
- •Физические свойства
- •Промышленная переработка алканов (нефти)
- •Некоторые лабораторные способы получения алканов
- •Нитрование алканов
- •Строение малых циклов (циклопропан, циклобутан)
- •Некоторые закономерности реакции отщепления
- •Дегидратация спиртов (отщепление воды)
- •Дегалогенирование дигалогенпроизводных
- •Восстановление алкинов (ацетиленов)
- •Расщепление четвертичных аммонийных солей по Гофману
- •Присоединение галогенов
- •Строение диенов
- •Химические свойства диенов
- •Реакции присоединения
- •Механизм реакции [ae] для сопряженных диенов
- •Некоторые аспекты применения сопряженных диенов
- •Алкины (ацетилены)
- •Способы получения ацетилена
- •Некоторые способы получения гомологов ацетилена
- •Общая характеристика реакционной способности ацетиленов
- •Физические свойства ацетилена
- •Химические свойства
- •Реакции присоединения
- •Реакции нуклеофильного присоединения к ацетиленам
- •Некоторые свойства виниловых эфиров
- •Ароматические углеводороды
- •Признаки ароматичности
- •Направление реакций ароматических соединений
- •II стадия:
- •Мнемоническое правилосмещения электронной плотности под действием заместителя в ядре
- •Нуклеофильное замещение в ароматических системах (snAr)
- •Механизм реакции snAr
- •Галогенпроизводные углеводородов
- •Методы получения галогенпроизводных
- •Замещение водорода на галоген в условиях радикальных процессов (прямое галогенирование алканов)
- •Галогенирование непредельных углеводородов
- •Получение галогенпроизводных из непредельных углеводородов
- •Общая характеристика реакционной способности галогенпроизводных
- •Важнейшие реакции галогенпроизводных
- •Образование металлорганических соединений
- •Содержание
2(Ρ),3-диоксипропаналь
При замене одного заместителя на другой конфигурация асимметрического центра не меняется. Напрмер:
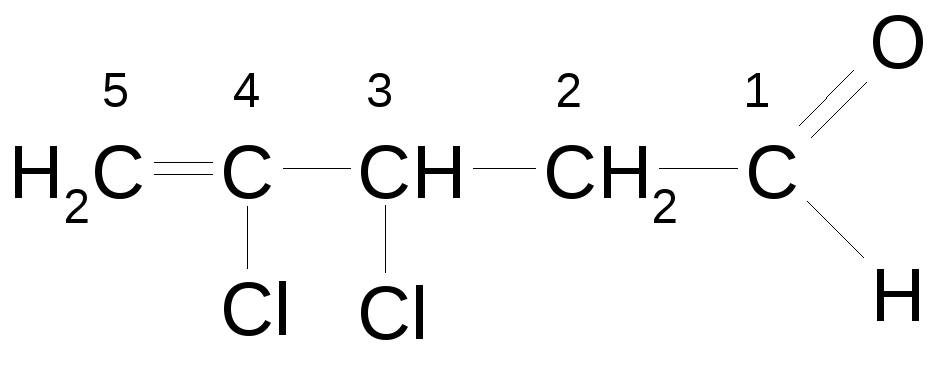
3,4-дихлорпентен-4-аль
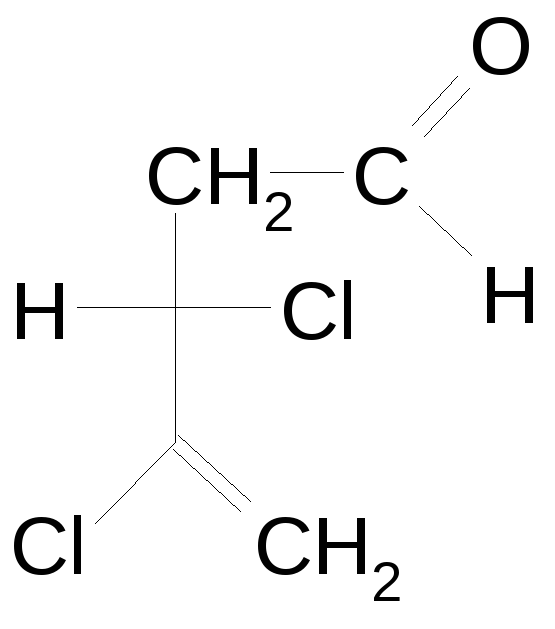
3(Ρ),4-дихлорпентен-4-аль
По номенклатуре КИП:
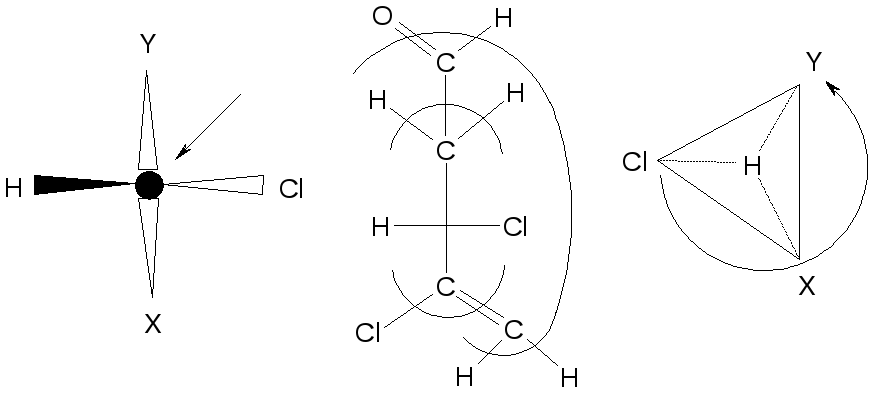
По горизонтали над плоскостью, по вертикализа плоскостью
I слой:Cl>XиY>H. ГдеX:CCl=CH2,Y:CH2CHO.
II слой:X>Y. Третий атом углерода имеетS-конфигурацию: 3(S)-3,4-дихлорпентен-4-аль.
Классификация органических реакций и реагентов
По способу разрыва (образования) химических связей.
Реакции подразделяются на радикальные и ионные (электрофильные и нуклеофильные).
а) Гомолитический разрыв связи.
Когда связь разрывается с образованием частиц с не спаренными электронами (радикалы).
Подобные реакции называются радикальными, обозначаются индексом [R].
![]()
б) Гетеролитический разрыв связи.
В зависимости от сродства к электрону и условий реакции связь может разрываться с образованием заряженных частиц (ионов):
![]()
В зависимости от природы частиц, реакции могут быть электрофильными (участвуют катионы или молекулы, несущие частичный положительный заряд ( δ+)),индекс[E], или нуклеофильными (участвуют анионы или атомы, несущие неподеленные пары электронов)индекс[N].
Нуклеофильными реакциями называют такие реакции, в котороых на ключевой стадии (самой медленной) происходит взаимодействие (атака) с участием нуклеофильных частиц:OH¯,SH¯,Hal¯,OR¯ и т.д., или нейтральных нуклеофилов:
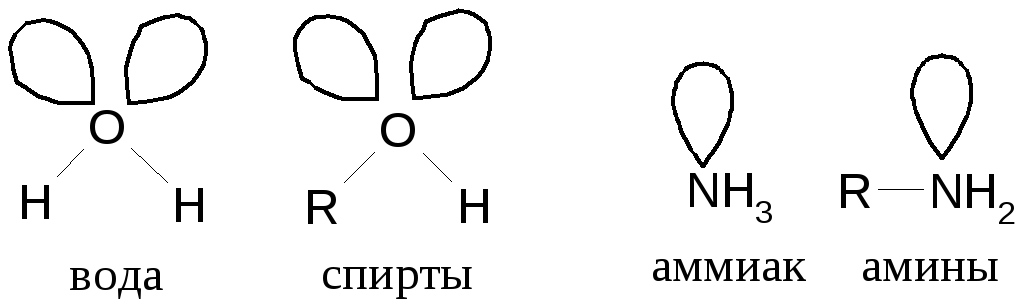 .
.
Соответственно, электрофильныминазывают реакции с участием электрофилов:NO2+(катион нитрония),H+(протон),SO3H+,Hal+, или нейтральных электрофиловкислот Льюиса:BF3,AlCl3,ZnCl2(галогены смещают электроны к себе, определяя частичныйδ+ на атомах бора, алюминия, цинка и т.д.).
■ В органической химии все реакции рассматривают относительно атома углерода.
Пример:
1-бромпропан (н-пропилбромид)
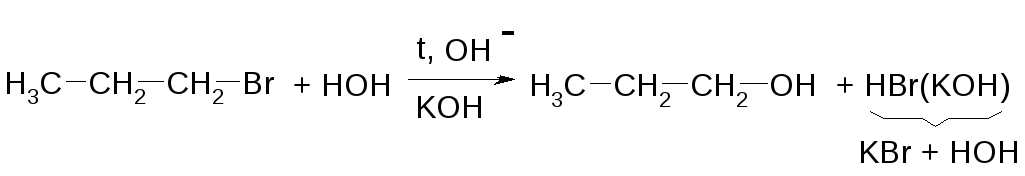
Реакция замещения, нуклеофильная[N] (анион гидроксила замещает анион брома).
Классификация реакций по типу превращений в органических веществах
Реакции замещения [S]
В алканах тип замещения радикальный.
В аренах (ароматических соединениях) тип замещения электрофильный. Например, нитрование бензола (реакция[SEAr]):
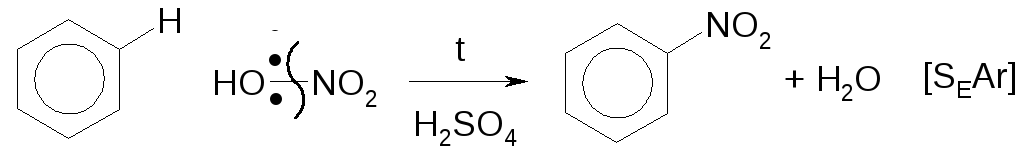
Катион нитрония NO2+замещает катион водородаH+(протон).
Реакции присоединения [A]
На примере алкенов:
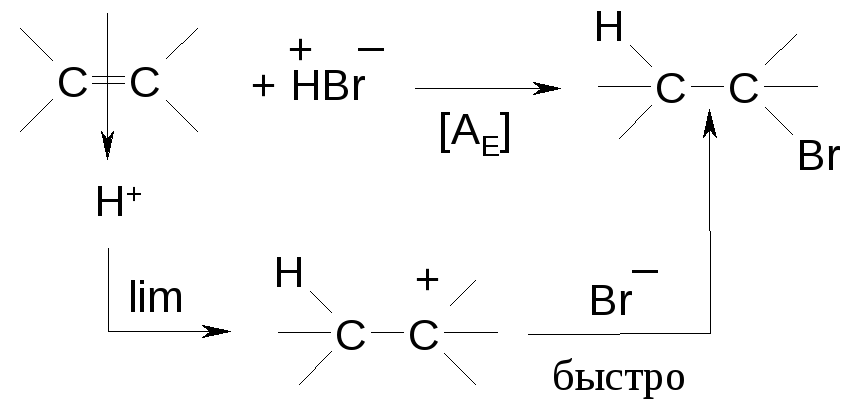
lim–лимитирующаястадия, определяет скорость всего процесса (то есть самая медленная стадия)
Реакции элиминирования (отщепления) [E]
Противоположны реакциям присоединения:
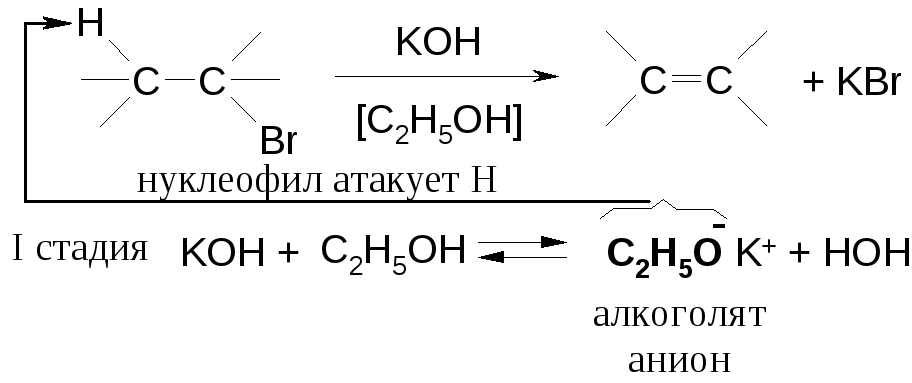
Все реакции элиминирования нуклеофильны.
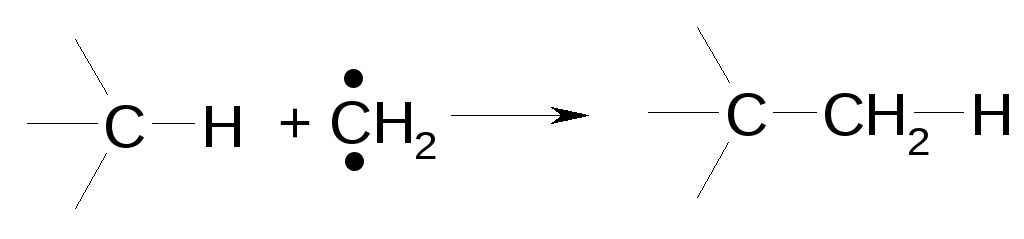
Реакции внедрения
В них участвуют частицы с высокой энергией
Пример:
Реакции перегруппировки
Подобные реакции протекают с изменением структуры молекулы путем перехода заместителя в другие положения основной цепи.
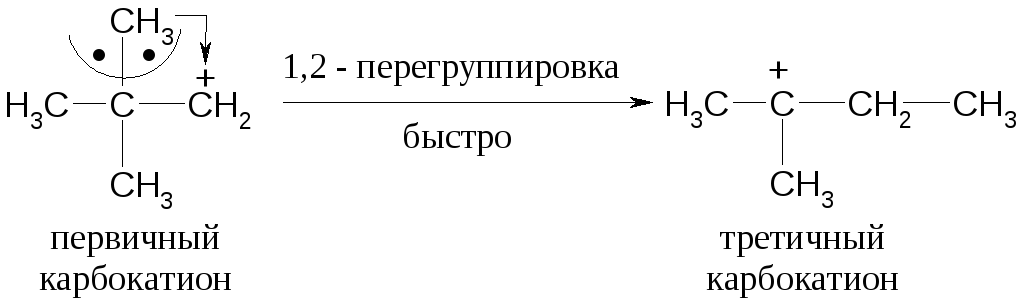
Перегруппировки проходят в сторону образования более устойчивых частиц (третичный карбокатион более устойчив чем первичный, вторичный).
В этом же порядке перегруппировываютсярадикалы: третичные > вторичные >
первичные >>CH3(самый неустойчивый).
этом же порядке перегруппировываютсярадикалы: третичные > вторичные >
первичные >>CH3(самый неустойчивый).
Реакции деградации (распада)
Протекают с расщеплением углерод-углеродных связей, напрмер, при крекинге:
![]()
Строение основных частиц в органической химии
Карбоанионы (карбанионы)
Углерод находится в состоянии sp3-гибридизации. Строение тетраэдрическое.
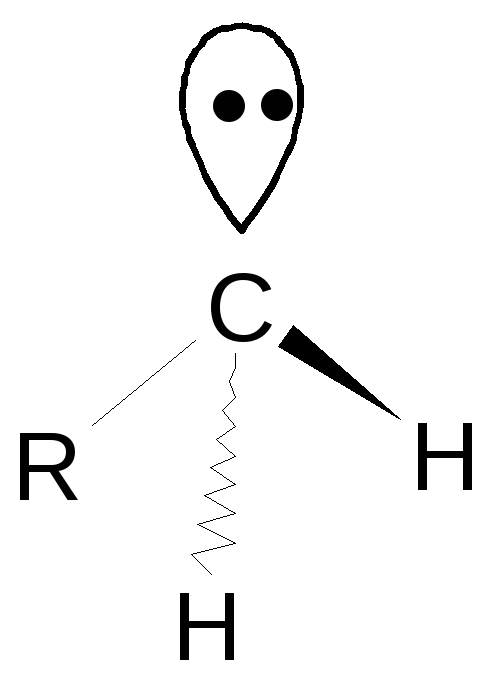
карбанион частица с «лишним» электроном (на углероде).
Карбанионы обладают различной степенью устойчивости, а, значит, и временем жизни. Чем большей энергией обладает частица, тем более она реакционоспособна и тем меньше время ее существования.
Устойчивость частиц уменьшается в ряду:
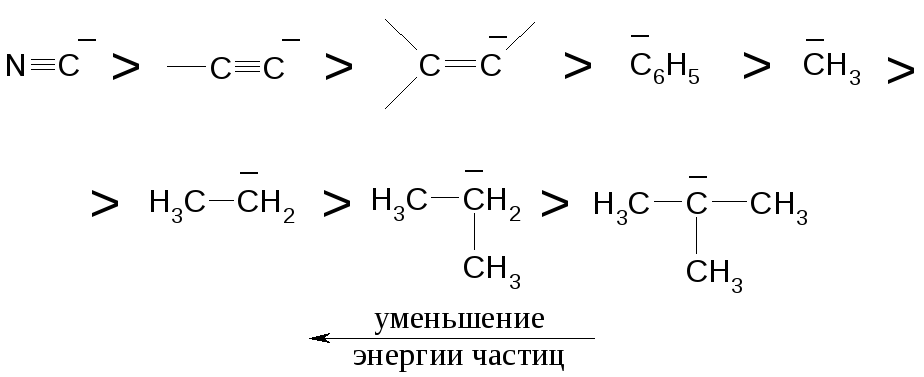
Карбокатионы
Считается, что частицы имеют строение, близкое к плоскостному (sp2-гибридное состояние атома углерода):
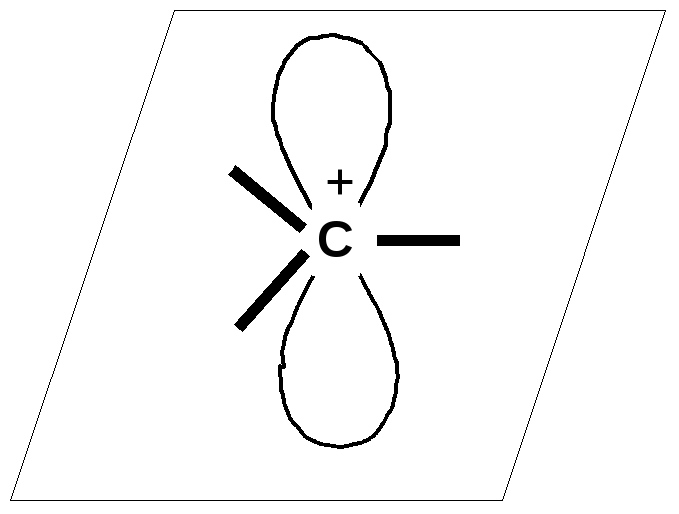
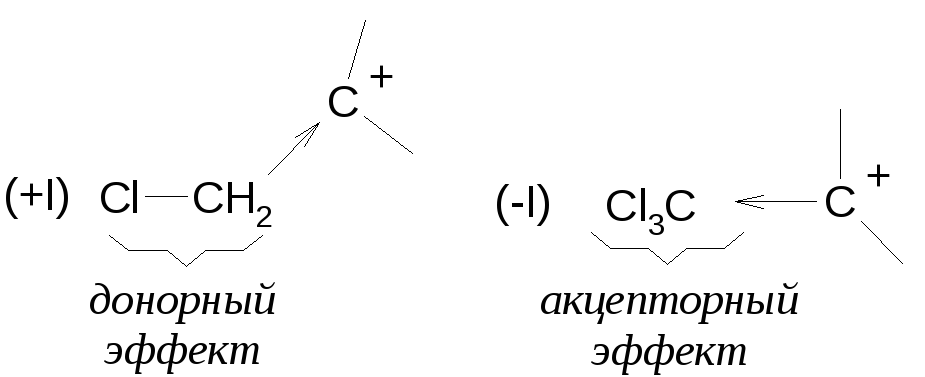
Устойчивость карбокатиона зависит от возможности распределения избыточного заряда по соседним группам и атомам. Из предельных карбокатионов наиболее устойчивы третичные, наименее первичные карбокатионы.
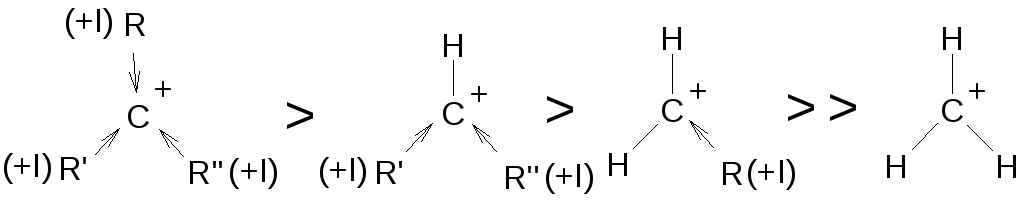
Примечание: индукционный (индуктивный) эффект может быть и отрицательным, если углерод связан с сильной акцепторной группой.
Пример: с галогеном
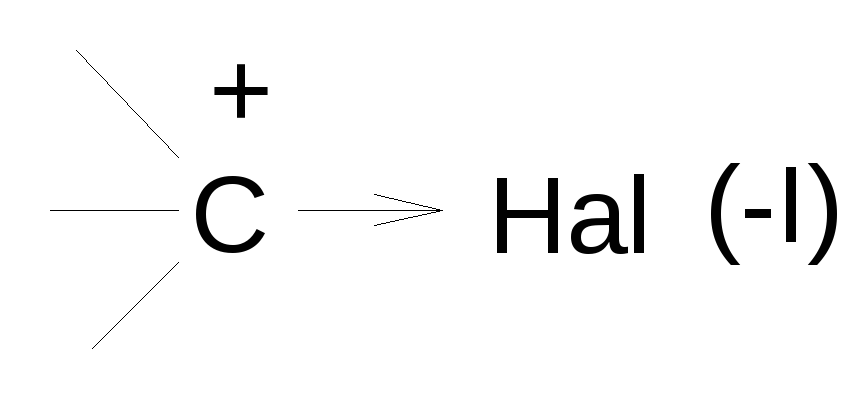
Однако если галоген находится в α-положении по отношению к карбокатиону, то общий эффект группы зависит от количества атомов галогена и может меняться от донорного к акцепторному: