
- •Специфика органической химии
- •Теория гибридизации
- •Типы гибридных орбиталей
- •Первое валентное состояние атома углерода Гибридизация sp3
- •Мезомерный эффект (эффект сопряжения) [±m]
- •Понятие сопряжения
- •Эффекты сопряжения
- •Правило Морковникова
- •Донорно-акцепторные связи. Семиполярные связи
- •Водородная связь
- •Названия ненасыщенных и ароматических углеводородов
- •Номенклатура гетероциклических соединений
- •Номенклатура июпак для производных различных классов органических соединений
- •Изомерия органических соединений
- •Структурная изомерия
- •Изомерия положения
- •Геометрическая изомерия (зеркальная, цис- транс- изомерия)
- •Оптическая изомерия
- •Устройство поляриметра
- •Диастереомеры
- •Номенклатура стереоизомеров
- •Номенклатура Кана, Ингольда, Прелога (кип)
- •Номенклатура стереоизомеров Потапова в.М., Терентьева а.П. И сотрудников
- •2(Ρ),3-диоксипропаналь
- •3(Ρ),4-дихлорпентен-4-аль
- •Классификация органических реакций и реагентов
- •По способу разрыва (образования) химических связей.
- •Классификация реакций по типу превращений в органических веществах
- •Свободные радикалы
- •Понятие о граничных структурах
- •Алканы (парафины)
- •Физические свойства
- •Промышленная переработка алканов (нефти)
- •Некоторые лабораторные способы получения алканов
- •Нитрование алканов
- •Строение малых циклов (циклопропан, циклобутан)
- •Некоторые закономерности реакции отщепления
- •Дегидратация спиртов (отщепление воды)
- •Дегалогенирование дигалогенпроизводных
- •Восстановление алкинов (ацетиленов)
- •Расщепление четвертичных аммонийных солей по Гофману
- •Присоединение галогенов
- •Строение диенов
- •Химические свойства диенов
- •Реакции присоединения
- •Механизм реакции [ae] для сопряженных диенов
- •Некоторые аспекты применения сопряженных диенов
- •Алкины (ацетилены)
- •Способы получения ацетилена
- •Некоторые способы получения гомологов ацетилена
- •Общая характеристика реакционной способности ацетиленов
- •Физические свойства ацетилена
- •Химические свойства
- •Реакции присоединения
- •Реакции нуклеофильного присоединения к ацетиленам
- •Некоторые свойства виниловых эфиров
- •Ароматические углеводороды
- •Признаки ароматичности
- •Направление реакций ароматических соединений
- •II стадия:
- •Мнемоническое правилосмещения электронной плотности под действием заместителя в ядре
- •Нуклеофильное замещение в ароматических системах (snAr)
- •Механизм реакции snAr
- •Галогенпроизводные углеводородов
- •Методы получения галогенпроизводных
- •Замещение водорода на галоген в условиях радикальных процессов (прямое галогенирование алканов)
- •Галогенирование непредельных углеводородов
- •Получение галогенпроизводных из непредельных углеводородов
- •Общая характеристика реакционной способности галогенпроизводных
- •Важнейшие реакции галогенпроизводных
- •Образование металлорганических соединений
- •Содержание
Свободные радикалы
Самые реакционноспособные частицы. Строение точно не установлено, однако считается, что оно ближе к sp2-гибридному, чем кsp3-гибридному (достаточно легко вступают в сопряжение с находящимися рядом двойными и тройными связями).
Общая тенденция устойчивости радикалов подобна карбокатионам, т.е. наиболее устойчивы третичные, наименее первичные.
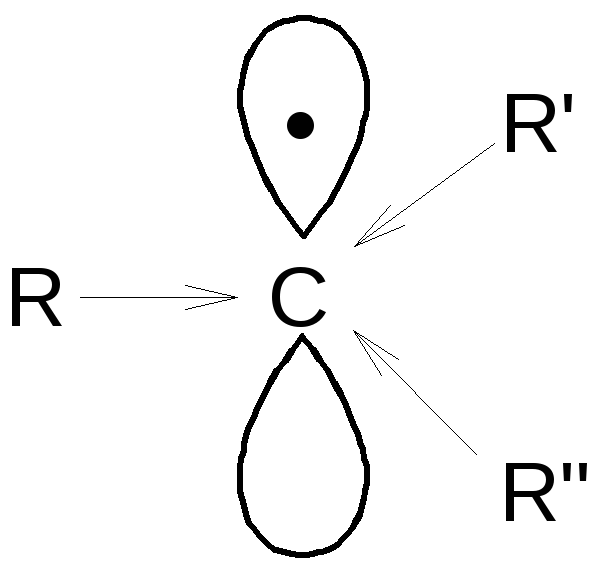
Доноры электронов, подавая электронную плотность, частично спаривают свободно радикальный электрон.
Устойчивость (неустойчивость) частиц с неспаренным электроном (радикалы) или избыточным зарядом (карбокатионы), находящимся рядом с непредельной системой объясняется эффектами сопряжения. Например, известно, что аллильный или бензильный радикал (иликарбокатион) обладают значительной устойчивостью. Для аллильной системы:
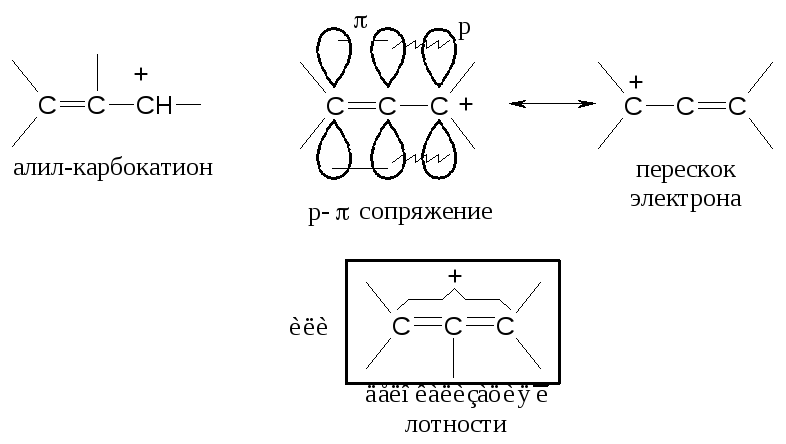
Положительный заряд полностью распределяется между тремя атомами (т.е. на каждом атоме углерода находится по 1/3 заряда).
Аллил значительно более устойчив, чем третичный карбокатион.
Еще более устойчив бензильный карбокатион:
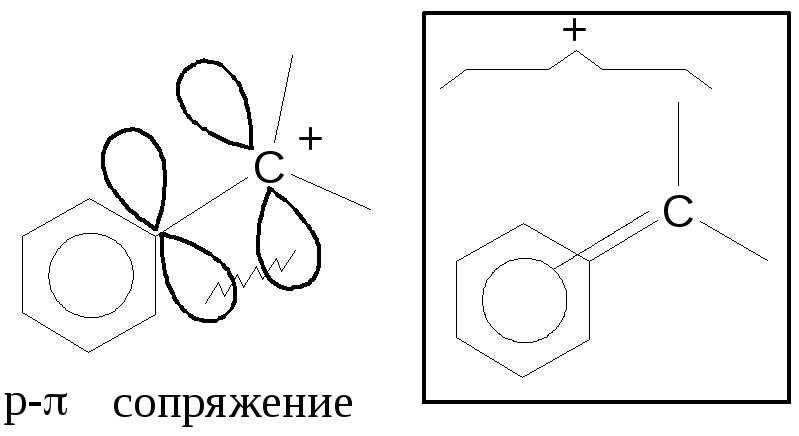
На каждом атоме углерода 1/7 заряда (1/3>1/7!)
Еще более устойчив трифенилметильный карбокатион (или радикал):
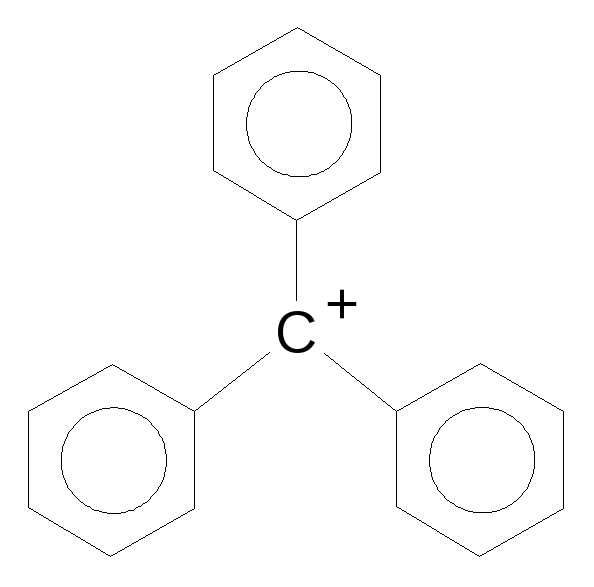
Примечание: данная ароматическая система сопряжена не полностью, т.к. водородные атомы во втором положении трех ароматических ядер отталкиваются, поворачивая плоскость бензольного кольца (трехлопастной пропеллер).
Понятие о граничных структурах
Электронная плотность в сопряженных системах распределяется неравномерно. Это хорошо корелирует с мезомерными структурами, построенными с учетом количества кратных связей содержащихся в молекуле (или частице), и принципа устойчивости (полное сопряжение). Подобные структуры называют граничнымиилирезонансными. Рассмотрим на примере бензильного радикала:
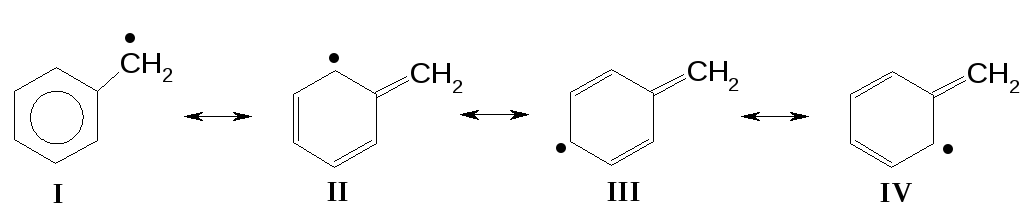
I,II,III,IV- Наиболее устойчивые промежуточные состояния, которые может принимать сопряженная система бензильного радикала. Как правило, каждая граничная структура содержит заряд и количество кратных связей такое же, как и в исходной частице.
Граничные структуры служат для выяснения причин образования изомеров в продуктах реакций, а так же для объяснения устойчивости и реакционной способности конкретного соединения (частицы). Чем большее количество граничных структур соответствует молекуле или частице, тем более она жизнеспособна.
В то же время с помощью резонансных структур можно предсказать вероятные продукты реакции.
Алканы (парафины)
Парафины (parafinus) насыщенные органические соединения, состоящие только из углерода и водорода, малоактивные вещества с общей формулойCnH2n+2.
Алканы бывают разветвленные и неразветвленные (нормального строения)
Изомерные алканы начинаются с бутана С4Н10, который имеет два структурных изомера:
![]()
C53 изомера,
C65 изомеров,
C927 изомеров,
C1075 изомеров.
В алканах длина углерод-углеродной связи 0,154 нм, валентный угол 10928’. Структура атома углерода тетраэдрическая(sp3-гибридный).
Физические свойства
CC4газы,
C5C17жидкости,
С18….твердые вещества.
Газообразные алканы запаха не имеют.
Все жидкие и твердые бесцветные жидкости со специфическим запахом.
Начиная с С5температура кипения каждого последующего гомолога увеличивается на 2025С.
Основной источник алканов в природе природный и попутный газы и нефть.
Длинные алканы входят в состав природного минерала азоперита (воскообразное вещество).
Количество алканов в нефти меняется в зависимости от месторождения. «Белая» нефть содержит больше алканов.
