
- •Глава 1. Комплексные соединения
- •1.1. Основные положения координационной теории
- •1.2. Природа химической связи в комплексном ионе
- •1.2.1. Электростатическая теория
- •1.2.2. Метод валентных связей
- •1.2.3. Метод молекулярных орбиталей
- •1.3. Пространственное строение и изомерия комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Номенклатура комплексных молекул
- •1.6. Диссоциация в растворах
- •1 Ступень
- •2 Ступень
- •1.7. Реакции комплексообразования
- •1.8. Хелатирование. Его роль в биологии и медицине
- •Полидентатные лиганды
- •1.9. Хелатотерапия
Глава 1. Комплексные соединения
Начало классической теории валентности положено немецким химиком Ф. Кекуле. Одно из ключевых её положений – постоянство валентности элементов и насыщаемость химической связи. Классическая теория позволила описать и предсказать множество химических фактов и явлений, свойственных простым бинарным молекулам, как Н2О, NH3, SO3, HCl, CuCl2, SiCl4 (их химическую активность, порядок расположения атомов и т.д.), но она не смогла объяснить механизм образования, свойства и строение более обширного и разнообразного по составу класса сложных соединений высшего порядка (комплексных), являющихся часто продуктами сочетания простых молекул с уже реализованными химическими связями: AlCl3 ∙ 6H2O, Fe(CN)2 ∙ 4KCN, Zn(OH)2 ∙ 2KOH, AgCl ∙ 2NH3. Согласно классической теории, двухвалентная медь, например, должна существовать в виде солей типа CuSO4, CuCl2, Cu(NO3)2, однако в действительности помимо бледно-голубых кристаллов CuSO4, с валентной схемой
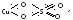
известны ярко-синие кристаллы комплексной соли [Cu(NH3)4]SO4, структура которых не находит объяснения в рамках общепринятых представлений о валентности.
Наиболее удачно строение и свойства комплексных соединений объясняет координационная теория швейцарского химика А. Вернера, предложенная в 1893 году.
1.1. Основные положения координационной теории
Подобно многим имеющим большое значение теориям, координационная теория исключительно проста. Её главный постулат сводится к нескольким моментам:
помимо главных валентностей у атомов имеются побочные валентности, проявляющие себя при некоторых реакциях;
насыщение главных валентностей лежит в основе образования простых соединений первого порядка;
насыщение побочных валентностей лежит в основе образования соединений высшего порядка, комплексных.
А. Вернер писал: «Даже если, судя по числу валентностей, соединительная способность нескольких атомов исчерпана, они все же, в большинстве случаев, могут принимать участие далее в построении сложных молекул с образованием определенных атомных связей. Эту возможность нужно усматривать в том факте, что, наряду со связями сродства, называемыми главной валентностью, между атомами существуют еще другие связи, называемые побочными валентностями…».
В момент опубликования теория Вернера носила формальный характер и не рассматривала вопрос о природе сил, обуславливающих формирование химической связи и механизм возникновения сложных молекул. Развитая в дальнейшем учениками, она стала основой современных воззрений о построении комплексных соединений. Согласно им, в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем или центральным ионом. Вокруг него, в непосредственной близости, расположено (координировано) некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами. Комплексообразователь с окружающими его лигандами образуют внутреннюю координационную сферу комплексного соединения – комплексный ион – [MLn], где М – комплексообразователь; L – окружающие комплексообразователь лиганды; n- их количество.
Для комплекса двухвалентной меди [Cu(NH3)4]SO4 роль комплексообразователя выполняют ионы меди, электронейтральные молекулы аммиака – лиганды. Вместе ионы Cu2+ с молекулами NH3 формируют комплексный ион [Cu(NH3)4]2+. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу. Общая запись формулы комплексного соединения имеет вид: [MLn]Xm, где в квадратные скобки заключаются частицы внутренней сферы, Х – внешнесферные частицы (молекулы или ионы). Для комплекса [Cu(NH3)4]SO4 внешнесферные частицы - ионы SO42–.
В большинстве комплексных соединений комплексообразователями служат ионы переходных металлов (d-элементов), хотя ими могут быть неметаллы в положительной (В3+, Si4+, Р5+, S6+, I7+), реже в отрицательной (I–, S2– и др.) степени окисления: K[BF4], Cs[IСl8], (NH4)2[SiF4]. Комплексообразователями могут выступать и нейтральные атомы. Нейтральными комплексообразователями являются атомы многих элементов побочных подгрупп V, VI, VII, VIII групп периодической системы. Так, к примеру, построены молекулы карбонилов металлов Cr(CO)6, Mn2(CO)10, Fe3(CO)12, Ni(CO)4.
В роли лигандов фигурируют простые (Cl–, Br–, I–, OH–) и сложные (CO32–, S2O32–, SCN–, NO2–) ионы, полярные и легко поляризующиеся в электрическом поле комплексообразователя нейтральные молекулы как неорганической (H2O, NH3, NO, CO), так и органической (NH2CH2CH2NH2, C2H5NH2, C3H5N) природы.
Молекула комплексного соединения в целом электронейтральна. Заряд комплексного иона определяется алгебраической суммой зарядов комплексообразователя и лигандов. Нейтральные молекулы вклада в заряженность иона не вносят:
2+ 6∙1– 3+ 0 0 1– 0 0
[Fe(CN)6]4–, [Cr(H2O)(NH3)4OH]2+, [Ni(CO)4]0 .
По знаку заряда комплексного иона различают: катионные ([Со(NH3)6]3+, [Al(H2O)5OH]2+); анионные ([Al(OH)4]-, [Fe(CN)6]4-) и нейтральные ([Ni(CO)4]0, [Co(NH3)3Cl3]0) комплексы. Последние не содержат внешней сферы и не являются электролитами.
Центральный атом комплексного соединения координирует вокруг себя лиганды внутренней сферы, геометрически правильно располагая их в пространстве. Число лигандов, определенным образом расположенных в пространстве и непосредственно связанных с центральным ионом, называют координационным числом этого иона или координационной валентностью. Более строго: координационное число – это число электронодонорных центров лигандов (атомов и π-связей), непосредственно взаимодействующих с комплексообразователем. Для комплексных соединений с моноцентровыми лигандами координационное число равно числу лигандов (в комплексных ионах [Cu(NH3)4]2+ координационное число меди – 4, в [Fe(CN)6]3+ координационное число железа – 6). В случае полицентровых – числу таких лигандов, умноженному на число электронодонорных центров лиганда (в [Сo(SO4)3]3- координационное число кобальта – 6).
В химии комплексных соединений координационное число играет примерно ту же роль, если лиганд ион, что и валентность в соединениях первого порядка, варьируя от 1 до 12. Обычными координационными числами, встречающимися более чем у 95% комплексов, являются 4 и 6.
Координационное число не является неизменной величиной. Его максимальное значение определяется, главным образом, соотношением сил отталкивания между лигандами, возникающими по мере накопления их в координационной сфере, и уравновешивающими эти силы силами притяжения лигандов к центральному иону. Когда внесение следующего лиганда приводит к такому возрастанию сил отталкивания, которое уже не компенсируется притяжением лигандов к комплексообразователю, координирование прекращается. Следовательно, основными факторами, влияющими на координационное число, являются плотность заряда комплексообразователя, а также размер и заряд (или полярность) лигандов.
В некоторых случаях размер лиганда оказывается намного больше размера центрального иона. Это будет вести к ограничению координационного числа центрального иона, поскольку делает физически невозможным присоединение к нему большого числа лигандов. Показано, что, если отношение радиусов центрального иона (r) и лигандов (r/) меньше 0,155, максимальное координационное число не может превышать двух (рис. 1.1). Однако и в тех случаях, когда отношение радиусов очень мало, основным фактором остается баланс сил притяжения лигандов к комплексообразователю и сил отталкивания между самими лигандами.
С уществует
статистическое правило, связывающее
заряд центрального иона (степень
окисления) и координационное число,
согласно которому (табл. 1.1) характерные
координационные числа чаще всего
превышают заряд центрального иона в
два раза (жирным шрифтом выделены
наиболее часто встречающиеся). Приведенные
значения чисел соответствуют максимальному
насыщению координационной сферы
лигандами и свойственныкоординационно-насыщенным
соединениям. В растворах не всегда
соблюдаются необходимые для этого
условия и тогда образуются
координационно-ненасыщенные
комплексы, с меньшими координационными
числами. Т.е., не являясь постоянной
величиной, координационное число
комплексообразователя, помимо основных
(заряд, размер частиц), зависит еще от
ряда сопутствующих факторов, среди
которых наибольшее значение имеют
концентрация исходных компонентов и
температура раствора.
уществует
статистическое правило, связывающее
заряд центрального иона (степень
окисления) и координационное число,
согласно которому (табл. 1.1) характерные
координационные числа чаще всего
превышают заряд центрального иона в
два раза (жирным шрифтом выделены
наиболее часто встречающиеся). Приведенные
значения чисел соответствуют максимальному
насыщению координационной сферы
лигандами и свойственныкоординационно-насыщенным
соединениям. В растворах не всегда
соблюдаются необходимые для этого
условия и тогда образуются
координационно-ненасыщенные
комплексы, с меньшими координационными
числами. Т.е., не являясь постоянной
величиной, координационное число
комплексообразователя, помимо основных
(заряд, размер частиц), зависит еще от
ряда сопутствующих факторов, среди
которых наибольшее значение имеют
концентрация исходных компонентов и
температура раствора.
Таблица 1.1
Координационные числа некоторых комплексообразователей
|
Ионы |
Степень окисления комплексообразователя |
Характерное координационное число |
|
Au+, Ag+, Cu+ |
+1 |
2 |
|
Cu2+, Hg2+, Pb2+, Pt2+, Pd2+, Zn2+, Ni2+, Co2+ |
+2 |
4; 6 |
|
Fe3+, Al3+, Cr3+ , Co3+, Ni3+ |
+3 |
6; 4 |
|
Mo4+, W4+ |
+4 |
8 |
Число атомов, предоставляемых лигандами для образования координационных связей с комплексообразователем, может быть различным. В большинстве случаев каждый отдельный лиганд присоединяется к центральному иону через один атом (М – L), занимая во внутренней координационной сфере одно место. Координационная ёмкость (число мест) или дентатность такого лиганда равна единице. Лиганды, предоставляющие для связывания с центральным ионом один атом и занимающие во внутренней сфере одно место, называются монодентатными. К монодентатным относятся все одноатомные лиганды: анионы галогенов; анионы CN–, SCN–, OH–; молекулы NH3, H2O, NO, CO и др. Примерами комплексов с монодентатными лигандами служат [Fe(CN)6]3–, [CrCl6]3-:
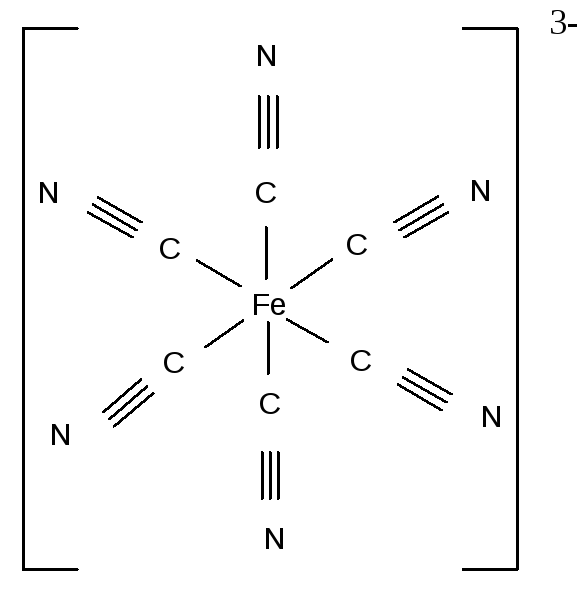
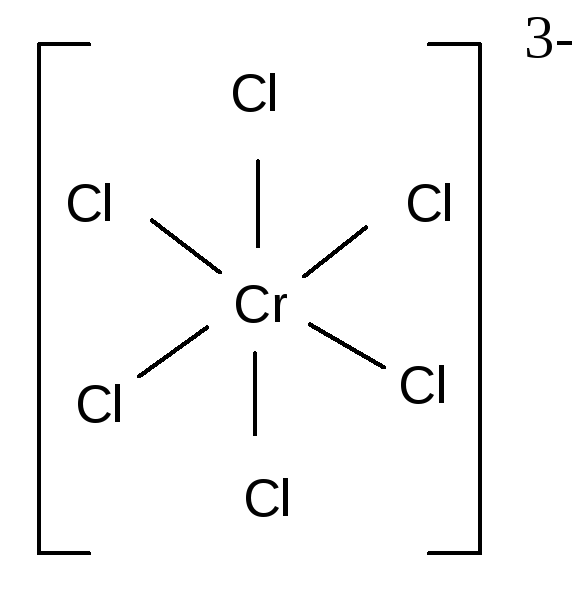
Иные лиганды используют в комплексообразовании два или большее число атомов, занимая в координационной сфере центрального иона два или большее число мест. Такие лиганды называются би- и полидентатными. Бидентатным является оксалат-анион С2О42–, формирующий с катионом-комплексообразователя две связи за счёт двух кислородных атомов:
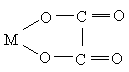 ,
а также этилендиамин, сульфатный,
карбонатный и другие анионы:
,
а также этилендиамин, сульфатный,
карбонатный и другие анионы:
 ,
,
 ,
,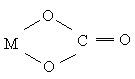
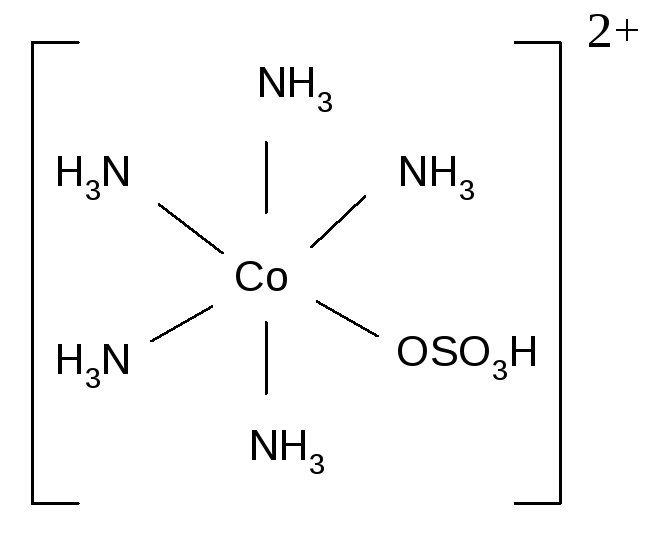
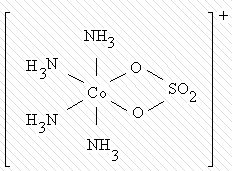
При этом один и тот же лиганд, в зависимости от характера связывания, может быть и моно- и бидентатным:
Примером тетрадентатного лиганда является двухзарядный анион этилендиаминтетрауксусной кислоты (ЭДТА):
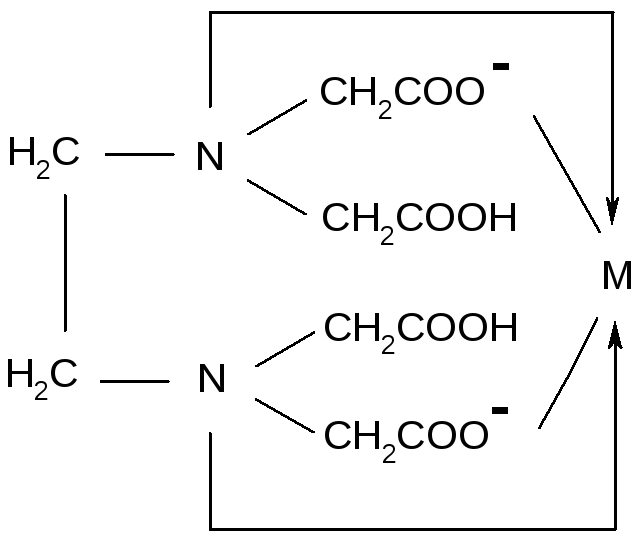
(на этих и последующих схемах обычные ковалентные связи, образованные неспаренными электронами, обозначены черточками, а возникающие по донорно-акцепторному механизму – стрелками). Таким образом, дентатность – это число донорных центров лиганда, участвующего в координации.
